名校
1 . Cr2O 毒性较强,常用NaHSO3处理工业废水中的Cr2O
毒性较强,常用NaHSO3处理工业废水中的Cr2O ,反应的离子方程式为:H+ +Cr2O
,反应的离子方程式为:H+ +Cr2O +HSO
+HSO
 Cr3++SO
Cr3++SO +H2O(未配平),下列关于该反应的说法正确的是
+H2O(未配平),下列关于该反应的说法正确的是
 毒性较强,常用NaHSO3处理工业废水中的Cr2O
毒性较强,常用NaHSO3处理工业废水中的Cr2O ,反应的离子方程式为:H+ +Cr2O
,反应的离子方程式为:H+ +Cr2O +HSO
+HSO
 Cr3++SO
Cr3++SO +H2O(未配平),下列关于该反应的说法正确的是
+H2O(未配平),下列关于该反应的说法正确的是| A.氧化剂和还原剂的计量数之比为3:1 | B.Cr3+是氧化反应的产物 |
C. 发生还原反应 发生还原反应 | D.消耗5 molH+时转移6mol电子 |
您最近一年使用:0次
名校
解题方法
2 . 控制、治理氮氧化物对大气的污染是改善大气质量的证要方面。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物( ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(2)在一密闭容器中发生反应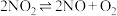 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
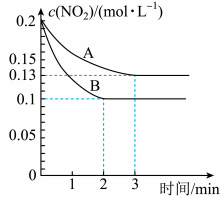
①依曲线A,反应在前3min内氧气的平均反应速率为___________ 。(保留三位有效数字)
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是___________ 。(填“浓度”、“压强”、“温度”或“催化剂”)
③曲线A、B分别对应的反应平衡常数的大小关系是
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(3)一定温度下,密闭容器中 可发生以下反应:
可发生以下反应:
 I
I
 Ⅱ
Ⅱ
那么反应I的平衡常数表达式为___________ 。假设达平衡时, ,
,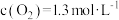 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为___________ , (g)的起始浓度不低于
(g)的起始浓度不低于___________  。
。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(
 ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为(2)在一密闭容器中发生反应
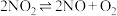 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是
③曲线A、B分别对应的反应平衡常数的大小关系是

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(3)一定温度下,密闭容器中
 可发生以下反应:
可发生以下反应: I
I Ⅱ
Ⅱ那么反应I的平衡常数表达式为
 ,
,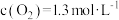 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为 (g)的起始浓度不低于
(g)的起始浓度不低于 。
。
您最近一年使用:0次
2024-04-05更新
|
69次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三下学期3月月考化学试题
名校
3 . 用低品铜矿(主要含 、
、 )制备
)制备 的一种工艺流程如下:
的一种工艺流程如下:
 、
、 )制备
)制备 的一种工艺流程如下:
的一种工艺流程如下: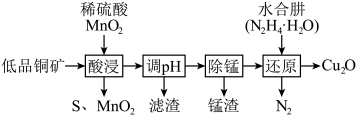
A.“酸浸”过程中 发生反应的离子方程式为 发生反应的离子方程式为 |
B.“调 ”的目的是除去溶液中的 ”的目的是除去溶液中的 |
C.使用 溶液“除锰”时,锰渣中可能会含有少量 溶液“除锰”时,锰渣中可能会含有少量 |
| D.“还原”过程中参与反应的氧化剂和还原剂的物质的量之比为2:1 |
您最近一年使用:0次
2024-02-17更新
|
209次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2023-2024学年高一下学期3月月考化学试题
名校
4 . 下表列出了五种燃煤烟气脱硫的方法。
(1)方法Ⅰ中吸收 后的溶液通过
后的溶液通过___________ (填字母)可使吸收液再生。
a.加热 b.加入适量NaOH c.通入
(2)方法Ⅱ中CO还原 反应的化学方程式为
反应的化学方程式为___________ 。
(3)方法Ⅲ在脱硫塔中进行,在脱硫的同时可得到产品硫酸。由于 对热不稳定,且硫酸浓度大也会导致其分解产生
对热不稳定,且硫酸浓度大也会导致其分解产生 ,需定时向脱硫塔中补充
,需定时向脱硫塔中补充___________ 。
(4)方法Ⅳ按如图所示方式,将含有 烟气和NaClO碱性溶液通入反应釜。
烟气和NaClO碱性溶液通入反应釜。___________ 。
②反应釜中采用“气-液逆流”接触吸收法的优点是___________ 。
(5)工业上方法Ⅴ的转化流程如下:___________ 。
②若用NaOH溶液代替 悬浊液,增加了生产成本,但可以防止
悬浊液,增加了生产成本,但可以防止___________ 。
| 方法Ⅰ | 用 溶液吸收 溶液吸收 |
| 方法Ⅱ | 用生物质热解气(主要成分为CO、 、 、 )将 )将 在高温下还原成S 在高温下还原成S |
| 方法Ⅲ | 用 溶液吸收 溶液吸收 |
| 方法Ⅳ | 用NaClO碱性溶液吸收 |
| 方法Ⅴ | 石灰-石膏法吸收 |
(1)方法Ⅰ中吸收
 后的溶液通过
后的溶液通过a.加热 b.加入适量NaOH c.通入

(2)方法Ⅱ中CO还原
 反应的化学方程式为
反应的化学方程式为(3)方法Ⅲ在脱硫塔中进行,在脱硫的同时可得到产品硫酸。由于
 对热不稳定,且硫酸浓度大也会导致其分解产生
对热不稳定,且硫酸浓度大也会导致其分解产生 ,需定时向脱硫塔中补充
,需定时向脱硫塔中补充(4)方法Ⅳ按如图所示方式,将含有
 烟气和NaClO碱性溶液通入反应釜。
烟气和NaClO碱性溶液通入反应釜。
②反应釜中采用“气-液逆流”接触吸收法的优点是
(5)工业上方法Ⅴ的转化流程如下:

②若用NaOH溶液代替
 悬浊液,增加了生产成本,但可以防止
悬浊液,增加了生产成本,但可以防止
您最近一年使用:0次
2024-01-24更新
|
314次组卷
|
2卷引用:湖南省常德市津市市第一中学2023-2024学年高一下学期4月份月考化学试卷
名校
5 . 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr2O (橙红色)、CrO
(橙红色)、CrO (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡:Cr2O
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+
+2H+
回答下列问题:
(1)探究外界因素对该平衡的影响。取三支相同(标号1,2,3)试管盛有相同体积K2Cr2O7溶液进行实验,完成表格中的填空。
(2)利用(1)中所得溶液A、B探究pH对K2Cr2O7溶液的氧化性强弱的影响。完成表格中的填空。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl−,利用Ag+与CrO 生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中c(Ag+)=2.0×10−5 mol·L−1时,此时溶液中c(CrO
生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中c(Ag+)=2.0×10−5 mol·L−1时,此时溶液中c(CrO )等于
)等于_______ mol·L−1.[已知Ksp(Ag2CrO4)=2.0×10−12 ]
 (橙红色)、CrO
(橙红色)、CrO (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡:Cr2O
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+
+2H+回答下列问题:
(1)探究外界因素对该平衡的影响。取三支相同(标号1,2,3)试管盛有相同体积K2Cr2O7溶液进行实验,完成表格中的填空。
| 实验操作 | 实验现象 | 实验结论 |
| 向试管1中加入几滴浓NaOH溶液,得溶液A | ①溶液变为 | 其他条件不变时,减小生成物浓度,平衡向正反应方向移动 |
| 向试管2中加入几滴较浓H2SO4溶液,得溶液B | ②溶液变为 | ③其他条件不变时, |
| 向试管2中加入FeSO4,再加入适量NaOH溶液 | ④先形成蓝紫色溶液,加入NaOH溶液后产生沉淀的成分为Fe(OH)3和 | K2Cr2O7溶液具有氧化性 |
| 实验操作 | 实验现象 | 实验结论 |
| 向上述溶液A、B中分别加入相同量甲醇溶液 | 溶液A无明显现象,溶液B形成蓝紫色溶液,产生CO2 | ① ②B中反应的离子方程式: |
 生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中c(Ag+)=2.0×10−5 mol·L−1时,此时溶液中c(CrO
生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中c(Ag+)=2.0×10−5 mol·L−1时,此时溶液中c(CrO )等于
)等于
您最近一年使用:0次
名校
6 . 某小组为了探究影响 溶液与
溶液与 溶液在酸性[所用试剂浓度:
溶液在酸性[所用试剂浓度:
 ]条件下反应速率的因素,设计的实验方案如表所示。混合溶液的体积变化忽略不计,下列说法错误的是
]条件下反应速率的因素,设计的实验方案如表所示。混合溶液的体积变化忽略不计,下列说法错误的是
 溶液与
溶液与 溶液在酸性[所用试剂浓度:
溶液在酸性[所用试剂浓度:
 ]条件下反应速率的因素,设计的实验方案如表所示。混合溶液的体积变化忽略不计,下列说法错误的是
]条件下反应速率的因素,设计的实验方案如表所示。混合溶液的体积变化忽略不计,下列说法错误的是| 实验 编号 | 实验 温度/K | 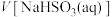 |  | 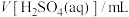 | 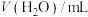 | 褪色时间 /min |
| 1 | 298 | 4.0 | 2 | 2 |  | 8 |
| 2 | 298 | 5.0 | 2 | 2 | 1 | 6 |
| 3 | 303 | 5.0 |  | 2 | 1 | 2 |
A. |
B.该反应的离子方程式为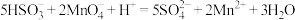 |
C.实验1中 的反应速率为 的反应速率为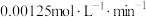 |
| D.实验2和3探究的是温度对反应速率的影响 |
您最近一年使用:0次
2023-12-21更新
|
401次组卷
|
4卷引用:湖南省常德市安乡县第一中学2023-2024学年高三上学期12月月考化学试题
名校
7 . 氧化还原反应在日常生活和工业生产中有重要应用。
I. 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: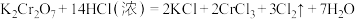 。
。
(1)该反应中被氧化的元素是_______ ,还原产物是_______ 。
(2)该反应中氧化剂与还原剂的个数比为_______ 。
(3)生成标准状况下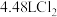 ,转移的电子个数为
,转移的电子个数为_______ (用 表示)。
表示)。
II.阅读下面一段材料并回答问题。
(4)K2FeO4中铁元素的化合价为_______ 。
(5)下列关于K2FeO4的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:_______ 。
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
I.
 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: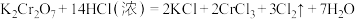 。
。(1)该反应中被氧化的元素是
(2)该反应中氧化剂与还原剂的个数比为
(3)生成标准状况下
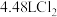 ,转移的电子个数为
,转移的电子个数为 表示)。
表示)。II.阅读下面一段材料并回答问题。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准 |
(5)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
您最近一年使用:0次
名校
8 . 磷酸亚铁锂(LiFePO4)是比亚迪“刀片电池”的电极材料,可以硫铁矿(主要成分是FeS2,含少量Al2O3、SiO2和Fe3O4)为原料制备,流程如图:

已知:几种金属离子沉淀的pH如表所示:
请回答下列问题:
(1)焙烧的目的是___________ 。
(2)从焙烧到氧化要经历一系列步骤,请从下列步骤选择正确的步骤并合理排序___________ ,其中要经历的“还原”步骤中反应的离子方程式为___________ 。

(3)试剂“R”是一种氧化剂,最好选择___________ 。
(4)流程中在“高温煅烧”条件下,由FePO4制备LiFePO4的化学方程式为___________ 。不能用铁粉代替草酸,其原因是___________ 。
(5)产品LiFePO4纯度的测定。分别取7.000g试样,用稀硫酸溶解,滴加二胺磺酸钠指示剂,用0.3000 mol/L K2Cr2O7溶液滴定至溶液由浅绿变为蓝紫,平均消耗K2Cr2O7溶液20.00 mL。
①产品的纯度为___________ 。(精确到0.01%)
②测定结果偏低的原因可能是___________ 。
A.产品在空气中放置时间过长 B.滴定前仰视读数
C.滴定达终点时发现滴定管尖嘴内有气泡生成 D.滴定管没有用标准液润洗

已知:几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 2.3 | 7.5 | 4.0 |
| 刚好完全沉淀pH | 4.1 | 9.7 | 5.2 |
(1)焙烧的目的是
(2)从焙烧到氧化要经历一系列步骤,请从下列步骤选择正确的步骤并合理排序

(3)试剂“R”是一种氧化剂,最好选择
(4)流程中在“高温煅烧”条件下,由FePO4制备LiFePO4的化学方程式为
(5)产品LiFePO4纯度的测定。分别取7.000g试样,用稀硫酸溶解,滴加二胺磺酸钠指示剂,用0.3000 mol/L K2Cr2O7溶液滴定至溶液由浅绿变为蓝紫,平均消耗K2Cr2O7溶液20.00 mL。
①产品的纯度为
②测定结果偏低的原因可能是
A.产品在空气中放置时间过长 B.滴定前仰视读数
C.滴定达终点时发现滴定管尖嘴内有气泡生成 D.滴定管没有用标准液润洗
您最近一年使用:0次
名校
解题方法
9 . 铋酸钠(NaBiO3)是分析化学中的重要试剂,某实验小组在实验室用Cl2氧化Bi(OH)3制备NaBiO3,并探究其氧化性。
Ⅰ.查阅资料:
①NaBiO3固体不溶于冷水,加沸水会分解,遇酸则迅速分解,在酸性条件下能将Mn2+氧化为MnO 。
。
②Bi(OH)3为白色难溶于水的固体。
Ⅱ.制备NaBiO3 (夹持等装置略)
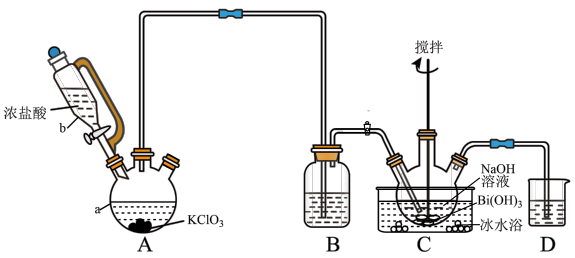
(1)装置A中,仪器b的名称___________ ,写出装置A中反应的离子方程式___________ 。
(2)若没有B装置,可能产生的影响是___________ 。
(3)装置C中Cl2发生的主要反应化学方程式为___________ ,另外还有Cl2+2NaOH = NaCl+NaClO+H2O。
(4)反应结束后,装置C中的浊液经过滤、___________ 、干燥得NaBiO3粗产品。
Ⅲ.测定NaBiO3产品纯度
取上述NaBiO3粗产品wg,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用c mol/L的H2C2O4标准溶液滴定生成的MnO ,平均消耗V mL标准溶液。
,平均消耗V mL标准溶液。
(5)该产品的纯度为___________ %(用含w、c、V的代数式表示)。
Ⅳ.探究NaBiO3的氧化性
(6)取少量装置 C中反应后的悬浊液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2.该实验___________ (填“能”或“不能”)证明一定是NaBiO3氧化了Cl-,理由是___________ 。
Ⅰ.查阅资料:
①NaBiO3固体不溶于冷水,加沸水会分解,遇酸则迅速分解,在酸性条件下能将Mn2+氧化为MnO
 。
。②Bi(OH)3为白色难溶于水的固体。
Ⅱ.制备NaBiO3 (夹持等装置略)

(1)装置A中,仪器b的名称
(2)若没有B装置,可能产生的影响是
(3)装置C中Cl2发生的主要反应化学方程式为
(4)反应结束后,装置C中的浊液经过滤、
Ⅲ.测定NaBiO3产品纯度
取上述NaBiO3粗产品wg,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用c mol/L的H2C2O4标准溶液滴定生成的MnO
 ,平均消耗V mL标准溶液。
,平均消耗V mL标准溶液。(5)该产品的纯度为
Ⅳ.探究NaBiO3的氧化性
(6)取少量装置 C中反应后的悬浊液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2.该实验
您最近一年使用:0次
名校
10 . 据文献报道,某反应的反应历程如图所示,下列有关该历程的说法正确的是


A. 可以加快反应速率 可以加快反应速率 |
| B.在该循环中有6种中间产物 |
C.总反应的化学方程式为 |
D.分解反应 的反应过程中一定有氮氮键断裂 的反应过程中一定有氮氮键断裂 |
您最近一年使用:0次
2023-10-17更新
|
222次组卷
|
2卷引用:湖南省常德市第一中学2024届高三上学期第四次月考化学试题



