1 . 改善大气质量、进行污水处理和将垃圾资源化等要靠化学等科学的发展。
(1)为了保护环境,防治酸雨的方法是减少________ 的排放(填“ ”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用
”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用________ 。(填“ ”或“氟氯代烷”)
”或“氟氯代烷”)
(2)垃圾是放错地方的资源。下列垃圾处理方式正确的是________ (填字母代号)。
a.回收利用易拉罐 b.焚烧废旧报纸 c.随意丢弃废旧电池
我国“十四五”规划中已明确提到“碳达峰”、“碳中和”的目标,请回答下列问题:
(3)写出碳元素的两种同素异形体名称________ 。(任写两种)
(4)“碳达峰”、“碳中和”的“碳”主要指的具体物质是________ ,其所属物质类别为________ 。(填写下列正确的选项代号)
A.电解质 B.非电解质 C.酸性氧化物
(5)我国科学家合成一种新型催化剂,将二氧化碳和水反应生成甲烷和氧气,该反应的化学方程为:________ ,该反应中还原剂是________ 。
(6)某化学兴趣小组同学将燃烧的镁条插入盛满 的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为
的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为 ,试用双线桥分析该反应电子的得失及数目:
,试用双线桥分析该反应电子的得失及数目:________ 。
(1)为了保护环境,防治酸雨的方法是减少
 ”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用
”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用 ”或“氟氯代烷”)
”或“氟氯代烷”)(2)垃圾是放错地方的资源。下列垃圾处理方式正确的是
a.回收利用易拉罐 b.焚烧废旧报纸 c.随意丢弃废旧电池
我国“十四五”规划中已明确提到“碳达峰”、“碳中和”的目标,请回答下列问题:

(3)写出碳元素的两种同素异形体名称
(4)“碳达峰”、“碳中和”的“碳”主要指的具体物质是
A.电解质 B.非电解质 C.酸性氧化物
(5)我国科学家合成一种新型催化剂,将二氧化碳和水反应生成甲烷和氧气,该反应的化学方程为:
(6)某化学兴趣小组同学将燃烧的镁条插入盛满
 的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为
的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为 ,试用双线桥分析该反应电子的得失及数目:
,试用双线桥分析该反应电子的得失及数目:
您最近一年使用:0次
2 . 某研究小组以TiCl4为原料制备新型耐热材料TiN。
步骤一:TiCl4水解制备TiO2(实验装置如图A,夹持装置省略):滴入TiCl4,边搅拌边加热,使混合液升温至80℃,保温3小时。离心分离白色沉淀TiO2·xH2O并洗涤,煅烧制得TiO2。
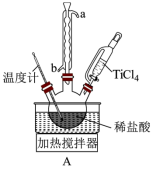
(1)装置A中冷凝水的入口为_______ (填“a”或“b”)。
(2)三颈烧瓶中预置的稀盐酸可抑制胶体形成、促进白色沉淀生成。 水解生成的胶体主要成分为
水解生成的胶体主要成分为_______ (填化学式)。
(3)判断 沉淀是否洗涤干净,可使用的检验试剂有
沉淀是否洗涤干净,可使用的检验试剂有_______ 。
步骤二:由 制备TiN并测定产率(实验装置如下图,夹持装置省略)。
制备TiN并测定产率(实验装置如下图,夹持装置省略)。

(4)装置C中试剂X为_______ 。
(5)装置D中反应生成TiN、N2和H2O,该反应的化学方程式为_______ 。
(6)装置E的作用是吸收水和_______ 。
(7)实验中部分操作如下:
a.反应前,称取0.800gTiO2样品; b.打开装置B中恒压滴液漏斗旋塞;
c.关闭装置B中恒压滴液漏斗旋塞; d.打开管式炉加热开关,加热至800℃左右;
e.关闭管式炉加热开关,待装置冷却; f.反应后,称得瓷舟中固体质量为0.496g。
①正确的操作顺序为:a→b→d→c→c→f。
②TiN的产率为_______ 。
步骤一:TiCl4水解制备TiO2(实验装置如图A,夹持装置省略):滴入TiCl4,边搅拌边加热,使混合液升温至80℃,保温3小时。离心分离白色沉淀TiO2·xH2O并洗涤,煅烧制得TiO2。

(1)装置A中冷凝水的入口为
(2)三颈烧瓶中预置的稀盐酸可抑制胶体形成、促进白色沉淀生成。
 水解生成的胶体主要成分为
水解生成的胶体主要成分为(3)判断
 沉淀是否洗涤干净,可使用的检验试剂有
沉淀是否洗涤干净,可使用的检验试剂有步骤二:由
 制备TiN并测定产率(实验装置如下图,夹持装置省略)。
制备TiN并测定产率(实验装置如下图,夹持装置省略)。
(4)装置C中试剂X为
(5)装置D中反应生成TiN、N2和H2O,该反应的化学方程式为
(6)装置E的作用是吸收水和
(7)实验中部分操作如下:
a.反应前,称取0.800gTiO2样品; b.打开装置B中恒压滴液漏斗旋塞;
c.关闭装置B中恒压滴液漏斗旋塞; d.打开管式炉加热开关,加热至800℃左右;
e.关闭管式炉加热开关,待装置冷却; f.反应后,称得瓷舟中固体质量为0.496g。
①正确的操作顺序为:a→b→d→c→c→f。
②TiN的产率为
您最近一年使用:0次
名校
3 . 叠氮化钠( )是一种防腐剂和分析试剂,在有机合成和汽车行业有着重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
)是一种防腐剂和分析试剂,在有机合成和汽车行业有着重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
查阅资料:
①氨基钠(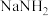 )熔点为208℃,易潮解和氧化;
)熔点为208℃,易潮解和氧化; 有强氧化性,不与酸、碱反应;叠氮酸(
有强氧化性,不与酸、碱反应;叠氮酸( )不稳定,易分解爆炸;
)不稳定,易分解爆炸;
② ,
, 。
。
回答下列问题:
I.制备
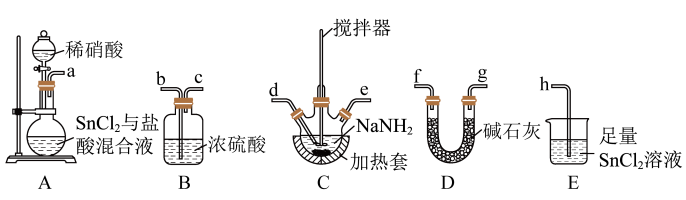
(1)按气流方向,上述装置合理的连接顺序为___________ (填仪器接口字母)。
(2)D的作用为___________ 。
(3)实验时E中生成 沉淀,反应的化学方程式为
沉淀,反应的化学方程式为___________ 。
Ⅱ.用如图所示装置测定产品纯度
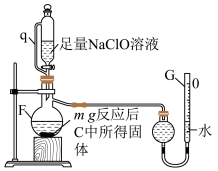
(4)仪器F的名称为___________ ;其中反应的离子方程式为___________ 。
(5)管q的作用为___________ 。
(6)若G的初始读数为 、末读数为
、末读数为 ,本实验条件下气体摩尔体积为
,本实验条件下气体摩尔体积为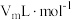 ,则产品中
,则产品中 的质量分数为
的质量分数为___________ 。
 )是一种防腐剂和分析试剂,在有机合成和汽车行业有着重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
)是一种防腐剂和分析试剂,在有机合成和汽车行业有着重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。查阅资料:
①氨基钠(
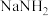 )熔点为208℃,易潮解和氧化;
)熔点为208℃,易潮解和氧化; 有强氧化性,不与酸、碱反应;叠氮酸(
有强氧化性,不与酸、碱反应;叠氮酸( )不稳定,易分解爆炸;
)不稳定,易分解爆炸;②
 ,
, 。
。回答下列问题:
I.制备


(1)按气流方向,上述装置合理的连接顺序为
(2)D的作用为
(3)实验时E中生成
 沉淀,反应的化学方程式为
沉淀,反应的化学方程式为Ⅱ.用如图所示装置测定产品纯度

(4)仪器F的名称为
(5)管q的作用为
(6)若G的初始读数为
 、末读数为
、末读数为 ,本实验条件下气体摩尔体积为
,本实验条件下气体摩尔体积为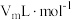 ,则产品中
,则产品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
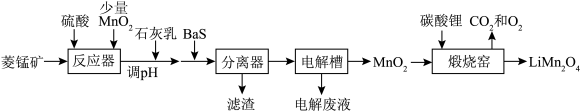
4 .  作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
已知常温下部分物质的 如表。
如表。
回答下列问题:
(1)基态Mn原子的价电子轨道表示式为______ 。
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是______ ;若测得溶液中 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于______ 。(已知:离子浓度小于等于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)
(3)加入少量BaS溶液除去 ,生成的沉淀有
,生成的沉淀有______ (填化学式)。
(4)具有强氧化性的过一硫酸( )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ (已知: 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。
(5)煅烧窑中,生成 反应的化学方程式是
反应的化学方程式是______ 。
(6) 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。
由此可以确定,在上述温度范围内,锰元素的平均价态的变化情况是______ 。
 作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
已知常温下部分物质的
 如表。
如表。物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)基态Mn原子的价电子轨道表示式为
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是
 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)(3)加入少量BaS溶液除去
 ,生成的沉淀有
,生成的沉淀有(4)具有强氧化性的过一硫酸(
 )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。(5)煅烧窑中,生成
 反应的化学方程式是
反应的化学方程式是(6)
 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。T/℃ |
|
|
|
700 | 5.56 | 44.58 | 49.86 |
750 | 2.56 | 44.87 | 52.57 |
800 | 5.50 | 44.17 | 50.33 |
850 | 6.22 | 44.40 | 49.38 |
您最近一年使用:0次
2024-02-25更新
|
821次组卷
|
3卷引用:湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题
湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题
5 . 发蓝工艺是一种材料保护技术,钢铁零件的发蓝处理实质是使钢铁表面通过氧化反应,生成有一定厚度、均匀、致密、附着力强、耐腐蚀性能好的深蓝色氧化膜。钢铁零件经历如图转化进行发蓝处理,已知 的还原产物为
的还原产物为 。下列说法正确的是
。下列说法正确的是
 的还原产物为
的还原产物为 。下列说法正确的是
。下列说法正确的是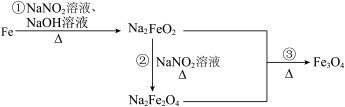
A.钢铁零件发蓝处理所得的深蓝色氧化膜是 |
| B.反应①中氧化剂和还原剂的物质的量之比为3∶1 |
C.反应②的离子方程式为 |
| D.反应③属于氧化还原反应 |
您最近一年使用:0次
名校
解题方法
6 . 某废料铁泥主要成分为 、FeO和Fe,其他杂质不与硫酸反应。现取wg废料铁泥提取
、FeO和Fe,其他杂质不与硫酸反应。现取wg废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
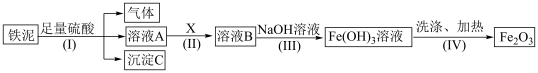
(1)分离溶液A和沉淀C的操作名称是___________ ,步骤(Ⅰ)中FeO与硫酸的反应的离子方程式:___________ 。
(2)检验溶液A中含有 可选用的试剂是___________(填字母)。
可选用的试剂是___________(填字母)。
(3)步骤(Ⅲ)中生成的 固体的颜色是
固体的颜色是___________ 。
(4)步骤(Ⅱ)中加入的试剂X的作用是___________ ,若试剂X为 ,请写出该步骤反应的离子方程式
,请写出该步骤反应的离子方程式___________ 。
(5)若最终获得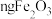 ,则铁泥中铁元素的质量分数为
,则铁泥中铁元素的质量分数为___________ (用含n和w的代数式表示)。
 、FeO和Fe,其他杂质不与硫酸反应。现取wg废料铁泥提取
、FeO和Fe,其他杂质不与硫酸反应。现取wg废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
(1)分离溶液A和沉淀C的操作名称是
(2)检验溶液A中含有
 可选用的试剂是___________(填字母)。
可选用的试剂是___________(填字母)。A.酸性 溶液 溶液 | B. 溶液 溶液 | C.铁粉 | D.KSCN溶液 |
(3)步骤(Ⅲ)中生成的
 固体的颜色是
固体的颜色是(4)步骤(Ⅱ)中加入的试剂X的作用是
 ,请写出该步骤反应的离子方程式
,请写出该步骤反应的离子方程式(5)若最终获得
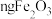 ,则铁泥中铁元素的质量分数为
,则铁泥中铁元素的质量分数为
您最近一年使用:0次
2024-02-23更新
|
113次组卷
|
2卷引用:湖南省浏阳市2023-2024学年高一上学期期末考试化学试题
名校
解题方法
7 .  在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿(主要成分为
在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿(主要成分为 ,还含有
,还含有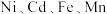 等元素)制备。工艺如图所示:
等元素)制备。工艺如图所示:
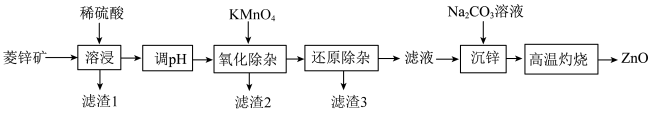
相关金属离子 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如表:
范围如表:
已知:①“溶浸”后的溶液中金属离子主要有: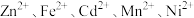 。
。
②弱酸性溶液中 能将
能将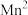 氧化生成
氧化生成 。
。
③氧化性顺序: 。
。
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为___________ , 溶于氨水生成
溶于氨水生成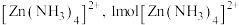 含有
含有___________  键。
键。
(2)“调 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量___________ (填化学式)调节至弱酸性(pH为5.5)。此时溶液中 的最大浓度是
的最大浓度是___________ 。
(3)加 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和___________ 。
(4)“还原除杂”除去的离子是___________ 。
(5)生成碱式碳酸锌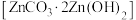 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式___________ 。碱式碳酸锌灼烧后得到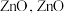 的一种晶体的晶胞是立方晶胞(如图所示),其中与锌原子距离最近的氧原子数有
的一种晶体的晶胞是立方晶胞(如图所示),其中与锌原子距离最近的氧原子数有___________ 个,请在图中画出该晶胞沿 轴方向的平面投影图
轴方向的平面投影图___________ 。

 在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿(主要成分为
在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿(主要成分为 ,还含有
,还含有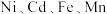 等元素)制备。工艺如图所示:
等元素)制备。工艺如图所示:
相关金属离子
 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如表:
范围如表:| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 1.5 | 6.3 | 6.0 | 7.4 | 8.1 | 6.9 |
沉淀完全的 | 2.8 | 8.3 | 8.0 | 9.4 | 10.1 | 8.9 |
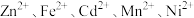 。
。②弱酸性溶液中
 能将
能将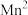 氧化生成
氧化生成 。
。③氧化性顺序:
 。
。(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为 溶于氨水生成
溶于氨水生成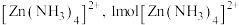 含有
含有 键。
键。(2)“调
 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量 的最大浓度是
的最大浓度是(3)加
 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和(4)“还原除杂”除去的离子是
(5)生成碱式碳酸锌
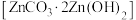 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式 的一种晶体的晶胞是立方晶胞(如图所示),其中与锌原子距离最近的氧原子数有
的一种晶体的晶胞是立方晶胞(如图所示),其中与锌原子距离最近的氧原子数有 轴方向的平面投影图
轴方向的平面投影图
您最近一年使用:0次
2024-02-23更新
|
493次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高三上学期一模化学试题
名校
8 . I.铝土矿是工业上制备金属铝的主要原料,其主要成分是 ,同时还含有
,同时还含有 、
、 。工业上可使用碱浸法提取铝土矿中的
。工业上可使用碱浸法提取铝土矿中的 ,其工业流程如图所示。根据图示信息,请回答下列问题:
,其工业流程如图所示。根据图示信息,请回答下列问题:_______ ,滤渣B的主要成分是_______ (填化学式)。
(2)实验室中进行煅烧时最适合用来盛放 固体的实验仪器名称是
固体的实验仪器名称是_______ 。
(3)用 与C、
与C、 在高温条件下反应可制取
在高温条件下反应可制取 ,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是
,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是_______ 。
Ⅱ.高铁酸钾( )具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程: 的部分性质如下:
的部分性质如下:
(4)写出①中发生的离子方程式:_______ 。
(5)②中加入NaOH固体的目的是_______ (填字母序号)
A.加入NaOH固体做氧化剂
B.为后续反应提供碱性环境
C.NaOH固体溶解时会放出较多的热量,有利于后续生成
(6)完成④中反应的离子方程式:_______ 。
(7)⑥中洗涤时,洗涤剂最好选用_______(填字母序号)。
(8)现取洗涤并干燥后 样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
 ,同时还含有
,同时还含有 、
、 。工业上可使用碱浸法提取铝土矿中的
。工业上可使用碱浸法提取铝土矿中的 ,其工业流程如图所示。根据图示信息,请回答下列问题:
,其工业流程如图所示。根据图示信息,请回答下列问题: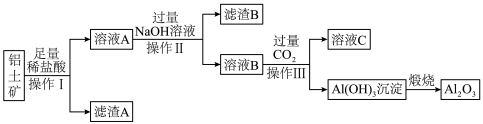
(2)实验室中进行煅烧时最适合用来盛放
 固体的实验仪器名称是
固体的实验仪器名称是(3)用
 与C、
与C、 在高温条件下反应可制取
在高温条件下反应可制取 ,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是
,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是Ⅱ.高铁酸钾(
 )具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程: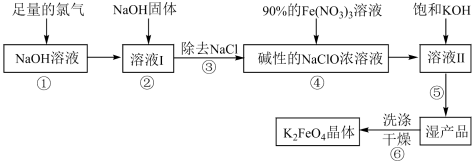
 的部分性质如下:
的部分性质如下:溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
稳定性 | 温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中Fe变为+3价并放出 |
(4)写出①中发生的离子方程式:
(5)②中加入NaOH固体的目的是
A.加入NaOH固体做氧化剂
B.为后续反应提供碱性环境
C.NaOH固体溶解时会放出较多的热量,有利于后续生成

(6)完成④中反应的离子方程式:
(7)⑥中洗涤时,洗涤剂最好选用_______(填字母序号)。
A. | B.KOH溶液 | C.异丙醇 | D. 溶液 溶液 |
(8)现取洗涤并干燥后
 样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近一年使用:0次
2024-02-20更新
|
195次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高一下学期选科适应性检测化学试卷
名校
9 . 连二亚硫酸钠 也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取
也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取 。
。
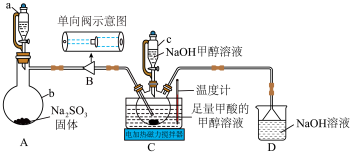
回答下列问题:
(1)仪器a的名称是___________ 。
(2)单向阀的作用是___________ ,制备保险粉前先打开仪器a的活塞的目的是___________ 。
(3)已知三颈烧瓶中的甲酸转化为 ,写出生成
,写出生成 的化学方程式:
的化学方程式:___________ 。
(4) 是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:
是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:___________ 。
(5) 固体隔绝空气加热使之完全分解得到固体产物
固体隔绝空气加热使之完全分解得到固体产物 、
、 和
和 气体,设计实验方案检验产物中含有的
气体,设计实验方案检验产物中含有的 :
:___________ (写出实验操作、现象及结论)。
(6)称取粗产品 加水溶解,用NaOH溶液碱化后,加入一定量的
加水溶解,用NaOH溶液碱化后,加入一定量的 溶液恰好完全反应
溶液恰好完全反应 ,将溶液中生成的纳米级的银粉干燥后称重,得到
,将溶液中生成的纳米级的银粉干燥后称重,得到 银,则粗产品中连二亚硫酸钠的纯度为
银,则粗产品中连二亚硫酸钠的纯度为___________ (用含 、
、 的表达式)。
的表达式)。
 也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取
也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取 。
。
回答下列问题:
(1)仪器a的名称是
(2)单向阀的作用是
(3)已知三颈烧瓶中的甲酸转化为
 ,写出生成
,写出生成 的化学方程式:
的化学方程式:(4)
 是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:
是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:(5)
 固体隔绝空气加热使之完全分解得到固体产物
固体隔绝空气加热使之完全分解得到固体产物 、
、 和
和 气体,设计实验方案检验产物中含有的
气体,设计实验方案检验产物中含有的 :
:(6)称取粗产品
 加水溶解,用NaOH溶液碱化后,加入一定量的
加水溶解,用NaOH溶液碱化后,加入一定量的 溶液恰好完全反应
溶液恰好完全反应 ,将溶液中生成的纳米级的银粉干燥后称重,得到
,将溶液中生成的纳米级的银粉干燥后称重,得到 银,则粗产品中连二亚硫酸钠的纯度为
银,则粗产品中连二亚硫酸钠的纯度为 、
、 的表达式)。
的表达式)。
您最近一年使用:0次
名校
解题方法
10 . 金属镓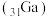 应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝原子核外共有___________ 种不同能量的电子。用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如: 。常温下
。常温下 的金属性比
的金属性比 的金属性
的金属性___________ (选填“强”、“弱”)。利用上述方法可制取 的主要原因是
的主要原因是___________ 。
A.高温时 的活泼性大于
的活泼性大于 B.高温有利于
B.高温有利于 分解
分解
C.高温时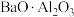 比
比 稳定 D.Ba的沸点比
稳定 D.Ba的沸点比 的低
的低
(2)下列有关镓和镓的化合物的说法正确的是___________。
(3)GaAs是共价化合物,一种重要的半导体材料。As与 同周期,As与
同周期,As与 同主族。
同主族。
①下列事实不能用元素周期律解释的是___________ (填字母)。
a.䂸性: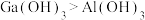
b.非金属性:
c.酸性: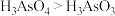
②GaAs中,As元素化合价为-3价,用原子结构理论解释As元素显负价的原因___________ 。
③废弃含 半导体材料可以用浓硝酸溶解
半导体材料可以用浓硝酸溶解 ,生成
,生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
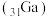 应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。(1)铝原子核外共有
 。常温下
。常温下 的金属性比
的金属性比 的金属性
的金属性 的主要原因是
的主要原因是A.高温时
 的活泼性大于
的活泼性大于 B.高温有利于
B.高温有利于 分解
分解C.高温时
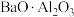 比
比 稳定 D.Ba的沸点比
稳定 D.Ba的沸点比 的低
的低(2)下列有关镓和镓的化合物的说法正确的是___________。
A.基态Ga原子价层电子的轨道表示式: |
B.常温下, 可与水剧烈反应放出氢气 可与水剧烈反应放出氢气 |
C.一定条件下, 可与 可与 反应生成盐 反应生成盐 |
D.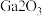 可由 可由 受热分解得到 受热分解得到 |
(3)GaAs是共价化合物,一种重要的半导体材料。As与
 同周期,As与
同周期,As与 同主族。
同主族。①下列事实不能用元素周期律解释的是
a.䂸性:
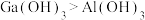
b.非金属性:

c.酸性:
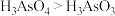
②GaAs中,As元素化合价为-3价,用原子结构理论解释As元素显负价的原因
③废弃含
 半导体材料可以用浓硝酸溶解
半导体材料可以用浓硝酸溶解 ,生成
,生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式
您最近一年使用:0次







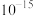

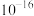
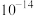
 /%
/% /%
/% /%
/%

