1 . 城市污水中含有一定量的 、
、 ,向污水中加入菌体和
,向污水中加入菌体和 溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现
溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现 、
、 的脱除,其过程如图所示。下列说法正确的是
的脱除,其过程如图所示。下列说法正确的是
 、
、 ,向污水中加入菌体和
,向污水中加入菌体和 溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现
溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现 、
、 的脱除,其过程如图所示。下列说法正确的是
的脱除,其过程如图所示。下列说法正确的是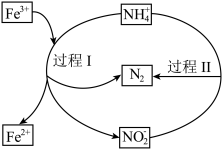
A.“过程Ⅰ”中 为催化剂 为催化剂 |
B. 的氧化性强于 的氧化性强于 |
C.“过程Ⅱ”中氧化产物和还原产物的质量之比为 |
D.“过程Ⅰ”中 和 和 的物质的量之比为 的物质的量之比为 ,则氧化剂与还原剂物质的量之比为 ,则氧化剂与还原剂物质的量之比为 |
您最近半年使用:0次
2023-09-23更新
|
571次组卷
|
10卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题
湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题湘豫名校联考2023-2024学年高三上学期一轮诊断化学试题河南省信阳市信阳高级中学2024届高三上学期9月一模化学试题山东省滨州市2023-2024学年高三上学期11月期中考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高三上学期10月月考化学试题(已下线)选择题11-15江西省赣州市信丰中学2023-2024学年高一上学期11月月考化学试题河南省南阳市邓州市第一高级中学校2023-2024学年高一上学期期末考试化学试题(已下线)选择题6-10河南省洛阳市宜阳县第一高级中学2023-2024学年高一上学期(研学班)期末考试化学试卷
2 . 工业上常采用堆浸-反萃取-电积法从锌矿(主要成分为ZnS,含有FeS2、CuS、NiS、SiO2等杂质)中获得锌,其流程如图所示。
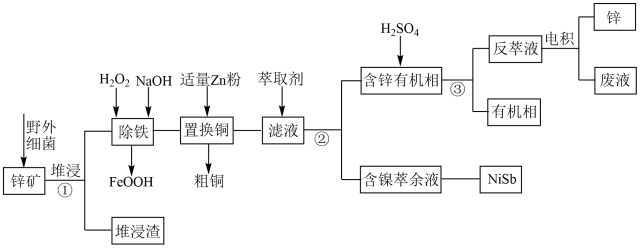
已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH较高时,氢氧化氧铁为胶状沉淀;③在我国,富矿少、贫矿多,品位低于5%的矿山属于贫矿。回答下列问题:
(1)“堆浸渣”的主要成分为_______ ,“堆浸”时为了提高反应速率,可以采取的措施为_______ (填标号)。
A.将锌矿粉碎 B.大幅度升温 C.延长堆浸时间 D.将锌矿充分暴露
(2)“除铁”时Zn2+、Cu2+、Ni2+在pH≤6时难以沉淀而除去,但是有Fe3+存在时,pH升高,Zn2+、Cu2+、Ni2+的去除率均升高,原因可能为_______ 。
(3)“置换铜”时用锌粉直接置换镍的速率极小,目前采用“锑盐净化法”,即在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为_______ 。
(4)“萃取”时需要进行多次萃取且合并萃取液,其目的是_______ ,操作③的名称为_______ ,此流程中可循环利用的物质有锌、萃取剂和_______ 。
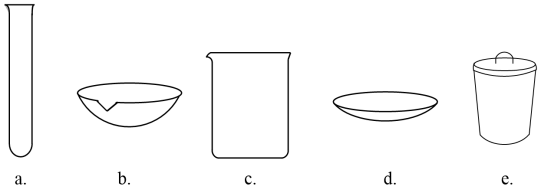
(5)反萃液的主要成分为ZnSO4,可通过一系列反应制备对可见光敏感的半导体催化剂ZnFe2O4。其中在无氧条件下灼烧ZnFe2(C2O4)3·6H2O获得产品ZnFe2O4时发生反应的化学方程式为_______ ,灼烧时需要借助马弗炉(Mufflefurnace,一种通用的加热设备,通常叫电炉等)和下列哪些仪器_______ (填标号)共同完成。
(6)“电积”时在_______ 极获得锌,得到的锌的质量分数为96.0% 。某企业利用上述流程从1600吨锌矿中可获得此种锌的质量为80吨,已知上述流程的总损耗率约为2%,则该锌矿为_______ (填“富矿”或“贫矿”)。

已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH较高时,氢氧化氧铁为胶状沉淀;③在我国,富矿少、贫矿多,品位低于5%的矿山属于贫矿。回答下列问题:
(1)“堆浸渣”的主要成分为
A.将锌矿粉碎 B.大幅度升温 C.延长堆浸时间 D.将锌矿充分暴露
(2)“除铁”时Zn2+、Cu2+、Ni2+在pH≤6时难以沉淀而除去,但是有Fe3+存在时,pH升高,Zn2+、Cu2+、Ni2+的去除率均升高,原因可能为
(3)“置换铜”时用锌粉直接置换镍的速率极小,目前采用“锑盐净化法”,即在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为
(4)“萃取”时需要进行多次萃取且合并萃取液,其目的是
(5)反萃液的主要成分为ZnSO4,可通过一系列反应制备对可见光敏感的半导体催化剂ZnFe2O4。其中在无氧条件下灼烧ZnFe2(C2O4)3·6H2O获得产品ZnFe2O4时发生反应的化学方程式为

(6)“电积”时在
您最近半年使用:0次
2022-04-03更新
|
459次组卷
|
3卷引用:湖南省吉首市第一中学2022届高三下学期4月模拟预测考试化学试题
3 . 水合肼(N2H4·H2O)及其衍生物在许多工业中被广泛的使用,沸点118°C,有强还原性,在空气中可吸收二氧化碳而产生烟雾。实验室利用NaClO氧化尿素制备水合肼分为以下两步:
I、制备次氯酸钠
II、与尿素[CO(NH2)2]在碱性条件下反应制备水合肼,实验装置如图所示(部分装置省略):

(1)装置B的作用是储存多余的Cl2,可用的试剂是_______ 。
(2)装置C中制备NaClO的反应过程中温度升高易产生副产物NaClO3,实验中可采取的措施是_______ (写一条即可)。
(3)将装置C中制备的溶液转移到装置D的_______ (填仪器名称)中,并缓缓滴入,原因是_______ ,装置D中生成水合肼的化学方程式为_______ .(在此反应中有苏打生成)。
(4)有同学认为该实验收集装置有缺陷,请你写出改进措施_______ 。
(5)常温时,水合肼在碱性条件下可以还原银氨溶液来回收金属银,并产生无污染气体N2,写出该反应的离子方程式:_______ 。
(6)称取3.0g水合肼样品,加水配制成250mL溶液,从中取出25.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.300mol/L的I2溶液进行滴定,滴定终点的现象_______ ,测得消耗I2溶液的体积为27.50mL,则样品中水合肼(N2H4·H2O)的质量百分数为_______ (保留3位有效数字)。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
(7)滴定时,下列能导致水合肼的含量测定结果偏低的是_______ (填字母)
a.实验过程中,部分HI被空气氧化
b.滴定前,盛标准液的滴定管内无气泡,滴定后有气泡
c.读数时,滴定前仰视,滴定后俯视
d.盛标准液的滴定管水洗后,直接装标准液
I、制备次氯酸钠
II、与尿素[CO(NH2)2]在碱性条件下反应制备水合肼,实验装置如图所示(部分装置省略):

(1)装置B的作用是储存多余的Cl2,可用的试剂是
(2)装置C中制备NaClO的反应过程中温度升高易产生副产物NaClO3,实验中可采取的措施是
(3)将装置C中制备的溶液转移到装置D的
(4)有同学认为该实验收集装置有缺陷,请你写出改进措施
(5)常温时,水合肼在碱性条件下可以还原银氨溶液来回收金属银,并产生无污染气体N2,写出该反应的离子方程式:
(6)称取3.0g水合肼样品,加水配制成250mL溶液,从中取出25.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.300mol/L的I2溶液进行滴定,滴定终点的现象
(7)滴定时,下列能导致水合肼的含量测定结果偏低的是
a.实验过程中,部分HI被空气氧化
b.滴定前,盛标准液的滴定管内无气泡,滴定后有气泡
c.读数时,滴定前仰视,滴定后俯视
d.盛标准液的滴定管水洗后,直接装标准液
您最近半年使用:0次
2022-03-29更新
|
366次组卷
|
2卷引用:湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题
4 . 据文献报道,氨催化还原法可用来消除某些污染气体,其反应历程如图所示:
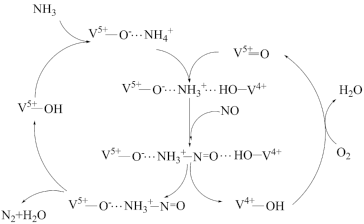
下列说法正确的是

下列说法正确的是
| A.V的核外电子排布式为3d34s2 |
| B.当消耗标准状况下11.2LO2时,整个过程转移6mole- |
| C.V5+-OH在该反应过程中作催化剂,V4+-OH是该反应过程的中间产物 |
D.总反应化学方程式:4NH3+3O2 2N2+6H2O 2N2+6H2O |
您最近半年使用:0次
2022-03-29更新
|
561次组卷
|
6卷引用:湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题
名校
5 . 一种利用废旧镀锌铁皮制备磁性Fe3O4纳米粒子的工艺流程如图。
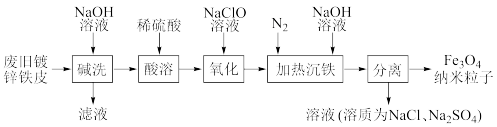
下列有关说法不正确 的是

下列有关说法
| A.“碱洗”是为了去除废旧镀锌铁皮表面的油污 |
| B.“氧化”时发生反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O |
| C.“氧化”后的溶液中金属阳离子主要有Fe2+、Fe3+、Na+ |
| D.用激光笔照射“加热沉铁”后所得分散系,产生丁达尔效应 |
您最近半年使用:0次
2022-03-26更新
|
1849次组卷
|
19卷引用:湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题
湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题江苏省七市(南通、泰州、扬州、徐州、淮安、连云港、宿迁)2022届高三下学期二模考试化学试题(已下线)秘籍10 金属元素及化合物的相互转化与推断-备战2022年高考化学抢分秘籍(全国通用)(已下线)化学-2022年高考考前押题密卷(湖南卷)(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编江苏省泰州中学2022-2023学年高三上学期期初调研考试 化学试题(已下线)期末测试卷-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)湖南省长沙市第一中学2022-2023学年高三上学期月考卷(三)化学试题湖北省宜昌英杰学校2021-2022学年高三上学期9月月考化学试题巩固训练9湖南省岳阳市第一中学2023届高三下学期第五次月考化学试题湖南省永州市第一中学2023届高三下学期第五次月考化学试题湖南省宁乡市第一高级中学2023届高三第七次月考化学试题江西省赣州市重点中学九校联盟2022-2023学年高二下学期第一次月考化学试题湖南省衡阳县2023届高三3月教学质量诊断性检测考试化学试题山西省运城市康杰中学2022-2023学年高一下学期5月月考化学试题(已下线)开学摸底考试卷-2024年高考化学一轮复习考点通关卷(新高考通用)河北省泊头市第一中学2023-2024学年高三上学期开学考试化学试题07 2024年苏州星海实验中学高一3月月考
名校
解题方法
6 . 工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6]•3H2O,工艺流程如图:
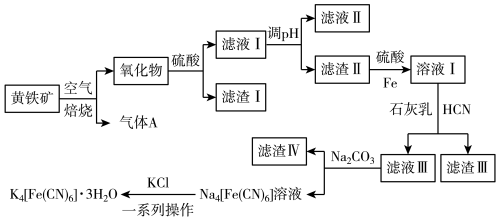
下列说法错误的是

下列说法错误的是
| A.“焙烧”时氧化产物有Fe2O3和SO2 |
| B.“调pH”分离Fe3+与Cu2+、Ni2+是利用了它们氢氧化物Ksp的不同 |
| C.“溶液Ⅰ”中主要反应的离子方程式为6OH-+6HCN+Fe2+=[Fe(CN)6]4-+6H2O |
| D.“一系列操作”为过滤、洗涤、干燥 |
您最近半年使用:0次
2022-03-22更新
|
2171次组卷
|
12卷引用:湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题
湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题山东省济南市2022届高三3月高考模拟考试(一模)化学试题湖北省枣阳市第一中学2022届高三下学期5月第三次模拟考试化学试题(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编(已下线)2022年山东省高考真题变式题(不定项选择题)山东省济南第一中学2023届高三上学期开学考试化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题湖南省怀化市会同县第一中学2021-2022学年高三下学期第二次调研考试化学试题湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题(已下线)学科特色7 工艺流程推断(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(不定项选择题)湖南省衡阳市第一中学2023届高三下学期第四次月考化学试题
名校
解题方法
7 . 某萃铜余液主要含有 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备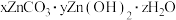 的工艺流程如图甲所示。
的工艺流程如图甲所示。

回答下列问题:
(1)过硫酸钠( )中
)中 的化合价为
的化合价为 ,
,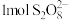 中过氧键的数目为
中过氧键的数目为___________ 。向 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为___________ 。“氧化除锰”过程中,
___________ (填“能”或“不能”)用绿色氧化剂 来代替。
来代替。
(2)向“氧化除锰”后的余液中加入试剂 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为___________ 。
(3)“沉锌”时,应保持溶液 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是___________ 。
(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→___________ →___________ →___________ →___________ →c→关抽气泵。
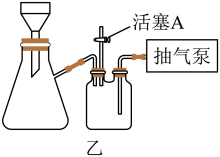
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[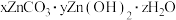 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌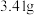 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体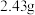 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为___________ 。
 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备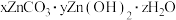 的工艺流程如图甲所示。
的工艺流程如图甲所示。
回答下列问题:
(1)过硫酸钠(
 )中
)中 的化合价为
的化合价为 ,
,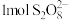 中过氧键的数目为
中过氧键的数目为 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为
 来代替。
来代替。(2)向“氧化除锰”后的余液中加入试剂
 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为(3)“沉锌”时,应保持溶液
 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→

a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[
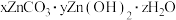 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌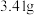 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体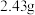 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为
您最近半年使用:0次
2021-09-09更新
|
1567次组卷
|
9卷引用:湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题
湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题全国2022届高三上学期第一次学业质量联合检测化学试题广东省珠海市第二中学2022届高三十月月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】07(已下线)第19周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)2019年高考浙江卷化学试题变式题(实验题)
名校
8 . 氧化钡广泛用于玻璃、陶瓷工业,是制取过氧化钡和钡盐的原料。一种利用钡泥[含BaCO3、BaSO3、Ba(FeO2)2等]制取氧化钡的绿色工艺流程如下:
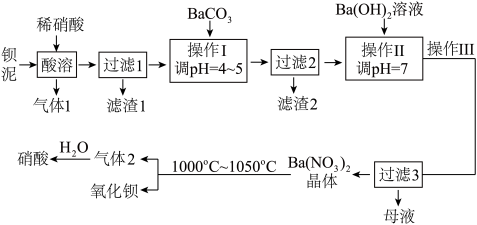
回答下列问题:
(1)酸溶时,Ba(FeO2)2与稀硝酸反应的化学方程式为_____________________ 。
(2)产生滤渣1的反应离子方程式是____________________________________________ 。
(3)操作Ⅰ调pH=4~5的目的是_________________________________________________ 。
(4)过滤3所得母液应返回______________ 工序循环使用。
(5)Ba(NO3)2可用于汽车尾气中还原性气体的催化转化。科技工作者用H2模拟尾气中的还原性气体,研究Ba(NO3)2的催化还原过程。该过程分两步进行,如图表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与NO3-的物质的量之比是_________ 。
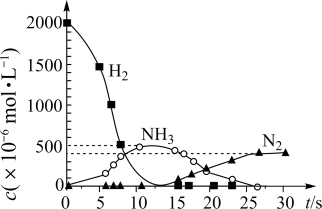
(6)“气体2”为混合气体。标准状况下a L“气体2”溶于水得到bL溶液,则所得溶液的物质的量浓度为_________________

回答下列问题:
(1)酸溶时,Ba(FeO2)2与稀硝酸反应的化学方程式为
(2)产生滤渣1的反应离子方程式是
(3)操作Ⅰ调pH=4~5的目的是
(4)过滤3所得母液应返回
(5)Ba(NO3)2可用于汽车尾气中还原性气体的催化转化。科技工作者用H2模拟尾气中的还原性气体,研究Ba(NO3)2的催化还原过程。该过程分两步进行,如图表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与NO3-的物质的量之比是

(6)“气体2”为混合气体。标准状况下a L“气体2”溶于水得到bL溶液,则所得溶液的物质的量浓度为
您最近半年使用:0次
2019-11-21更新
|
106次组卷
|
2卷引用:湖南省湘西自治州永顺县第一中学2022届高三下学期期中考试化学试题



