名校
1 . 将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
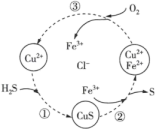
和 的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是
的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是
 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是
的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是
A.回收S的总反应为 |
B.过程②中,发生的反应为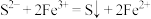 |
C.过程③中,标准状况下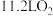 参加反应转移2mol电子 参加反应转移2mol电子 |
D.整个转化过程中 可以循环使用 可以循环使用 |
您最近一年使用:0次
2023-12-23更新
|
96次组卷
|
2卷引用:湖南省岳阳市湘阴县知源高级中学等多校2023-2024学年高一上学期12月月考化学试题
名校
2 . 填空
(1)某一反应体系有反应物和生成物共五种物质: 、
、 、
、 、
、 、
、 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程:
①该反应中的还原剂是______ .
②该反应中,发生还原反应的过程是______ .
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目______ .
④如反应转移了0.3mol电子,则产生的气体在标准状况下体积为______ .
(2)在反应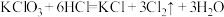 中,还原产物是
中,还原产物是______ ,反应中的氧化剂与还原剂物质的量之比为______ .
(1)某一反应体系有反应物和生成物共五种物质:
 、
、 、
、 、
、 、
、 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程:
①该反应中的还原剂是
②该反应中,发生还原反应的过程是
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目
④如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
(2)在反应
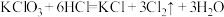 中,还原产物是
中,还原产物是
您最近一年使用:0次
名校
3 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
(2)我国用 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:___________ 。将该反应化学方程式改写为离子方程式:___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下降 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为___________ 。
(5)实验室用下列方法均可制取氯气
① ③
③
②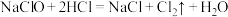 ②
②
③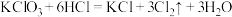 ④
④
若各反应转移的电子数相同,①②③生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下降
 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为(5)实验室用下列方法均可制取氯气
①
 ③
③②
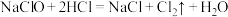 ②
②③
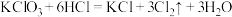 ④
④若各反应转移的电子数相同,①②③生成的氯气质量比为
您最近一年使用:0次
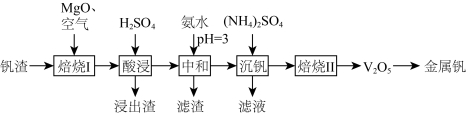
4 . 钒(V)广泛应用于冶金、化工、航天等领域。一种以钒渣(主要成分是 、
、 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示:
已知:① 具有强氧化性,主要存在于
具有强氧化性,主要存在于 的溶液中,
的溶液中,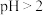 时转化成酸式多钒酸盐。
时转化成酸式多钒酸盐。
②溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1) 中
中 为
为 价,
价, 的化合价为
的化合价为_______ ;基态 原子价层电子排布图为
原子价层电子排布图为_______ 。
(2)“焙烧Ⅰ”中将 和空气分别加入炉中,焙烧将
和空气分别加入炉中,焙烧将 转化为
转化为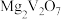 和
和 的化学方程式为
的化学方程式为_______ 。
(3)“酸浸”所得浸出液中除含有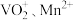 外,还含有的金属阳离子有
外,还含有的金属阳离子有_______ 。
(4)“沉钒”可得到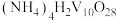 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为_______ 。
(5)“沉钒”所得滤液中加入氨水调节溶液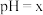 ,过滤得到
,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制
,应控制
_______ 。
 、
、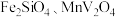 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示:
已知:①
 具有强氧化性,主要存在于
具有强氧化性,主要存在于 的溶液中,
的溶液中,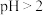 时转化成酸式多钒酸盐。
时转化成酸式多钒酸盐。②溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 1.9 | 7.0 | 8.1 | 8.9 |
沉淀完全时 的 的 | 3.2 | 9.0 | 10.1 | 10.9 |
(1)
 中
中 为
为 价,
价, 的化合价为
的化合价为 原子价层电子排布图为
原子价层电子排布图为(2)“焙烧Ⅰ”中将
 和空气分别加入炉中,焙烧将
和空气分别加入炉中,焙烧将 转化为
转化为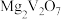 和
和 的化学方程式为
的化学方程式为(3)“酸浸”所得浸出液中除含有
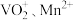 外,还含有的金属阳离子有
外,还含有的金属阳离子有(4)“沉钒”可得到
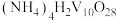 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为(5)“沉钒”所得滤液中加入氨水调节溶液
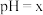 ,过滤得到
,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制
,应控制
您最近一年使用:0次
5 . 硫化钠可广泛用于染料、医药行业。工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列问题:
(1)工业上常用芒硝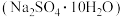 和煤粉在高温下生产硫化钠,同时生成
和煤粉在高温下生产硫化钠,同时生成 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(2)溶解回流装置如图所示,装置中球形冷凝管应从_______ (填“a”或“b”)口进水;

(3)回流前无需加入沸石,其原因是_______ 。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3.若气雾上升过高,可采取的措施是_______ 。
(4)回流结束后,需进行的操作有①停止加热②关闭冷凝水③移去水浴,正确的顺序为_______(填标号)。
(5)该实验趁热过滤除去的杂质为_______ 。若滤纸上析出大量晶体,则可能的原因是_______ 。
(6)滤液冷却、结晶、过滤,晶体用少量_______ 洗涤,干燥,得到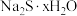 。
。
(1)工业上常用芒硝
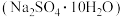 和煤粉在高温下生产硫化钠,同时生成
和煤粉在高温下生产硫化钠,同时生成 ,该反应的化学方程式为
,该反应的化学方程式为(2)溶解回流装置如图所示,装置中球形冷凝管应从

(3)回流前无需加入沸石,其原因是
(4)回流结束后,需进行的操作有①停止加热②关闭冷凝水③移去水浴,正确的顺序为_______(填标号)。
| A.①②③ | B.③①② | C.②①③ | D.①③② |
(6)滤液冷却、结晶、过滤,晶体用少量
 。
。
您最近一年使用:0次
解题方法
6 . 氮化镓(GaN)具有优异的光电性能。一种利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)2、铁酸锌ZnFe2O4、SiO2]制备GaN的工艺流程如下:
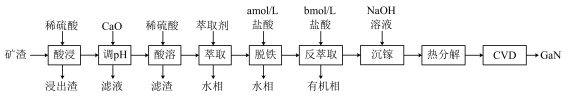
已知:
①Ga与Al同主族,化学性质相似。
②常温下, ,
, ,
, 。
。
③ 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
回答下列问题:
(1)“酸浸”时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。“酸溶”所得滤渣的主要成分是___________ (填化学式)。
(2)“酸浸”所得浸出液中 、
、 浓度分别为0.003mol/L和1mol/L。常温下,为尽可能多地提取
浓度分别为0.003mol/L和1mol/L。常温下,为尽可能多地提取 并确保不混入
并确保不混入 ,“调pH”时需用CaO调pH略小于
,“调pH”时需用CaO调pH略小于___________ (假设调pH时溶液体积不变)。
(3)“反萃取”时,所用盐酸的浓度
___________ (选填上表中盐酸的浓度)。
(4)“沉镓”时,若加入NaOH的量过多,会导致 的沉淀率降低,原因是
的沉淀率降低,原因是___________ (用离子方程式表示)。
(5)利用CVD(化学气相沉积)技术,将热分解得到的 与
与 在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为
在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为___________ 。
(6)①GaN的熔点为1700℃, 的熔点为77.9℃,则
的熔点为77.9℃,则 晶体类型为
晶体类型为___________ 。
②GaN晶体的一种立方晶胞如图所示。该晶体密度为 ,GaN的式量为Mr,则晶胞边长为
,GaN的式量为Mr,则晶胞边长为___________ nm。(列出计算式, 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)


已知:
①Ga与Al同主族,化学性质相似。
②常温下,
 ,
, ,
, 。
。③
 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。盐酸浓度/ | 反萃取率/% | |
 |  | |
| 2 | 86.9 | 9.4 |
| 4 | 69.1 | 52.1 |
| 6 | 17.5 | 71.3 |
(1)“酸浸”时
 发生反应的离子方程式为
发生反应的离子方程式为(2)“酸浸”所得浸出液中
 、
、 浓度分别为0.003mol/L和1mol/L。常温下,为尽可能多地提取
浓度分别为0.003mol/L和1mol/L。常温下,为尽可能多地提取 并确保不混入
并确保不混入 ,“调pH”时需用CaO调pH略小于
,“调pH”时需用CaO调pH略小于(3)“反萃取”时,所用盐酸的浓度

(4)“沉镓”时,若加入NaOH的量过多,会导致
 的沉淀率降低,原因是
的沉淀率降低,原因是(5)利用CVD(化学气相沉积)技术,将热分解得到的
 与
与 在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为
在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为(6)①GaN的熔点为1700℃,
 的熔点为77.9℃,则
的熔点为77.9℃,则 晶体类型为
晶体类型为②GaN晶体的一种立方晶胞如图所示。该晶体密度为
 ,GaN的式量为Mr,则晶胞边长为
,GaN的式量为Mr,则晶胞边长为 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
7 . 用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx)转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质的转化过程如图所示。下列说法不正确的是
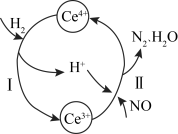

| A.反应I的离子方程式为2Ce4+ + H2 = 2Ce3+ + 2H+ |
| B.反应II中氧化剂与还原剂的物质的量之比为1:2 |
| C.反应过程中,混合溶液中Ce3+和Ce4+的总数一定保持不变 |
| D.理论上,每消耗2.24 L氢气,转移的电子的物质的量为0.2 mol |
您最近一年使用:0次
2023-05-16更新
|
1145次组卷
|
5卷引用:湖南省岳阳市平江县2023届高三下学期教学质量监测(三)化学试题
湖南省岳阳市平江县2023届高三下学期教学质量监测(三)化学试题(已下线)考点巩固卷02 化学物质及其变化(3大考点44题)?-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)湖北省恩施州恩高芳华高级中学2022-2023学年高二上学期期末考试化学试卷
解题方法
8 . 硼氢化钠( )广泛用于化工生产,常温下能与水反应,碱性条件下能稳定存在,易溶于异丙胺(沸点为33℃)。工业上可用硼镁矿(主要成分为
)广泛用于化工生产,常温下能与水反应,碱性条件下能稳定存在,易溶于异丙胺(沸点为33℃)。工业上可用硼镁矿(主要成分为 ,含少量杂质
,含少量杂质 )制取
)制取 ,其工艺流程如图1所示。
,其工艺流程如图1所示。
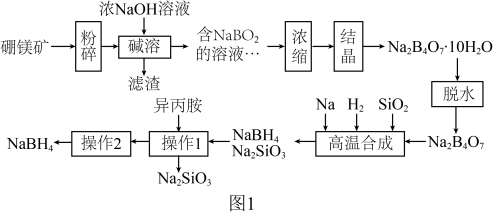
回答下列问题:
(1) 中含有的化学键为
中含有的化学键为_______
(2)Ti的核外电子排布式_______
(3)碱溶过滤得滤渣的主要成分是_______ 、_______
(4)写出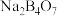 制取
制取 的化学方程式
的化学方程式_______
(5)高温合成中,加料之前需将反应器加热至100℃以上,并通入氩气。通入氩气的目的是_______
(6)在碱性条件下,用惰性电极电解 溶液也可制得
溶液也可制得 ,装置如图2所示,写出阴极反应的电极方程式
,装置如图2所示,写出阴极反应的电极方程式_______
(7) 常用作还原剂,
常用作还原剂, 也是常见的还原剂。与相同氧化剂反应时,
也是常见的还原剂。与相同氧化剂反应时, 的还原能力相当于
的还原能力相当于_______  的还原能力。
的还原能力。
 )广泛用于化工生产,常温下能与水反应,碱性条件下能稳定存在,易溶于异丙胺(沸点为33℃)。工业上可用硼镁矿(主要成分为
)广泛用于化工生产,常温下能与水反应,碱性条件下能稳定存在,易溶于异丙胺(沸点为33℃)。工业上可用硼镁矿(主要成分为 ,含少量杂质
,含少量杂质 )制取
)制取 ,其工艺流程如图1所示。
,其工艺流程如图1所示。
回答下列问题:
(1)
 中含有的化学键为
中含有的化学键为(2)Ti的核外电子排布式
(3)碱溶过滤得滤渣的主要成分是
(4)写出
 制取
制取 的化学方程式
的化学方程式(5)高温合成中,加料之前需将反应器加热至100℃以上,并通入氩气。通入氩气的目的是
(6)在碱性条件下,用惰性电极电解
 溶液也可制得
溶液也可制得 ,装置如图2所示,写出阴极反应的电极方程式
,装置如图2所示,写出阴极反应的电极方程式
(7)
 常用作还原剂,
常用作还原剂, 也是常见的还原剂。与相同氧化剂反应时,
也是常见的还原剂。与相同氧化剂反应时, 的还原能力相当于
的还原能力相当于 的还原能力。
的还原能力。
您最近一年使用:0次
名校
解题方法
9 . 下列解释事实的离子方程式正确的是
A.实验室配制的亚铁盐溶液在空气中被氧化: |
B.漂白粉溶液在空气中失效: |
C.向硫酸铜溶液中加入NaHS溶液生成黑色沉淀: |
D.用 做碘量法实验时,溶液pH不可太低,否则溶液变浑浊: 做碘量法实验时,溶液pH不可太低,否则溶液变浑浊: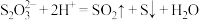 |
您最近一年使用:0次
2023-03-29更新
|
1073次组卷
|
5卷引用:湖南省岳阳市2023届高三下学期教学质量监测(二模)化学试题
湖南省岳阳市2023届高三下学期教学质量监测(二模)化学试题江西省铜鼓中学2022-2023学年高二下学期4月月考化学试题(已下线)狂飙卷 04-【热题狂飙】2023年高考化学样卷(全国卷专用)广东省茂名市第一中学2023届高三下学期模拟预测化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题11-15)
名校
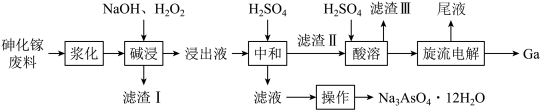
10 . 从砷化镓废料(主要成分为GaAs,含 、
、 和
和 等杂质)中回收镓和砷的工艺流程如下:
等杂质)中回收镓和砷的工艺流程如下:
已知: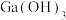 是两性氢氧化物。
是两性氢氧化物。
25℃时,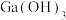 的溶度积
的溶度积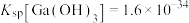 ,
,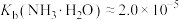 。回答下列问题:
。回答下列问题:
(1)“滤渣Ⅱ”的成分为_______ (填化学式)。
(2)基态砷原子的价电子排布图为_______ ;砷化镓(GaAs)和氮化硼(BN)晶体都具有空间网状结构,硬度大,则砷化镓的熔点_______ 氮化硼的熔点(填“高于”“低于”或“等于”)。
(3)砷化镓(GaAs)在“碱浸”时,砷化镓转化为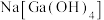 和
和 进入溶液,该反应的化学方程式为
进入溶液,该反应的化学方程式为_______ 。
(4)“碱浸”的温度控制在70℃左右,温度不能过高或过低的原因是_____ 。
(5)向“中和”后得到的滤液中加入足量NaOH溶液,使pH大于12,经_______ 、降温结晶、过滤、洗涤、低温干燥后得到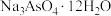 。
。
(6)为探究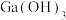 在氨水中能否溶解,计算反应
在氨水中能否溶解,计算反应 的平衡常数K=
的平衡常数K=_______ 。(已知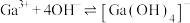
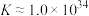 )
)
 、
、 和
和 等杂质)中回收镓和砷的工艺流程如下:
等杂质)中回收镓和砷的工艺流程如下:
已知:
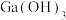 是两性氢氧化物。
是两性氢氧化物。25℃时,
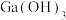 的溶度积
的溶度积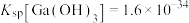 ,
,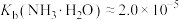 。回答下列问题:
。回答下列问题:(1)“滤渣Ⅱ”的成分为
(2)基态砷原子的价电子排布图为
(3)砷化镓(GaAs)在“碱浸”时,砷化镓转化为
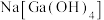 和
和 进入溶液,该反应的化学方程式为
进入溶液,该反应的化学方程式为(4)“碱浸”的温度控制在70℃左右,温度不能过高或过低的原因是
(5)向“中和”后得到的滤液中加入足量NaOH溶液,使pH大于12,经
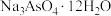 。
。(6)为探究
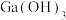 在氨水中能否溶解,计算反应
在氨水中能否溶解,计算反应 的平衡常数K=
的平衡常数K=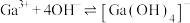
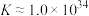 )
)
您最近一年使用:0次
2023-03-17更新
|
333次组卷
|
2卷引用:湖南省平江县第一中学2023届高三下学期适应性考试(二)化学试题



