解题方法
1 . 根据所学知识,回答下列问题:
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:___________ 。
②过程a中K2FeO4体现___________ (填“氧化”或“还原”)性,反应过程中转移5.418×1022个电子,需要___________ mol K2FeO4。
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:___________ 。
___________Fe(OH)3+___________KOH+___________KClO=___________K2FeO4+___________KCl+___________H2O
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是___________ ,生产1mol的高铁酸钠,需要转移电子的物质的量是___________ mol。
(4)将铝箔放入NaOH稀溶液中,开始时无气体生成,写出反应的离子方程式:___________ ;反应片刻后,可观察到有气体产生。
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:
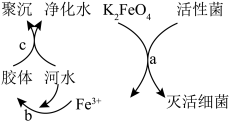
②过程a中K2FeO4体现
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:
___________Fe(OH)3+___________KOH+___________KClO=___________K2FeO4+___________KCl+___________H2O
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是
(4)将铝箔放入NaOH稀溶液中,开始时无气体生成,写出反应的离子方程式:
您最近一年使用:0次
名校
解题方法
2 . 化学小组实验探究 与
与 溶液的反应。
溶液的反应。
实验一:用如图装置制备 ,并将足量
,并将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(1)制备的 中会混有少量的
中会混有少量的 ,原因可能为浓硫酸或硫酸铜受热分解产生
,原因可能为浓硫酸或硫酸铜受热分解产生 ,为了排除
,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为___________ 。
a.浓硫酸 b.足量 溶液 c.足量NaHS溶液 d.足量饱和
溶液 c.足量NaHS溶液 d.足量饱和 溶液
溶液
请写出试剂a所有不能选择的试剂的理由(用相应的离子方程式回答):___________ 。
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为 、
、 或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
相关反应为:① ,
,
② 。
。
流程如下: 是否已经过量,请简述实验方法
是否已经过量,请简述实验方法___________ 。
(3)沉淀D加入过量盐酸后,只有少量沉淀剩余,则表明大部外沉淀为 。向滤液E中加入
。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是___________ ,可进一步证实B中含 。
。
实验三:探究 的产生途径。
的产生途径。
猜想1:实验一中, 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。
猜想2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:___________ 。
(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有 生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率
生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率___________ (填“快”或“慢”)。
(6)实验探究可知, 在
在___________ (选填“酸性”“中性”“碱性”)溶液中更易被氧化为 。
。
 与
与 溶液的反应。
溶液的反应。实验一:用如图装置制备
 ,并将足量
,并将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(1)制备的
 中会混有少量的
中会混有少量的 ,原因可能为浓硫酸或硫酸铜受热分解产生
,原因可能为浓硫酸或硫酸铜受热分解产生 ,为了排除
,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为a.浓硫酸 b.足量
 溶液 c.足量NaHS溶液 d.足量饱和
溶液 c.足量NaHS溶液 d.足量饱和 溶液
溶液请写出试剂a所有不能选择的试剂的理由(用相应的离子方程式回答):
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为
 、
、 或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
或两者混合物。滴加氨水可释出其阴离子,便于后续检验。相关反应为:①
 ,
,②
 。
。流程如下:

 是否已经过量,请简述实验方法
是否已经过量,请简述实验方法(3)沉淀D加入过量盐酸后,只有少量沉淀剩余,则表明大部外沉淀为
 。向滤液E中加入
。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是 。
。实验三:探究
 的产生途径。
的产生途径。猜想1:实验一中,
 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。猜想2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加
 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有
 生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率
生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率(6)实验探究可知,
 在
在 。
。
您最近一年使用:0次
2024-05-05更新
|
343次组卷
|
2卷引用:辽宁省实验中学2022-2023学年高一下学期期中测试化学试题
解题方法
3 . 钛白粉学名二氧化钛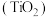 是性能最佳、应用最广、用量最大的白色颜料。钛铁矿
是性能最佳、应用最广、用量最大的白色颜料。钛铁矿 中往往含有
中往往含有 等杂质。一种硫酸法钛白粉生产工艺如图:
等杂质。一种硫酸法钛白粉生产工艺如图:
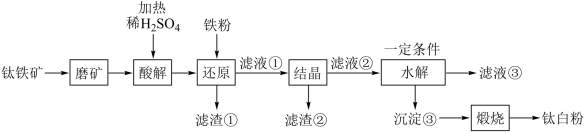
已知:①酸解后,钛主要以 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。
② 不溶于水和稀酸。
不溶于水和稀酸。
(1)写出基态 原子的价层电子排布式
原子的价层电子排布式___________ 。
(2)磨矿的目的是___________ 。
(3)滤渣①的主要成分是___________ 。
(4)酸解过程中,写出 发生反应的化学方程式
发生反应的化学方程式___________ 。
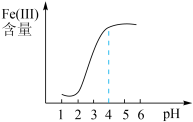
(5)还原过程中,加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中
。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中 (Ⅲ)含量随
(Ⅲ)含量随 变化如图,试分析在
变化如图,试分析在 介于4~6之间时,
介于4~6之间时, (Ⅲ)含量基本保持不变的原因:
(Ⅲ)含量基本保持不变的原因:___________ 。
(6)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为___________ 。
②一定量 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理___________ 。
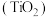 是性能最佳、应用最广、用量最大的白色颜料。钛铁矿
是性能最佳、应用最广、用量最大的白色颜料。钛铁矿 中往往含有
中往往含有 等杂质。一种硫酸法钛白粉生产工艺如图:
等杂质。一种硫酸法钛白粉生产工艺如图:
已知:①酸解后,钛主要以
 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。②
 不溶于水和稀酸。
不溶于水和稀酸。(1)写出基态
 原子的价层电子排布式
原子的价层电子排布式(2)磨矿的目的是
(3)滤渣①的主要成分是
(4)酸解过程中,写出
 发生反应的化学方程式
发生反应的化学方程式(5)还原过程中,加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中
。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中 (Ⅲ)含量随
(Ⅲ)含量随 变化如图,试分析在
变化如图,试分析在 介于4~6之间时,
介于4~6之间时, (Ⅲ)含量基本保持不变的原因:
(Ⅲ)含量基本保持不变的原因:
(6)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为
②一定量
 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
您最近一年使用:0次
名校
解题方法
4 . 蛇纹石矿的主要成分为 、
、 、
、 、
、 、
、 、
、 等,现有一种利用该矿石制备高纯度
等,现有一种利用该矿石制备高纯度 工艺流程如图:
工艺流程如图:

已知: ,氢硫酸的两步电离常数分别为
,氢硫酸的两步电离常数分别为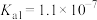 ,
,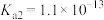 。
。
(1)滤渣1的主要成分有S、 、
、 ,根据滤渣成分,分析使用浓硫酸酸浸而不用盐酸的理由是
,根据滤渣成分,分析使用浓硫酸酸浸而不用盐酸的理由是__________ 。
(2)“氧化”时 作氧化剂发生反应的离子方程式为
作氧化剂发生反应的离子方程式为__________ ,鼓入空气,除可作氧化剂外,还有__________ 的作用。
(3)滤渣2的主要成分是__________ 。
(4)沉镍时,当镍离子恰好沉淀完全(离子浓度小于 ,可认为沉淀完全),要保证此时
,可认为沉淀完全),要保证此时 不会从溶液逸出,应控制溶液中
不会从溶液逸出,应控制溶液中 浓度不高于
浓度不高于__________ (已知饱和 浓度约为
浓度约为 )。
)。
(5) 晶体具有
晶体具有 型结构(如图),实验测得
型结构(如图),实验测得 的晶胞参数为
的晶胞参数为 ,则与
,则与 距离最近的
距离最近的 有
有__________ 个,该晶体密度为__________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。

 、
、 、
、 、
、 、
、 、
、 等,现有一种利用该矿石制备高纯度
等,现有一种利用该矿石制备高纯度 工艺流程如图:
工艺流程如图:
已知:
 ,氢硫酸的两步电离常数分别为
,氢硫酸的两步电离常数分别为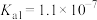 ,
,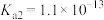 。
。(1)滤渣1的主要成分有S、
 、
、 ,根据滤渣成分,分析使用浓硫酸酸浸而不用盐酸的理由是
,根据滤渣成分,分析使用浓硫酸酸浸而不用盐酸的理由是(2)“氧化”时
 作氧化剂发生反应的离子方程式为
作氧化剂发生反应的离子方程式为(3)滤渣2的主要成分是
(4)沉镍时,当镍离子恰好沉淀完全(离子浓度小于
 ,可认为沉淀完全),要保证此时
,可认为沉淀完全),要保证此时 不会从溶液逸出,应控制溶液中
不会从溶液逸出,应控制溶液中 浓度不高于
浓度不高于 浓度约为
浓度约为 )。
)。(5)
 晶体具有
晶体具有 型结构(如图),实验测得
型结构(如图),实验测得 的晶胞参数为
的晶胞参数为 ,则与
,则与 距离最近的
距离最近的 有
有 (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。
您最近一年使用:0次
2024-02-02更新
|
368次组卷
|
2卷引用:辽宁省沈阳市第一二0中学2023-2024学年高三上学期第五次质量监测化学试题
5 . 高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):___________KMnO4+___________FeSO4+___________H2SO4→___________K2SO4+___________MnSO4+___________Fe2(SO4)3+___________H2O,下列说法正确的是
A.MnO 是氧化剂,Fe3+是还原产物 是氧化剂,Fe3+是还原产物 | B.Fe2+的还原性强于Mn2+ |
| C.生成物水的化学计量数是16 | D.生成4个水分子时,转移10个电子 |
您最近一年使用:0次
名校
解题方法
6 . 纳米铁是一种黑色粉末,可用于制作高密度磁性材料。以铁屑(含少量 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下:
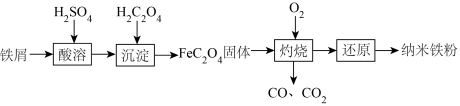
已知:草酸( )是一种二元酸
)是一种二元酸
(1)取少量产品分散于水中,通过_______ 效应,可验证所得铁粉直径是否为纳米级。
(2)写出“酸溶”时氧化还原反应的离子方程式:_______ 、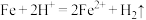 。
。
(3)若加入480mL1.5mol/LH2SO4时,铁屑与 恰好完全反应,为了使
恰好完全反应,为了使 元素完全转化,则沉淀过程中加入2mol/LH2C2O4的体积至少为
元素完全转化,则沉淀过程中加入2mol/LH2C2O4的体积至少为_______  。
。
(4) 固体在空气中灼烧后得到红棕色固体和
固体在空气中灼烧后得到红棕色固体和 、
、 混合气体,若产物中
混合气体,若产物中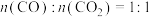 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为_______ 。
(5)纳米铁粉可用于处理含氧酸性废水中的 ,反应原理如图所示。
,反应原理如图所示。
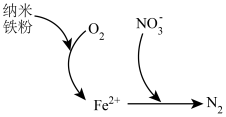
①该过程中体现了纳米铁粉的_______ 性(填“氧化”或“还原”)。
②在铁粉总量一定的条件下,废水中的溶解氧过多不利于 的去除,原因是
的去除,原因是_______ 。
(6)一定条件下,向 溶液中加入过量碱性
溶液中加入过量碱性 溶液,(B元素的化合价为+3价),溶液中
溶液,(B元素的化合价为+3价),溶液中 与
与 反应生成纳米铁粉、
反应生成纳米铁粉、 和
和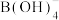 ,其离子方程式为
,其离子方程式为_______ 。
 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下:
已知:草酸(
 )是一种二元酸
)是一种二元酸(1)取少量产品分散于水中,通过
(2)写出“酸溶”时氧化还原反应的离子方程式:
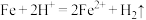 。
。(3)若加入480mL1.5mol/LH2SO4时,铁屑与
 恰好完全反应,为了使
恰好完全反应,为了使 元素完全转化,则沉淀过程中加入2mol/LH2C2O4的体积至少为
元素完全转化,则沉淀过程中加入2mol/LH2C2O4的体积至少为 。
。(4)
 固体在空气中灼烧后得到红棕色固体和
固体在空气中灼烧后得到红棕色固体和 、
、 混合气体,若产物中
混合气体,若产物中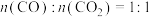 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为(5)纳米铁粉可用于处理含氧酸性废水中的
 ,反应原理如图所示。
,反应原理如图所示。
①该过程中体现了纳米铁粉的
②在铁粉总量一定的条件下,废水中的溶解氧过多不利于
 的去除,原因是
的去除,原因是(6)一定条件下,向
 溶液中加入过量碱性
溶液中加入过量碱性 溶液,(B元素的化合价为+3价),溶液中
溶液,(B元素的化合价为+3价),溶液中 与
与 反应生成纳米铁粉、
反应生成纳米铁粉、 和
和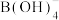 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2024-01-25更新
|
181次组卷
|
2卷引用:辽宁省六校协作体2023-2024学年高一上学期第三次考试化学试题
名校
解题方法
7 . 过渡元素现代社会得到广泛应用。请回答下列问题:
(1)稀土金属包括______ 、钇和钪,在合金中加入稀土金属,能大大改善合金的性能,稀土金属被称为“冶金工业的维生素”。
(2)钼系催化剂:(NH4)2O·4MoO3·2H2O主要用于石油炼制和化学工业中。高温用H2还原(NH4)2O·4MoO3·2H2O得金属钼,氧化剂与还原剂物质的量之比为______ 。
(3)ZnO、ZnS、Se共热可制备荧光材料ZnSe,同时产生了 ,写出该反应的化学方程式:
,写出该反应的化学方程式:______ 。
(4)高锰酸钾因其强氧化性和溶液颜色变化明显而被用于物质的鉴定。请写出SO2与酸性高锰酸钾溶液反应的离子方程式:______ 。(高锰酸根离子的还原产物为Mn2+)
(5)V2O5是化工生产中重要的催化剂,可用于制备硫酸和彩色玻璃。在硫酸酸化条件下,V2O5可与草酸(H2C2O4)溶液反应得到含VO2+的溶液,反应的离子方程式为______ 。
(6)镍主要用于合金(可用来制造货币等)及用作催化剂(如氢化的催化剂),常见化合价为+2价、+3价。已知镍的氢氧化物均不溶于水。请写出碱性条件下Ni2+与溴水反应的离子方程式:______ 。
(1)稀土金属包括
(2)钼系催化剂:(NH4)2O·4MoO3·2H2O主要用于石油炼制和化学工业中。高温用H2还原(NH4)2O·4MoO3·2H2O得金属钼,氧化剂与还原剂物质的量之比为
(3)ZnO、ZnS、Se共热可制备荧光材料ZnSe,同时产生了
 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)高锰酸钾因其强氧化性和溶液颜色变化明显而被用于物质的鉴定。请写出SO2与酸性高锰酸钾溶液反应的离子方程式:
(5)V2O5是化工生产中重要的催化剂,可用于制备硫酸和彩色玻璃。在硫酸酸化条件下,V2O5可与草酸(H2C2O4)溶液反应得到含VO2+的溶液,反应的离子方程式为
(6)镍主要用于合金(可用来制造货币等)及用作催化剂(如氢化的催化剂),常见化合价为+2价、+3价。已知镍的氢氧化物均不溶于水。请写出碱性条件下Ni2+与溴水反应的离子方程式:
您最近一年使用:0次
2024-01-14更新
|
186次组卷
|
2卷引用:辽宁省沈阳市第一二0中学2023-2024学年高一上学期第三次质量监测化学试题
名校
解题方法
8 . I.ClO2(其中O为-2价)是国际公认的一种安全、低毒的绿色消毒剂。熔点为-59.5℃,沸点为11.0℃,高浓度时极易爆炸,极易溶于水,遇热水易分解。实验室可用如图所示的装置制备ClO2 (装置A的酒精灯加热装置略去)。回答下列问题:
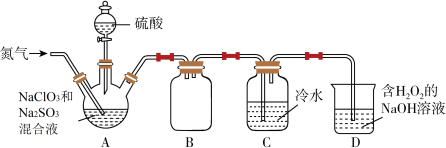
(1)下列关于ClO2分子结构和性质的说法错误的是___________ 。
A.分子中只含σ键 B.分子具有极性 C.分子的空间结构为V形
(2)实验开始即向装置A中通入氮气,目的是___________ 。
(3)装置A中反应的化学方程式为___________ ,装置B的作用是___________ 。
(4)装置D中吸收尾气的反应也可用于制备NaClO2,反应的离子方程式为___________ 。
Ⅱ.
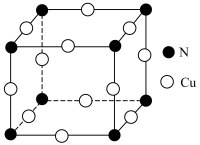
(5)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为___________ 。该化合物中Cu元素的化合价是___________ 价。

(1)下列关于ClO2分子结构和性质的说法错误的是
A.分子中只含σ键 B.分子具有极性 C.分子的空间结构为V形
(2)实验开始即向装置A中通入氮气,目的是
(3)装置A中反应的化学方程式为
(4)装置D中吸收尾气的反应也可用于制备NaClO2,反应的离子方程式为
Ⅱ.
(5)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为

您最近一年使用:0次
名校
解题方法
9 . MgF2是一种重要的无机化工原料,可用于制备多晶材料、光学玻璃。现有如下两种途径可以制得。
途径Ⅰ:以工业级MgSO4溶液(含Fe3+和Mn2+等杂质)为原料制备MgF2,过程如下:

(1)除杂
①向硫酸镁溶液中加入Na2SO4,加热、保持溶液温度在80~95℃,将Fe3+转化为Na2Fe6(SO4)4(OH)12沉淀,反应后滤液的pH___________ (填“增大”、“不变”或“减小”);
②调节滤液的pH,使溶液呈弱碱性,向其中加入H2O2,将Mn2+转化为MnO2沉淀,写出该反应的离子方程式___________ 。
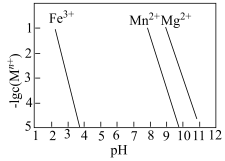
③Mn+(Fe3+、Mn2+、Mg2+)转变为氢氧化物沉淀的pH如图。除杂时未采取将Mn2+直接转化为Mn(OH)2的原因是___________ 。
(2)沉镁
向“除杂”后滤液中加入Na2CO3,同时产生气体,写出生成Mg2(OH)2CO3的化学方程式___________ 。
(3)酸溶
将所得Mg2(OH)2CO3置于___________ (填“玻璃”、“聚丙烯”或“石英”)烧杯中,加入适量的HF,搅拌溶解。
途径Ⅰ:以工业级MgSO4溶液(含Fe3+和Mn2+等杂质)为原料制备MgF2,过程如下:

(1)除杂
①向硫酸镁溶液中加入Na2SO4,加热、保持溶液温度在80~95℃,将Fe3+转化为Na2Fe6(SO4)4(OH)12沉淀,反应后滤液的pH
②调节滤液的pH,使溶液呈弱碱性,向其中加入H2O2,将Mn2+转化为MnO2沉淀,写出该反应的离子方程式
③Mn+(Fe3+、Mn2+、Mg2+)转变为氢氧化物沉淀的pH如图。除杂时未采取将Mn2+直接转化为Mn(OH)2的原因是

(2)沉镁
向“除杂”后滤液中加入Na2CO3,同时产生气体,写出生成Mg2(OH)2CO3的化学方程式
(3)酸溶
将所得Mg2(OH)2CO3置于
您最近一年使用:0次
2024-01-10更新
|
70次组卷
|
2卷引用:辽宁省沈阳市第十五中学2023-2024学年高二上学期12月月考化学试题
名校
10 . 化学在日常防疫中发挥了重要作用,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液;②H2O2(在水溶液中可部分电离);③ClO2;④O3;⑤碘酒;⑥75%酒精;⑦过氧乙酸(CH3COOOH);⑧高铁酸钠(Na2FeO4)。
回答下列问题:
(1)上述杀菌消毒剂属于非电解质的是________ (填序号)。
(2)臭氧比氧气具有更强的氧化性,可用于杀菌消毒。实验室可将氧气通过高压放电管来制取臭氧: 。
。
①将8L(标准状况)氧气通过放电管后,得到气体6.5L(标准状况),其中臭氧为______ L(标准状况)。
②实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后(气体全部参加反应),固体粉末的质量变为21.6g,则原混合气体中臭氧的体积分数为_______ ,原混合气体对氢气的相对密度为_______ 。
(3)各类杀菌消毒剂使用时,必须严格按照使用说明。
①巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应的离子方程式为_______ ;当有0.1molO2生成时,反应中转移电子的数目为_________ 。
②若混合使用“洁厕灵”(盐酸是成分之一)与“84”消毒液会产生有毒的黄绿色气体,其原因是________ (用离子方程式表示)。
(4)商业上常用“有效氯”来表明含氯消毒剂的消毒能力。若ag某种消毒剂的氧化能力与bg氯气相当,则其“有效氯”为 ,据此可知二氧化氯的“有效氯”为
,据此可知二氧化氯的“有效氯”为_______ %(保留3位有效数字)。
回答下列问题:
(1)上述杀菌消毒剂属于非电解质的是
(2)臭氧比氧气具有更强的氧化性,可用于杀菌消毒。实验室可将氧气通过高压放电管来制取臭氧:
 。
。①将8L(标准状况)氧气通过放电管后,得到气体6.5L(标准状况),其中臭氧为
②实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后(气体全部参加反应),固体粉末的质量变为21.6g,则原混合气体中臭氧的体积分数为
(3)各类杀菌消毒剂使用时,必须严格按照使用说明。
①巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应的离子方程式为
②若混合使用“洁厕灵”(盐酸是成分之一)与“84”消毒液会产生有毒的黄绿色气体,其原因是
(4)商业上常用“有效氯”来表明含氯消毒剂的消毒能力。若ag某种消毒剂的氧化能力与bg氯气相当,则其“有效氯”为
 ,据此可知二氧化氯的“有效氯”为
,据此可知二氧化氯的“有效氯”为
您最近一年使用:0次



