解题方法
1 .  在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。
(1)用丁达尔效应鉴别 胶体和
胶体和 溶液的操作是
溶液的操作是____________ (写出具体实验操作、结论)。
(2)电子工业中用 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:__________________ 。该反应的还原剂是______ 。
(3)硫化氢( )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为____________ 。该反应中氧化产物与还原产物的物质的量之比为______ 。
(4)某小组同学设计了制备无水) 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
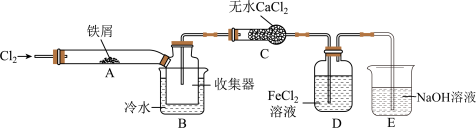
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的 ,赶尽装置中的空气;
,赶尽装置中的空气;
步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。
①装置A中发生反应的化学方程式为__________________ 。
②装置B中冷水浴的作用为____________ 。
 在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。(1)用丁达尔效应鉴别
 胶体和
胶体和 溶液的操作是
溶液的操作是(2)电子工业中用
 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)硫化氢(
 )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为(4)某小组同学设计了制备无水)
 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的
 ,赶尽装置中的空气;
,赶尽装置中的空气;步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入
 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。①装置A中发生反应的化学方程式为
②装置B中冷水浴的作用为
您最近半年使用:0次
解题方法
2 . 某消毒液的主要成分为NaClO,还含有一定量的NaCl和NaOH。下列用来解释事实的离子方程式不合理的是
A.该消毒液可用NaOH溶液吸收 来制备: 来制备: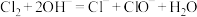 |
B.HClO的酸性弱于 : :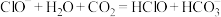 |
C.该消毒液与洁厕灵(主要成分为HCl)混用会产生有毒的 : : |
D.该消毒液加白醋会生成HClO,可增强漂白作用: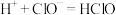 |
您最近半年使用:0次
解题方法
3 . 向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜,其反应过程如图所示。下列说法不正确 的是
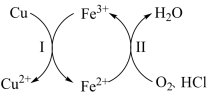

A.制备 的总反应为 的总反应为 |
B.反应Ⅰ中 作氧化剂 作氧化剂 |
C.反应Ⅱ中 作还原剂 作还原剂 |
D.还原性: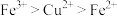 |
您最近半年使用:0次
解题方法
4 . 过氧化氢(H2O2,俗名为双氧水)、过氧化银(Ag2O2)广泛应用于抗菌消毒和化学能源等领域。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为_____ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为_____ 。
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:_____ 。
(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为_____ ,Ag2O2中O的化合价为_____ 。
②写出上述反应的化学方程式:_____ 。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn
 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为
②写出上述反应的化学方程式:
您最近半年使用:0次
2024-03-23更新
|
49次组卷
|
2卷引用:甘肃省白银市靖远县第二中学2023-2024学年高一上学期12月期末化学试题
5 . 对于反应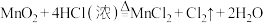
(1)MnO2在反应中电子____________ (填“得到”或“失去”),所含元素化合价____________ (填“升高”或“降低”),发生____________ 反应(填“氧化”或“还原”)。
(2)HCl在反应中____________ 电子(填“得到”或“失去”),所含元素化合价____________ (填“升高”或“降低”),发生____________ 反应(填“氧化”或“还原”)。
(3)配平下列化学方程式:
________ 
________ 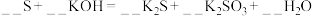
(4)用双线桥表示下列氧化还原反应。
①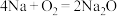
____________
②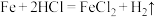
____________
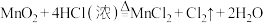
(1)MnO2在反应中电子
(2)HCl在反应中
(3)配平下列化学方程式:

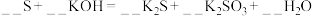
(4)用双线桥表示下列氧化还原反应。
①
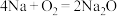
②
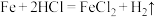
您最近半年使用:0次
6 . 黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,矿区中的黄铁矿暴露在空气中会被缓慢氧化,氧化过程如图所示。下列说法正确的是
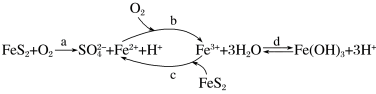

| A.d步生成的Fe(OH)3可作净水剂、消毒剂 |
B.a步发生反应的离子方程式为2FeS2+7O2+2H2O=2Fe2++4SO +4H+ +4H+ |
| C.空气中O2约占五分之一,0.1 mol FeS2完全被氧化时消耗标准状况下空气的体积约为8.4 L |
| D.缓慢氧化过程中对矿区的生态环境没有影响 |
您最近半年使用:0次
7 . H2O2是重要的化学试剂,在实验室和实际生产中应用广泛。
(1)H2O2有一定的还原性,能使酸性KMnO4溶液褪色。
①写出反应的离子方程式:______________ 。
②实验室常用酸性KMnO4标准液测定溶液中H2O2的浓度,酸性KMnO4溶液应盛放在___________ (填“酸式”或“碱式”)滴定管中,判断到达滴定终点的现象是___________ 。
(2)①我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:___________ 。
②在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是___________ 。
③利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:
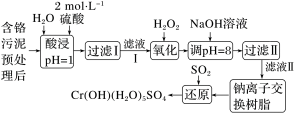
已知:硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。H2O2的作用是将滤液Ⅰ中的Cr3+转化为 ,写出此反应的离子方程式:
,写出此反应的离子方程式: ___________ 。
(3)H2O2是一种二元弱酸,写出其第一步电离的方程式:___________ ,它与过量的Ba(OH)2反应的化学方程式为________________ 。
(1)H2O2有一定的还原性,能使酸性KMnO4溶液褪色。
①写出反应的离子方程式:
②实验室常用酸性KMnO4标准液测定溶液中H2O2的浓度,酸性KMnO4溶液应盛放在
(2)①我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:
②在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是
③利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:

已知:硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。H2O2的作用是将滤液Ⅰ中的Cr3+转化为
 ,写出此反应的离子方程式:
,写出此反应的离子方程式: (3)H2O2是一种二元弱酸,写出其第一步电离的方程式:
您最近半年使用:0次
名校
8 . 写出下列反应的方程式:
(1)氢氧化亚铁沉淀在空气中迅速变为灰绿色,最终变成红褐色对应的化学方程式___________ 。
(2)工业用氯化铁溶液腐蚀铜印刷电路板的离子方程式___________ 。
(3)漂白粉在空气中生效的化学方程式___________ 。
(4)请写出次氯酸光照分解的离子方程式___________ 。
(5) 中的少量
中的少量 ,可以利用加入酸性
,可以利用加入酸性 溶液进行检验,请写出离子方程式
溶液进行检验,请写出离子方程式______ 。
(1)氢氧化亚铁沉淀在空气中迅速变为灰绿色,最终变成红褐色对应的化学方程式
(2)工业用氯化铁溶液腐蚀铜印刷电路板的离子方程式
(3)漂白粉在空气中生效的化学方程式
(4)请写出次氯酸光照分解的离子方程式
(5)
 中的少量
中的少量 ,可以利用加入酸性
,可以利用加入酸性 溶液进行检验,请写出离子方程式
溶液进行检验,请写出离子方程式
您最近半年使用:0次
9 . 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某工厂烟灰(主要成分为MgO、 、
、 、
、 、
、 等)为原料制备镁铝复合氧化物(
等)为原料制备镁铝复合氧化物(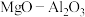 )为载体的负载型铜镍催化剂(
)为载体的负载型铜镍催化剂(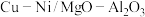 )的工艺流程如下:
)的工艺流程如下:

已知:25℃时各离子在该生产工艺条件下开始沉淀及完全沉淀时的pH如下表所示:
回答下列问题:
(1)为加快浸取速率,可采取的措施是___________ (写出一条即可)。
(2)“浸取”过程中NiO发生反应的离子方程式为___________ ,“滤渣”的主要成分是___________ (填化学式)。
(3)加热时尿素 在水中发生水解反应生成
在水中发生水解反应生成 和
和___________ 气体(写化学式)。
(4)25℃时若“晶化、过滤”所得滤液中 ,则滤液中的
,则滤液中的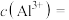
___________  。
。
(5)“晶化”过程中,需保持70℃的温度,通常采用水浴加热方式,其优点为___________ 。
(6)“洗涤”过程中检验滤饼是否洗干净的方法为___________ ;“洗涤、干燥”之后的工序为___________ 。
 、
、 、
、 、
、 等)为原料制备镁铝复合氧化物(
等)为原料制备镁铝复合氧化物(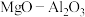 )为载体的负载型铜镍催化剂(
)为载体的负载型铜镍催化剂(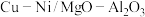 )的工艺流程如下:
)的工艺流程如下:
已知:25℃时各离子在该生产工艺条件下开始沉淀及完全沉淀时的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀时的pH | 3.4 | 4.8 | 7.7 | 9.1 |
完全沉淀时(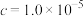 )的pH )的pH | 5.0 | 6.7 | 9.5 | 11.2 |
(1)为加快浸取速率,可采取的措施是
(2)“浸取”过程中NiO发生反应的离子方程式为
(3)加热时尿素
 在水中发生水解反应生成
在水中发生水解反应生成 和
和(4)25℃时若“晶化、过滤”所得滤液中
 ,则滤液中的
,则滤液中的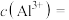
 。
。(5)“晶化”过程中,需保持70℃的温度,通常采用水浴加热方式,其优点为
(6)“洗涤”过程中检验滤饼是否洗干净的方法为
您最近半年使用:0次
名校
10 . 三氧化二砷(俗称砒霜,分子式As2O3)微溶于水。主要用于提炼单质砷及冶炼砷合金和制造半导体。从硫化砷渣(含As2S3、CuS、Bi2S3)中回收As2O3的流程如下:

回答下列问题:
(1)“碱浸”时,As2S3反应生成Na3AsO3和Na3AsS3的离子方程式为___________ ,该工序需要将硫化砷渣粉碎,其目的是___________ ;碱浸渣的主要成分为___________ (写化学式)。
(2)“氧化脱硫”时,Na3AsS3反应的化学方程式为___________ 。
(3)下列有关硫黄的性质和用途的说法错误的是___________ (填字母)。
a.不溶于水,易溶于乙醇 b.可用于制造农药、火柴、火药
c.易溶于二硫化碳 d.硫黄在足量氧气中燃烧生成三氧化硫
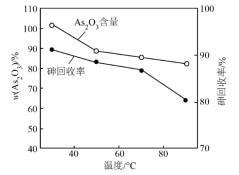
(4)“还原”时,反应的离子方程式为___________ ;该过程中,反应温度对产物中As2O3含量和砷的回收率的影响如图所示。随着温度升高,As2O3含量和砷的回收率逐渐降低的原因可能是___________ (写一点即可)。
(5)设计流程a、b的目的是___________ 。

回答下列问题:
(1)“碱浸”时,As2S3反应生成Na3AsO3和Na3AsS3的离子方程式为
(2)“氧化脱硫”时,Na3AsS3反应的化学方程式为
(3)下列有关硫黄的性质和用途的说法错误的是
a.不溶于水,易溶于乙醇 b.可用于制造农药、火柴、火药
c.易溶于二硫化碳 d.硫黄在足量氧气中燃烧生成三氧化硫
(4)“还原”时,反应的离子方程式为

(5)设计流程a、b的目的是
您最近半年使用:0次



