名校
1 . 几种中学化学常见的单质及其化合物相互转化的关系如图:
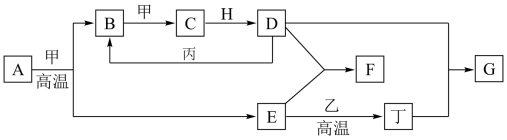
已知:
①甲、乙、丙、丁为单质,乙中元素在地壳中的含量占第三位,丙为红色固体,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③H常温下为无色、无味的液体,E常用作油漆、涂料的红色颜料。
回答下列问题:
(1)高温下,A和甲反应生成B和E的化学方程式为___________ ,每生成1 mol B,转移___________ mol电子。
(2)F的水溶液与丁单质反应也可以生成G,反应的离子方程式为___________ 。
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①②③。
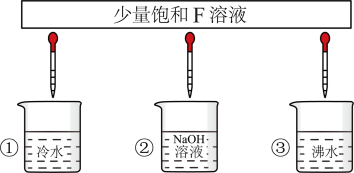
分散系②是___________ (填“胶体”“悬浊液”“乳浊液”或“溶液”),能鉴别分散系①③的实验现象称为___________ 。
(4)一定条件下,丙和D反应生成B的化学方程式为___________ 。

已知:
①甲、乙、丙、丁为单质,乙中元素在地壳中的含量占第三位,丙为红色固体,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③H常温下为无色、无味的液体,E常用作油漆、涂料的红色颜料。
回答下列问题:
(1)高温下,A和甲反应生成B和E的化学方程式为
(2)F的水溶液与丁单质反应也可以生成G,反应的离子方程式为
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①②③。

分散系②是
(4)一定条件下,丙和D反应生成B的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 大苏打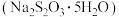 、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以1:2的物质的量之比配成溶液。再通入
以1:2的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ ; 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为_______ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因_______ 。
(3)下列关于苏打和小苏打的说法正确的是_______(选填字母序号)。
(4)向 的
的 溶液中通入一定量
溶液中通入一定量 ,充分反应后再向溶液中逐滴滴入
,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
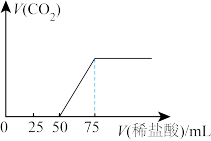
①通入 后形成溶液的溶质成分是
后形成溶液的溶质成分是_______ (填化学式);
②原 溶液的浓度为
溶液的浓度为_______  。
。
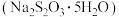 、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以1:2的物质的量之比配成溶液。再通入
以1:2的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程式
,写出该反应的化学方程式 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是_______(选填字母序号)。
| A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用 |
| B.苏打和小苏打的相互转化属于可逆反应 |
C.采用加热法除去 溶液中混有的 溶液中混有的 |
| D.小苏打和全锌化铝均可治疗胃酸 |
 的
的 溶液中通入一定量
溶液中通入一定量 ,充分反应后再向溶液中逐滴滴入
,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
①通入
 后形成溶液的溶质成分是
后形成溶液的溶质成分是②原
 溶液的浓度为
溶液的浓度为 。
。
您最近一年使用:0次
2023-09-24更新
|
50次组卷
|
2卷引用:甘肃省民乐县第一中学2023-2024学年高三上学期第一次诊断考试化学试题
名校
3 . 三氧化二砷(俗称砒霜,分子式As2O3)微溶于水。主要用于提炼单质砷及冶炼砷合金和制造半导体。从硫化砷渣(含As2S3、CuS、Bi2S3)中回收As2O3的流程如下:

回答下列问题:
(1)“碱浸”时,As2S3反应生成Na3AsO3和Na3AsS3的离子方程式为___________ ,该工序需要将硫化砷渣粉碎,其目的是___________ ;碱浸渣的主要成分为___________ (写化学式)。
(2)“氧化脱硫”时,Na3AsS3反应的化学方程式为___________ 。
(3)下列有关硫黄的性质和用途的说法错误的是___________ (填字母)。
a.不溶于水,易溶于乙醇 b.可用于制造农药、火柴、火药
c.易溶于二硫化碳 d.硫黄在足量氧气中燃烧生成三氧化硫
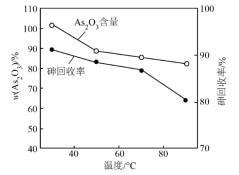
(4)“还原”时,反应的离子方程式为___________ ;该过程中,反应温度对产物中As2O3含量和砷的回收率的影响如图所示。随着温度升高,As2O3含量和砷的回收率逐渐降低的原因可能是___________ (写一点即可)。
(5)设计流程a、b的目的是___________ 。

回答下列问题:
(1)“碱浸”时,As2S3反应生成Na3AsO3和Na3AsS3的离子方程式为
(2)“氧化脱硫”时,Na3AsS3反应的化学方程式为
(3)下列有关硫黄的性质和用途的说法错误的是
a.不溶于水,易溶于乙醇 b.可用于制造农药、火柴、火药
c.易溶于二硫化碳 d.硫黄在足量氧气中燃烧生成三氧化硫
(4)“还原”时,反应的离子方程式为

(5)设计流程a、b的目的是
您最近一年使用:0次
名校
解题方法
4 . 科学家舍勒和戴维对氯气的制取和研究做出了重大贡献。
I.某化学小组设计如图装置制备少量纯净干燥的氯气,试回答下列问题:
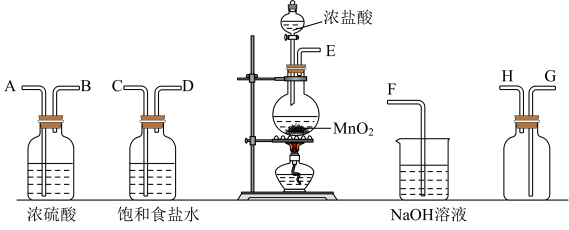
(1)盛有浓盐酸的仪器名称_______ ,装置的正确连接顺序为E→_______ →F。
(2)气体发生装置中发生反应的化学方程式为_______ 。
(3)装置中饱和食盐水的作用是_______ 。
(4)请用离子方程式表示装置中的氢氧化钠溶液的作用_______ 。
II.一种以氯气和生石灰(CaO)为原料制备KClO3的流程如图:
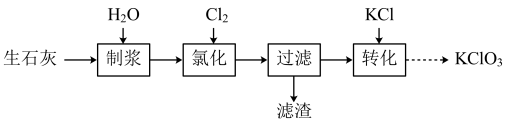
注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(5)氯化过程中需缓慢通入Cl2的目的是_______ 。
(6)根据如图的溶解度曲线(如图),回答下列问题。
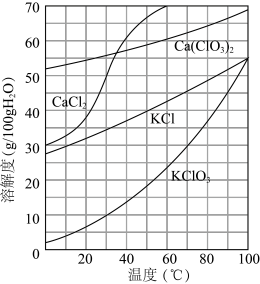
向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是_______ 。若溶液中KClO3的含量为100g•L-1,从该溶液中尽可能多地析出KClO3固体的方法是_______ 。
I.某化学小组设计如图装置制备少量纯净干燥的氯气,试回答下列问题:

(1)盛有浓盐酸的仪器名称
(2)气体发生装置中发生反应的化学方程式为
(3)装置中饱和食盐水的作用是
(4)请用离子方程式表示装置中的氢氧化钠溶液的作用
II.一种以氯气和生石灰(CaO)为原料制备KClO3的流程如图:

注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(5)氯化过程中需缓慢通入Cl2的目的是
(6)根据如图的溶解度曲线(如图),回答下列问题。

向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是
您最近一年使用:0次
名校
解题方法
5 . 汽车尾气已成为城市空气的主要污染源,治理汽车尾气的SCR(选择性催化还原)和NSR (NOx储存还原)技术均可有效降低柴油发动机工作过程中排放的NOx。
(1)SCR工作原理
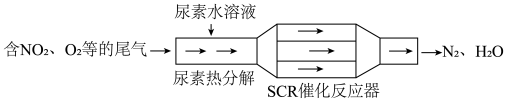
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式是___________ 。
②反应器中NH3还原NO2的化学方程式是___________ 。
(2)NSR(NOx储存还原)的工作原理如下图所示,柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,通过BaO和Ba(NO3)2的相互转化实现NOx 的储存和还原。

①BaO吸收NO2的反应中氧化剂与还原剂的物质的量之比是___________ 。
②富燃条件下Pt表面反应的化学方程式是___________ 。
③若柴油中硫含量较高,在稀燃过程中,BaO吸收氮氧化物的能力下降至很低水平,结合化学方程式解释原因:___________ 。
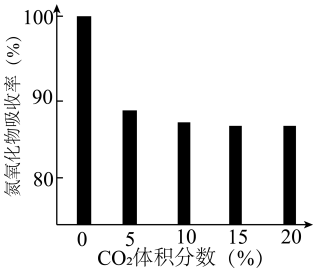
④研究发现:尾气中的CO2对BaO吸收氮氧化物有影响。一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如下图所示。则:一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因是___________ ;当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,原因可能是___________ 。
(1)SCR工作原理

①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式是
②反应器中NH3还原NO2的化学方程式是
(2)NSR(NOx储存还原)的工作原理如下图所示,柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,通过BaO和Ba(NO3)2的相互转化实现NOx 的储存和还原。

①BaO吸收NO2的反应中氧化剂与还原剂的物质的量之比是
②富燃条件下Pt表面反应的化学方程式是
③若柴油中硫含量较高,在稀燃过程中,BaO吸收氮氧化物的能力下降至很低水平,结合化学方程式解释原因:
④研究发现:尾气中的CO2对BaO吸收氮氧化物有影响。一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如下图所示。则:一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因是

您最近一年使用:0次
2021-04-17更新
|
658次组卷
|
4卷引用:甘肃省天水市甘谷县2023-2024学年高三上学期第一次检测化学试题
6 . 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀,而被广泛用作高新科技材料,并被誉为“未来金属”,但在高温时钛化合能力极强,可以与氧、碳、氮及其他元素化合。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,同时获得副产品甲的工业生产流程如下:
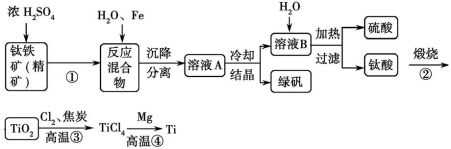
回答下列问题:
(1)已知反应①钛铁矿和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成。则该反应属于______ (填“氧化还原反应”或“非氧化还原反应”),写出该反应的化学方程式:_________ 。
(2)写出上述反应②、③的化学方程式:_________________________ 。
(3)反应④要在氩气氛围中进行的理由是______________________ ,最终所得到的金属钛中会混有少量杂质,可加入_______ 溶解后除去。
(4)用熔融法直接电解TiO2也能制取金属钛,该反应的化学方程式为_________ 。
(5)如果取钛铁矿m吨,杂质的百分含量为w,最终生产出钛n吨(不考虑损耗),则m、n、w三者之间的数学关系是_______ (已知Ti的相对原子质量为48)。

回答下列问题:
(1)已知反应①钛铁矿和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成。则该反应属于
(2)写出上述反应②、③的化学方程式:
(3)反应④要在氩气氛围中进行的理由是
(4)用熔融法直接电解TiO2也能制取金属钛,该反应的化学方程式为
(5)如果取钛铁矿m吨,杂质的百分含量为w,最终生产出钛n吨(不考虑损耗),则m、n、w三者之间的数学关系是
您最近一年使用:0次



