大苏打 、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以1:2的物质的量之比配成溶液。再通入
以1:2的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ ; 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为_______ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因_______ 。
(3)下列关于苏打和小苏打的说法正确的是_______(选填字母序号)。
(4)向 的
的 溶液中通入一定量
溶液中通入一定量 ,充分反应后再向溶液中逐滴滴入
,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
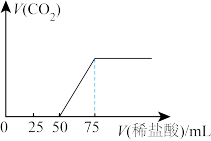
①通入 后形成溶液的溶质成分是
后形成溶液的溶质成分是_______ (填化学式);
②原 溶液的浓度为
溶液的浓度为_______  。
。
 、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以1:2的物质的量之比配成溶液。再通入
以1:2的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程式
,写出该反应的化学方程式 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是_______(选填字母序号)。
| A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用 |
| B.苏打和小苏打的相互转化属于可逆反应 |
C.采用加热法除去 溶液中混有的 溶液中混有的 |
| D.小苏打和全锌化铝均可治疗胃酸 |
 的
的 溶液中通入一定量
溶液中通入一定量 ,充分反应后再向溶液中逐滴滴入
,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
①通入
 后形成溶液的溶质成分是
后形成溶液的溶质成分是②原
 溶液的浓度为
溶液的浓度为 。
。
更新时间:2023-09-24 09:02:51
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示:
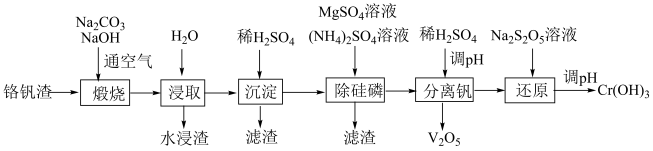
已知:i)最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在;
存在;
ii)pH<7时,硅元素以H2SiO3形式存在;
iii)pH在4-12之间,铝元素以Al(OH)3形式存在。
回答下列问题:
(1)Cr元素的价电子轨道表示式_________ 。
(2)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为______ (填化学式)。
(3)水浸渣中主要物质为______ (填化学式)。
(4)“沉淀”步骤调pH到弱碱性,主要除去的杂质为_______ (填化学式)。
(5)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH以达到最好的除杂效果,下列说法中,正确的是______ 。
a.若pH过小,磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀
b.若pH过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若pH过大,会导致镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质
d.若pH过大,溶液中铵根离子浓度增大,降低导致MgNH4PO4无法完全沉淀
(6)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有______ (填标号)。
A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为________ 。

已知:i)最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在;
存在;ii)pH<7时,硅元素以H2SiO3形式存在;
iii)pH在4-12之间,铝元素以Al(OH)3形式存在。
回答下列问题:
(1)Cr元素的价电子轨道表示式
(2)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(3)水浸渣中主要物质为
(4)“沉淀”步骤调pH到弱碱性,主要除去的杂质为
(5)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH以达到最好的除杂效果,下列说法中,正确的是
a.若pH过小,磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀
b.若pH过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若pH过大,会导致镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质
d.若pH过大,溶液中铵根离子浓度增大,降低导致MgNH4PO4无法完全沉淀
(6)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
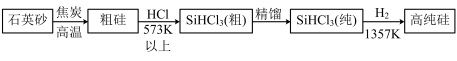
①写出由纯SiHCl3制备高纯硅的化学反应方程式_____________________ 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种酸,写出并配平化学反应方程式_____________________ ;H2还原SiHCl3过程中若混入O2,可能引起的后果是_______________________ 。
(2)下列有关硅材料的说法正确的是________ 。
(3)自然界中硅酸盐种类多,结构复杂,通常用二氧化硅和金属氧化物的形式来表示其组成.如正长石(KAlSi3O8),氧化物形式为___________________
(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为________ ,水玻璃在工业上有许多用途,试举出一例________ 。
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种酸,写出并配平化学反应方程式
(2)下列有关硅材料的说法正确的是________ 。
| A.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高,硬度很大 |
(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的工艺流程如图:

已知:①黄钠铁矾[Na2Fe6(SO4)4(OH)12]不溶于水。
②CoCl2的溶解度曲线如图所示:

回答下列问题:
(1)钴与铁具有相似的化学性质,溶解过程中Co与稀硫酸反应生成的氧化产物为____ (填化学式,下同)。溶解后过滤,得到的滤渣是____ ,滤液中含有过量的硫酸。
(2)在加热、搅拌条件下,向(1)中所得滤液中加入NaClO3,目的是____ ,NaClO3被还原为NaCl,反应的离子方程为____ 。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6],亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是:取少许氧化后的溶液于试管中,滴加几滴____ (填“铁氰化钾溶液”或“亚铁氰化钾溶液”),若____ (填现象),则说明Fe2+已全部被氧化。
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾沉淀,反应过程中,参加反应的CO 转变为
转变为____ (填化学式)。
(5)流程图中,加入适量的NaOH,得到的是碱式碳酸钴[Co2(OH)2CO3]沉淀。向碱式碳酸钴沉淀中加入足量稀盐酸,边加热边搅拌至完全溶解,溶解后需趁热过滤,原因是____ 。

已知:①黄钠铁矾[Na2Fe6(SO4)4(OH)12]不溶于水。
②CoCl2的溶解度曲线如图所示:

回答下列问题:
(1)钴与铁具有相似的化学性质,溶解过程中Co与稀硫酸反应生成的氧化产物为
(2)在加热、搅拌条件下,向(1)中所得滤液中加入NaClO3,目的是
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6],亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是:取少许氧化后的溶液于试管中,滴加几滴
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾沉淀,反应过程中,参加反应的CO
 转变为
转变为(5)流程图中,加入适量的NaOH,得到的是碱式碳酸钴[Co2(OH)2CO3]沉淀。向碱式碳酸钴沉淀中加入足量稀盐酸,边加热边搅拌至完全溶解,溶解后需趁热过滤,原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】根据如图所示的转化关系推断各物质。已知A为谈黄色固体,常温下B和C为气体,H为单质。A、D、E、H灼烧时焰色试验为黄色,回答下列问题:

(1)请写出物质的化学式:H___________ 、E___________ 。
(2)图中反应属于非氧化还原反应的是___________ (填标号)。
(3)反应④的离子方程为___________ 。
(4)写出反应①的化学方程式,并用双线桥表示该反应电子转移___________ 。
(5)D固体中含有少量的E,可采用的除杂方法为___________ ,如果涉及化学反应。请写出化学反应方程式___________ 。
(6)请写出A物质的常见用途:___________ 。

(1)请写出物质的化学式:H
(2)图中反应属于非氧化还原反应的是
(3)反应④的离子方程为
(4)写出反应①的化学方程式,并用双线桥表示该反应电子转移
(5)D固体中含有少量的E,可采用的除杂方法为
(6)请写出A物质的常见用途:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】无机物转化题。A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:

(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________ ,B的俗名____________ ;
②反应Ⅱ的离子方程式是_____________ 。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅱ的离子方程式是____________ ;
②反应Ⅲ的离子方程式表示反应__________ ;
③检验B中阳离子最好的试剂是_________ (写化学式)。
(3)C与NaOH溶液反应,用离子方程式表示产生此现象的过程________ 、_____ 。

(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式
②反应Ⅱ的离子方程式是
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅱ的离子方程式是
②反应Ⅲ的离子方程式表示反应
③检验B中阳离子最好的试剂是
(3)C与NaOH溶液反应,用离子方程式表示产生此现象的过程
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】为测定碳酸钠纯度(只含有少量氯化钠),学生设计了如下两个实验方案。
[方案1]称取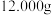 样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
(1)写出生成沉淀的反应方程式__________________ 。
(2)过滤操作需要的玻璃仪器__________________ 。
(3)计算碳酸钠的质量分数为______________ (保留两位小数)。
[方案2]用下图装置,排液法测定 的体积,并根据样品质量和
的体积,并根据样品质量和 的体积计算
的体积计算

(4)为了减小测定 的体积误差,量气管中加入的液体
的体积误差,量气管中加入的液体 为
为______ (填化学式)。
(5)通过实验,测得该试样中碳酸钠的质量分数偏高,产生这种现象的原因可能是______ 。
A.测定气体体积时未冷却至室温
B.气体进入量气管前未用浓硫酸干燥
C. 型管中留有反应生成的气体
型管中留有反应生成的气体
D.反应结束后读数时水准管的水面高于量气管的水面
[方案1]称取
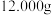 样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。(1)写出生成沉淀的反应方程式
(2)过滤操作需要的玻璃仪器
(3)计算碳酸钠的质量分数为
[方案2]用下图装置,排液法测定
 的体积,并根据样品质量和
的体积,并根据样品质量和 的体积计算
的体积计算
(4)为了减小测定
 的体积误差,量气管中加入的液体
的体积误差,量气管中加入的液体 为
为(5)通过实验,测得该试样中碳酸钠的质量分数偏高,产生这种现象的原因可能是
A.测定气体体积时未冷却至室温
B.气体进入量气管前未用浓硫酸干燥
C.
 型管中留有反应生成的气体
型管中留有反应生成的气体D.反应结束后读数时水准管的水面高于量气管的水面
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。
(1)工业上“侯氏制碱法”以NaCl、 、
、 及水等为原料制备纯碱,其反应原理为:
及水等为原料制备纯碱,其反应原理为: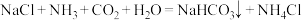 。生产纯碱的工艺流程示意图如下:
。生产纯碱的工艺流程示意图如下:

请回答下列问题:
①析出的 晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是:
晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是:___________ 。
②该工艺流程中可回收再利用的物质是___________ 。
(2)实验室需要240mL2.00mol/L的 溶液:
溶液:
①所用仪器除天平、烧杯、药匙、玻璃棒、胶头滴管外还有___________ (填仪器名称);
②下列操作会造成所配溶液的浓度偏高的是___________ (填序号)
a.定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.发现凹液面超过刻度线,立即将多余溶液吸出
d.溶液转移至容量瓶中后没有洗涤烧杯
(3)常温下在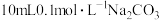 溶液中逐滴加入
溶液中逐滴加入 溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如下图所示。
溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如下图所示。

根据图示回答下列问题:
①在同一溶液中, 、
、 、
、
___________ (填“能”或“不能”)大量共存。
②将 和
和 混合并配成溶液,向溶液中滴加
混合并配成溶液,向溶液中滴加 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成 的物质的量的关系的是
的物质的量的关系的是___________ (填字母)。

(4)若称取16.8g纯净的 固体,加热一段时间后,剩余固体的质量为13.7g。如果把剩余的固体全部加入到
固体,加热一段时间后,剩余固体的质量为13.7g。如果把剩余的固体全部加入到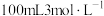 的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度
的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度___________ (设溶液的体积变化及盐酸的挥发忽略不计)(写出计算过程)。
(1)工业上“侯氏制碱法”以NaCl、
 、
、 及水等为原料制备纯碱,其反应原理为:
及水等为原料制备纯碱,其反应原理为: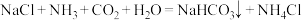 。生产纯碱的工艺流程示意图如下:
。生产纯碱的工艺流程示意图如下:
请回答下列问题:
①析出的
 晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是:
晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是:②该工艺流程中可回收再利用的物质是
(2)实验室需要240mL2.00mol/L的
 溶液:
溶液:①所用仪器除天平、烧杯、药匙、玻璃棒、胶头滴管外还有
②下列操作会造成所配溶液的浓度偏高的是
a.定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.发现凹液面超过刻度线,立即将多余溶液吸出
d.溶液转移至容量瓶中后没有洗涤烧杯
(3)常温下在
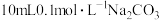 溶液中逐滴加入
溶液中逐滴加入 溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如下图所示。
溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如下图所示。
根据图示回答下列问题:
①在同一溶液中,
 、
、 、
、
②将
 和
和 混合并配成溶液,向溶液中滴加
混合并配成溶液,向溶液中滴加 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成 的物质的量的关系的是
的物质的量的关系的是
(4)若称取16.8g纯净的
 固体,加热一段时间后,剩余固体的质量为13.7g。如果把剩余的固体全部加入到
固体,加热一段时间后,剩余固体的质量为13.7g。如果把剩余的固体全部加入到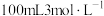 的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度
的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学兴趣小组采用如下图所示装置研究NaHCO3分解的CO2与Na2O2反应。
(1)装置乙中应装入的药品为___________ ,其作用为___________
(2)装置丙中仪器名称是___________ ,其中反应的化学方程式是___________ ,该反应中氧化剂与还原剂的质量比为___________ 。
(3)装置丁中NaOH溶液的作用是___________ ,装置戊中澄清石灰水的作用是___________ 。
Ⅱ.NaHCO3俗称小苏打,工业上可通过侯氏制碱法制取(又称联合制碱法,由我国近代著名的化工学家侯德榜发明)。
(4)写出侯氏制碱法中生成NaHCO3的离子方程式___________ 。操作时,往饱和食盐水中先通入___________ 气体,原因是___________ 。
(5)在密闭容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反应。若残留固体为纯净物,则起始时 应满足的条件是
应满足的条件是___________ 。

(1)装置乙中应装入的药品为
(2)装置丙中仪器名称是
(3)装置丁中NaOH溶液的作用是
Ⅱ.NaHCO3俗称小苏打,工业上可通过侯氏制碱法制取(又称联合制碱法,由我国近代著名的化工学家侯德榜发明)。
(4)写出侯氏制碱法中生成NaHCO3的离子方程式
(5)在密闭容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反应。若残留固体为纯净物,则起始时
 应满足的条件是
应满足的条件是
您最近一年使用:0次

 、
、 、
、 、
、 、KOH五种溶液中的一种,现利用X溶液鉴别它们,试根据下图关系回答问题:
、KOH五种溶液中的一种,现利用X溶液鉴别它们,试根据下图关系回答问题:


