名校
解题方法
1 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性。由于
,其水溶液呈碱性。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: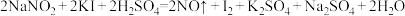
(1)在下面方框中写出氧化剂和还原剂的化学式及其系数,并用单线桥法标出电子转移的方向和数目:______

(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.盐 c.碱 d.非电解质 e.电解质
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是
和NaCl的是___________ (填序号)。
A.分别溶于水,并滴加几滴酚酞溶液
B.分别加强热并收集气体检验
C.用筷子分别蘸取固体品尝味道
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式:___________ ,产生氮气分子和转移电子数目比为:___________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性。由于
,其水溶液呈碱性。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: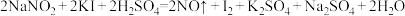
(1)在下面方框中写出氧化剂和还原剂的化学式及其系数,并用单线桥法标出电子转移的方向和数目:

(2)从物质分类角度来看,
 是
是a.酸 b.盐 c.碱 d.非电解质 e.电解质
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是
和NaCl的是A.分别溶于水,并滴加几滴酚酞溶液
B.分别加强热并收集气体检验
C.用筷子分别蘸取固体品尝味道
(5)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C. |
D.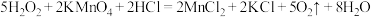 |
您最近一年使用:0次
名校
解题方法
2 . 三氯氧钒(VOCl3,M=173.5g/mol)是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。已知三氯氧钒为黄色液体,密度为1.84g/cm3,熔点为-77℃,沸点为126℃,遇水会迅速水解生成HCl和一种氧化物。某小组同学利用如图装置以氯气、V2O5和碳粉为原料制备三氯氧钒。
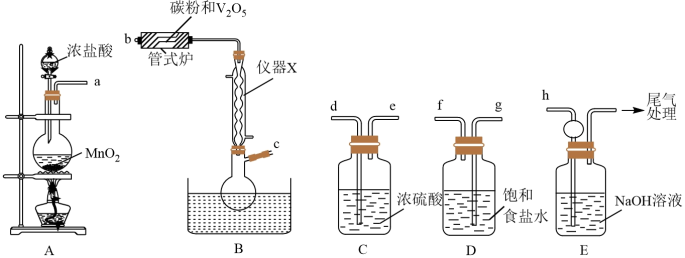
回答下列问题:
(1)仪器X的名称为___________ 。
(2)从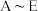 中选择必要的仪器制备VOCl3,正确的连接顺序是
中选择必要的仪器制备VOCl3,正确的连接顺序是___________ (按气流方向,用小写字母表示,装置可重复使用)。
(3)装置A中发生反应的离子方程式为___________ 。
(4)管式炉中发生反应生成CO的化学方程式为___________ 。
(5)装置D的作用为___________ 。
(6)装置E的作用为___________ 。
(7)实验过程中正确的加热顺序为___________ (填序号)。
①先点燃A处酒精灯,再加热管式炉
②先加热管式炉,再点燃A处酒精灯
(8)若管式炉中加入 和
和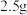 的碳粉,通入足量氯气充分反应后,在装置
的碳粉,通入足量氯气充分反应后,在装置 的烧瓶中最终收集到
的烧瓶中最终收集到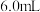 黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为___________ (保留3位有效数字)。

回答下列问题:
(1)仪器X的名称为
(2)从
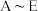 中选择必要的仪器制备VOCl3,正确的连接顺序是
中选择必要的仪器制备VOCl3,正确的连接顺序是(3)装置A中发生反应的离子方程式为
(4)管式炉中发生反应生成CO的化学方程式为
(5)装置D的作用为
(6)装置E的作用为
(7)实验过程中正确的加热顺序为
①先点燃A处酒精灯,再加热管式炉
②先加热管式炉,再点燃A处酒精灯
(8)若管式炉中加入
 和
和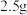 的碳粉,通入足量氯气充分反应后,在装置
的碳粉,通入足量氯气充分反应后,在装置 的烧瓶中最终收集到
的烧瓶中最终收集到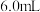 黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
您最近一年使用:0次
2023-10-09更新
|
645次组卷
|
4卷引用:甘肃省张掖市民乐县第一中学2023-2024学年高三上学期第二次诊断(期中)考试化学试题
名校
3 . 几种中学化学常见的单质及其化合物相互转化的关系如图:
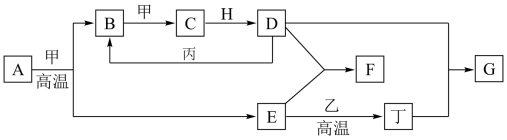
已知:
①甲、乙、丙、丁为单质,乙中元素在地壳中的含量占第三位,丙为红色固体,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③H常温下为无色、无味的液体,E常用作油漆、涂料的红色颜料。
回答下列问题:
(1)高温下,A和甲反应生成B和E的化学方程式为___________ ,每生成1 mol B,转移___________ mol电子。
(2)F的水溶液与丁单质反应也可以生成G,反应的离子方程式为___________ 。
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①②③。
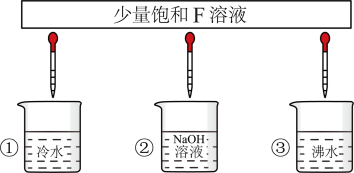
分散系②是___________ (填“胶体”“悬浊液”“乳浊液”或“溶液”),能鉴别分散系①③的实验现象称为___________ 。
(4)一定条件下,丙和D反应生成B的化学方程式为___________ 。

已知:
①甲、乙、丙、丁为单质,乙中元素在地壳中的含量占第三位,丙为红色固体,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③H常温下为无色、无味的液体,E常用作油漆、涂料的红色颜料。
回答下列问题:
(1)高温下,A和甲反应生成B和E的化学方程式为
(2)F的水溶液与丁单质反应也可以生成G,反应的离子方程式为
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①②③。

分散系②是
(4)一定条件下,丙和D反应生成B的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 工业综合处理含NH 废水和含N2、CO2、SO2、NO、CO的废气,得到无毒气体b,流程如下:
废水和含N2、CO2、SO2、NO、CO的废气,得到无毒气体b,流程如下:
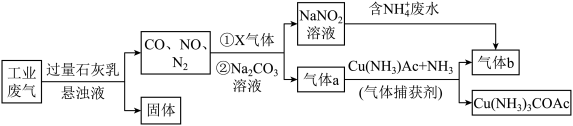
下列说法正确的是
 废水和含N2、CO2、SO2、NO、CO的废气,得到无毒气体b,流程如下:
废水和含N2、CO2、SO2、NO、CO的废气,得到无毒气体b,流程如下:
下列说法正确的是
| A.“固体”中含有CaSO4、CaSO3和CaCO3 |
B.X气体、NO与Na2CO3溶液的离子反应:4NO+O2+CO = 4NO = 4NO +CO2 +CO2 |
C.处理含NH 的废水时,离子方程式为NH 的废水时,离子方程式为NH +NO +NO = N2↑+2H2O = N2↑+2H2O |
| D.捕获剂捕获气体a中发生络合反应Cu(NH3)Ac+CO+NH3=Cu(NH3)3COAc |
您最近一年使用:0次
5 . NaHSO3是常见的亚硫酸盐,在潮湿的空气中易被氧化,在工业生产和实验室都有着广泛的应用。为探究NaHSO3溶液的性质,甲同学配制了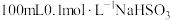 溶液。做了如下实验:
溶液。做了如下实验:
(1)配制溶液需用到的玻璃仪器有玻璃棒、量筒、烧杯、_____ 、_____ 。
(2)常温下,用pH计测量新配制的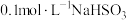 溶液的pH,测得pH约为4.1。
溶液的pH,测得pH约为4.1。
①若在实验室用pH试纸测量溶液的pH,其简单操作为_____ 。
②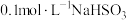 溶液呈酸性,说明H2SO3的第二步电离常数Ka2
溶液呈酸性,说明H2SO3的第二步电离常数Ka2_____ (填“>”、“<”或“=”) 的第二步水解常数
的第二步水解常数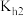 。
。
(3)将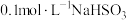 溶液与
溶液与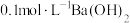 溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:
溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:_____ 。
探究白色沉淀的成分:
提出猜想:
a.只有BaSO3 b.只有BaSO4 c._____
验证猜想:
乙同学认为猜想b不正确,原因为_____
将白色沉淀加入足量盐酸中,若有气泡生成,且沉淀全部溶解,证明猜想a正确;若_____ ,证明猜想c正确。
(4)将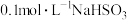 溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:_____ 。该现象说明NaHSO3溶液具有_____ (填“氧化性”、“还原性”或“氧化性和还原性”)。
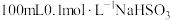 溶液。做了如下实验:
溶液。做了如下实验:(1)配制溶液需用到的玻璃仪器有玻璃棒、量筒、烧杯、
(2)常温下,用pH计测量新配制的
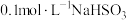 溶液的pH,测得pH约为4.1。
溶液的pH,测得pH约为4.1。①若在实验室用pH试纸测量溶液的pH,其简单操作为
②
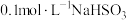 溶液呈酸性,说明H2SO3的第二步电离常数Ka2
溶液呈酸性,说明H2SO3的第二步电离常数Ka2 的第二步水解常数
的第二步水解常数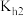 。
。(3)将
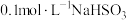 溶液与
溶液与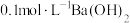 溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:
溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:探究白色沉淀的成分:
提出猜想:
a.只有BaSO3 b.只有BaSO4 c.
验证猜想:
乙同学认为猜想b不正确,原因为
将白色沉淀加入足量盐酸中,若有气泡生成,且沉淀全部溶解,证明猜想a正确;若
(4)将
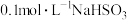 溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
您最近一年使用:0次
2023-10-02更新
|
95次组卷
|
2卷引用:广东省东莞市部分名校高三上(9月联考)-化学试题
名校
6 . 工业制备硝酸的过程中,会产生氮的氧化物等空气污染物。为减少环境污染,需要用氢氧化钠溶液吸收尾气,反应的化学方程式为 ,则
,则 的化学式为
的化学式为
 ,则
,则 的化学式为
的化学式为A. | B. | C. | D.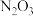 |
您最近一年使用:0次
名校
解题方法
7 . 以黄铜矿( )为主要原料的炼铜方法之一是生物浸出法:在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
)为主要原料的炼铜方法之一是生物浸出法:在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
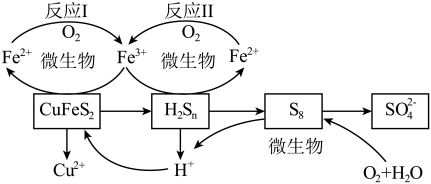
下列说法不正确的是
 )为主要原料的炼铜方法之一是生物浸出法:在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
)为主要原料的炼铜方法之一是生物浸出法:在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
下列说法不正确的是
A.反应Ⅰ、Ⅱ中的离子方程式均为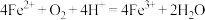 |
| B.此浸出过程,温度越高,浸出率越高 |
C.在微生物的作用下,可以循环使用的物质有 和 和 |
D.假如黄铜矿中的铁元素最终全部转化为 ,当有 ,当有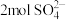 生成时,理论上消耗 生成时,理论上消耗 的物质的量为 的物质的量为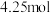 |
您最近一年使用:0次
2023-09-24更新
|
142次组卷
|
3卷引用:甘肃省张掖市高台县第一中学2023-2024学年高三上学期9月月考化学试题
名校
解题方法
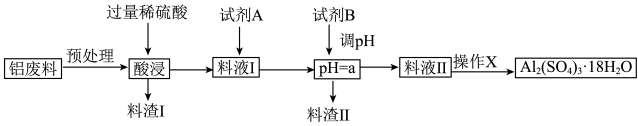
8 . 硫酸铝在造纸、水净化、土壤改良中有着广泛应用。某化工厂利用含铅废料(成分为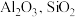 及少量
及少量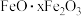 )制备硫酸铝晶体的工艺流程如下图所示,回答相关问题。
)制备硫酸铝晶体的工艺流程如下图所示,回答相关问题。
已知生成氢氧化物沉淀的 如下表:
如下表:
(1)“预处理”时需要将铝废料粉碎,目的是_______ 。
(2)料渣Ⅰ的成分是_______ ,酸浸时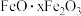 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)试剂 是一种液态绿色氧化剂,料液Ⅰ中反应的离子方程式
是一种液态绿色氧化剂,料液Ⅰ中反应的离子方程式_______ 。
(4) 的范围是
的范围是_______ ,试剂B最好是_______ ,目的是_______ 。(用离子方程式和必要的文字描述)
(5)操作 的内容是
的内容是_______ 、过滤、洗涤、干燥等。
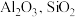 及少量
及少量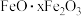 )制备硫酸铝晶体的工艺流程如下图所示,回答相关问题。
)制备硫酸铝晶体的工艺流程如下图所示,回答相关问题。
已知生成氢氧化物沉淀的
 如下表:
如下表: |  |  | |
开始沉淀时 | 3.6 | 6.3 | 2.3 |
完全沉淀时 | 4.9 | 8.3 | 3.2 |
(2)料渣Ⅰ的成分是
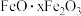 发生反应的离子方程式为
发生反应的离子方程式为(3)试剂
 是一种液态绿色氧化剂,料液Ⅰ中反应的离子方程式
是一种液态绿色氧化剂,料液Ⅰ中反应的离子方程式(4)
 的范围是
的范围是(5)操作
 的内容是
的内容是
您最近一年使用:0次
名校
解题方法
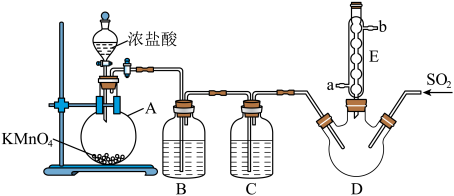
9 . 硫酰氯(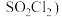 是一种重要的化工试济,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):
是一种重要的化工试济,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):
已知:① (1)
(1)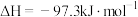 。
。
②常温下硫酰氯为无色液体,熔点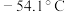 ,沸点
,沸点 ,在潮湿空气中“发烟”。
,在潮湿空气中“发烟”。
③ 以上或长时间存放硫酰氯都易分解,生成
以上或长时间存放硫酰氯都易分解,生成 和
和 。
。
回答下列问题:
(1)硫酰氯在潮湿空气中“发烟”的原因是_______ (用化学方程式表示)。
(2)装置A中发生反应的离子方程式为_______ 。
(3)仪器 的名称为
的名称为_______ ,其作用是_______ 。
(4)整套装置存在一处明显的缺䧄,请你提出改进措施_______ 。
(5)当装置A中生成氯气 (已折算成标准状况)时,则最终得到纯净的硫酰氯5.4g。硫酰氯的产率为
(已折算成标准状况)时,则最终得到纯净的硫酰氯5.4g。硫酰氯的产率为_______ 。
(6)氯磺酸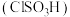 加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为
加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_______ ,从分解的产物中分离出硫酰氯的操作方法是_______ 。
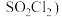 是一种重要的化工试济,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):
是一种重要的化工试济,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):
已知:①
 (1)
(1)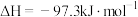 。
。②常温下硫酰氯为无色液体,熔点
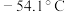 ,沸点
,沸点 ,在潮湿空气中“发烟”。
,在潮湿空气中“发烟”。③
 以上或长时间存放硫酰氯都易分解,生成
以上或长时间存放硫酰氯都易分解,生成 和
和 。
。回答下列问题:
(1)硫酰氯在潮湿空气中“发烟”的原因是
(2)装置A中发生反应的离子方程式为
(3)仪器
 的名称为
的名称为(4)整套装置存在一处明显的缺䧄,请你提出改进措施
(5)当装置A中生成氯气
 (已折算成标准状况)时,则最终得到纯净的硫酰氯5.4g。硫酰氯的产率为
(已折算成标准状况)时,则最终得到纯净的硫酰氯5.4g。硫酰氯的产率为(6)氯磺酸
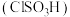 加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为
加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
10 . 大苏打 、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以1:2的物质的量之比配成溶液。再通入
以1:2的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ ; 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为_______ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因_______ 。
(3)下列关于苏打和小苏打的说法正确的是_______(选填字母序号)。
(4)向 的
的 溶液中通入一定量
溶液中通入一定量 ,充分反应后再向溶液中逐滴滴入
,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
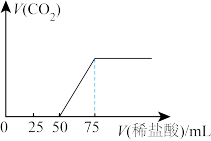
①通入 后形成溶液的溶质成分是
后形成溶液的溶质成分是_______ (填化学式);
②原 溶液的浓度为
溶液的浓度为_______  。
。
 、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以1:2的物质的量之比配成溶液。再通入
以1:2的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程式
,写出该反应的化学方程式 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是_______(选填字母序号)。
| A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用 |
| B.苏打和小苏打的相互转化属于可逆反应 |
C.采用加热法除去 溶液中混有的 溶液中混有的 |
| D.小苏打和全锌化铝均可治疗胃酸 |
 的
的 溶液中通入一定量
溶液中通入一定量 ,充分反应后再向溶液中逐滴滴入
,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
①通入
 后形成溶液的溶质成分是
后形成溶液的溶质成分是②原
 溶液的浓度为
溶液的浓度为 。
。
您最近一年使用:0次
2023-09-24更新
|
50次组卷
|
2卷引用:甘肃省民乐县第一中学2023-2024学年高三上学期第一次诊断考试化学试题



