解题方法
1 . 过氧化氢(H2O2,俗名为双氧水)、过氧化银(Ag2O2)广泛应用于抗菌消毒和化学能源等领域。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为_____ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为_____ 。
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn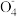 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:_____ 。
(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为_____ ,Ag2O2中O的化合价为_____ 。
②写出上述反应的化学方程式:_____ 。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn
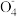 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为
②写出上述反应的化学方程式:
您最近一年使用:0次
2024-03-23更新
|
52次组卷
|
2卷引用:甘肃省白银市靖远县第二中学2023-2024学年高一上学期12月期末化学试题
2 . 对于反应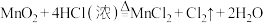
(1)MnO2在反应中电子____________ (填“得到”或“失去”),所含元素化合价____________ (填“升高”或“降低”),发生____________ 反应(填“氧化”或“还原”)。
(2)HCl在反应中____________ 电子(填“得到”或“失去”),所含元素化合价____________ (填“升高”或“降低”),发生____________ 反应(填“氧化”或“还原”)。
(3)配平下列化学方程式:
________ 
________ 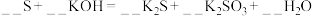
(4)用双线桥表示下列氧化还原反应。
①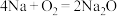
____________
②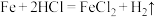
____________
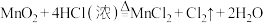
(1)MnO2在反应中电子
(2)HCl在反应中
(3)配平下列化学方程式:

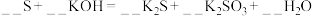
(4)用双线桥表示下列氧化还原反应。
①
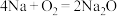
②
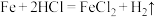
您最近一年使用:0次
解题方法
3 .  在常温下就可以与
在常温下就可以与 反应,化学方程式如下:
反应,化学方程式如下: (白色固体)
(白色固体) (未配平),设阿伏加德罗常数的值为
(未配平),设阿伏加德罗常数的值为 ,回答下列问题。
,回答下列问题。
(1)配平化学方程式,并用单线桥法表示电子转移的方向和数目:___________ 。
___________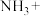 ___________
___________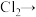 ___________
___________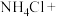 ___________
___________
(2)上述反应中的氧化产物为___________ (填化学式),氧化剂与还原剂的物质的量之比为___________ 。
(3)当生成1mol氮气时,被氧化的物质的质量为___________ ,反应中转移电子数为___________  。
。
(4)下列说法中正确的是___________(填字母)。
(5)已知:CuO能够和 在加热条件下反应生成两种单质,写出在加热条件下CuO和
在加热条件下反应生成两种单质,写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:___________ 。
 在常温下就可以与
在常温下就可以与 反应,化学方程式如下:
反应,化学方程式如下: (白色固体)
(白色固体) (未配平),设阿伏加德罗常数的值为
(未配平),设阿伏加德罗常数的值为 ,回答下列问题。
,回答下列问题。(1)配平化学方程式,并用单线桥法表示电子转移的方向和数目:
___________
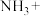 ___________
___________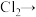 ___________
___________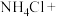 ___________
___________
(2)上述反应中的氧化产物为
(3)当生成1mol氮气时,被氧化的物质的质量为
 。
。(4)下列说法中正确的是___________(填字母)。
| A.上述反应中能观察到有白烟产生 |
| B.上述反应中生成的气体有刺激性气味 |
C. 不含金属阳离子,不属于盐类 不含金属阳离子,不属于盐类 |
| D.可用浓氨水来检验氯气管道是否泄漏 |
 在加热条件下反应生成两种单质,写出在加热条件下CuO和
在加热条件下反应生成两种单质,写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)请用“双线桥”表示上述反应电子转移的方向和数目_______ 。
(2)请将上述反应改写成离子方程式________ 。
(3)浓盐酸在反应中体现出来的性质有______ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
(4)若反应生成21.3g氯气,则消耗还原剂的质量为______ g。
II.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是______ 。(填化学式)
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:________ 。
②每生成1个FeO 转移
转移______ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)请将上述反应改写成离子方程式
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
(4)若反应生成21.3g氯气,则消耗还原剂的质量为
II.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个FeO
 转移
转移
您最近一年使用:0次
名校
解题方法
5 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性。由于
,其水溶液呈碱性。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: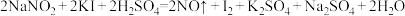
(1)在下面方框中写出氧化剂和还原剂的化学式及其系数,并用单线桥法标出电子转移的方向和数目:______

(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.盐 c.碱 d.非电解质 e.电解质
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是
和NaCl的是___________ (填序号)。
A.分别溶于水,并滴加几滴酚酞溶液
B.分别加强热并收集气体检验
C.用筷子分别蘸取固体品尝味道
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式:___________ ,产生氮气分子和转移电子数目比为:___________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性。由于
,其水溶液呈碱性。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: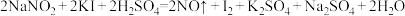
(1)在下面方框中写出氧化剂和还原剂的化学式及其系数,并用单线桥法标出电子转移的方向和数目:

(2)从物质分类角度来看,
 是
是a.酸 b.盐 c.碱 d.非电解质 e.电解质
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是
和NaCl的是A.分别溶于水,并滴加几滴酚酞溶液
B.分别加强热并收集气体检验
C.用筷子分别蘸取固体品尝味道
(5)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C. |
D.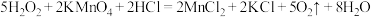 |
您最近一年使用:0次
名校
6 . 工业制备硝酸的过程中,会产生氮的氧化物等空气污染物。为减少环境污染,需要用氢氧化钠溶液吸收尾气,反应的化学方程式为 ,则
,则 的化学式为
的化学式为
 ,则
,则 的化学式为
的化学式为A. | B. | C. | D.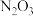 |
您最近一年使用:0次
7 . 在离子方程式xR2++yH++O2=mR3++nH2O中,对系数m和R3+的判断正确的是
| A.m=4;R2+是氧化剂 |
| B.m=y;R3+是氧化产物 |
| C.m=2;R2+是氧化剂 |
| D.m=y;R3+是还原产物 |
您最近一年使用:0次
2023-08-25更新
|
314次组卷
|
2卷引用:甘肃省武威市凉州区部分校2023-2024学年高三上学期第二次模拟考试化学试题
名校
8 . 某实验小组对Cu与 的反应进行研究,实验如下。
的反应进行研究,实验如下。

(1)试管①中反应的化学方程式是_______ 。
(2)已知绿色是棕色和蓝色的混合色,绿色溶液变蓝是因为 与水生成了
与水生成了 和
和_______ 。
(3)对比③和⑤中现象,为探究③中立即产生气泡的原因,实验小组提出如下假设,并设计实验验证。
假设1: 对该反应有催化作用。
对该反应有催化作用。
假设2: 对该反应有催化作用。
对该反应有催化作用。
假设3: 对该反应有催化作用。
对该反应有催化作用。
(4)得出实验结论后,有同学认为还应补充对比实验:向④溶液加入几滴较浓的硝酸后加入铜片。补充该实验的目的是_______ 。
(5)某工厂用硝酸溶解废铜屑制备 ,为避免
,为避免 的生成,实验小组提出还应加入
的生成,实验小组提出还应加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ ;消耗含铜元素80%的废铜屑240 kg固体时,得到653.4 kg产品,产率为_______ 。
 的反应进行研究,实验如下。
的反应进行研究,实验如下。
(1)试管①中反应的化学方程式是
(2)已知绿色是棕色和蓝色的混合色,绿色溶液变蓝是因为
 与水生成了
与水生成了 和
和(3)对比③和⑤中现象,为探究③中立即产生气泡的原因,实验小组提出如下假设,并设计实验验证。
假设1:
 对该反应有催化作用。
对该反应有催化作用。假设2:
 对该反应有催化作用。
对该反应有催化作用。假设3:
 对该反应有催化作用。
对该反应有催化作用。| 序号 | 实验操作 | 实验现象 | 结论 |
| 3 | 向④中溶液加入少量 | 溶液蓝色加深,无其他明显现象 | 假设1不成立 |
| 4 | 铜片表面立即产生气泡 | 假设2成立 | |
| 5 | 向②中溶液通入少量 | 无明显变化 | |
| 6 | 向④中溶液加入少量 | 铜片表面立即产生气泡 | 假设3成立 |
(5)某工厂用硝酸溶解废铜屑制备
 ,为避免
,为避免 的生成,实验小组提出还应加入
的生成,实验小组提出还应加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为
您最近一年使用:0次
2023-05-04更新
|
595次组卷
|
9卷引用:甘肃省平凉市静宁县文萃中学2023-2024学年高三上学期第三次模拟考试化学试题
甘肃省平凉市静宁县文萃中学2023-2024学年高三上学期第三次模拟考试化学试题福建省龙岩市一级校2022-2023学年高三上学期期末联考化学试题(已下线)考点11 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)物质含量的测定辽宁省部分县级重点中学2023-2024学年高三上学期11月期中考试化学试题广东省佛山市2023-2024学年高三上学期12月月考化学试题广东省深圳外国语学校(集团)高中部 2023-2024学年高三上学期第四次月考化学试题河北省部分学校2023-2024学年上学期高三七调考试化学试题广东省深圳市福田区福田中学2023-2024学年高三上学期12月月考化学考试
9 . 氮、硫及其化合物是重要的化工原料,研究其性质、用途和转化具有重要意义。
(1)氮的化合物常用作制冷剂的是___________ (填名称)。
(2)燃煤排放的尾气中含有二氧化硫、氮的氧化物(主要为NO)等污染物,工业上采用NaClO碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为___________ ,实验证明相对于SO2,NO更难脱除,其原因可能是___________ 。
(3)将3.84gCu和稀硝酸充分反应,生成的气体体积为___________ L(在标准状况下),用排水法收集该气体,将收集到的气体的试管倒立于水槽中缓缓通入___________ LO2(标准状况)使NO恰好完全反应,写出观察到的现象:___________ 。

(1)氮的化合物常用作制冷剂的是
(2)燃煤排放的尾气中含有二氧化硫、氮的氧化物(主要为NO)等污染物,工业上采用NaClO碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为
(3)将3.84gCu和稀硝酸充分反应,生成的气体体积为

您最近一年使用:0次
名校
10 . 已知 ,则c为
,则c为
 ,则c为
,则c为| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2023-03-03更新
|
115次组卷
|
2卷引用:甘肃省张掖市高台县第一中学2022-2023学年高一下学期2月月考化学试题



