解题方法
1 .  是重要的化工原料,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在,在酸性溶液中易生成S和
是重要的化工原料,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在,在酸性溶液中易生成S和 。工业上用硫化碱法制备
。工业上用硫化碱法制备 的反应方程式为:
的反应方程式为: ,实验室用此法制备
,实验室用此法制备 的装置如图所示:
的装置如图所示:

请回答下列问题:
(1)仪器a的名称为_______ 。
(2) 的制备:①先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开
的制备:①先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开  ,关闭
,关闭 ,调节
,调节 使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开
使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开  ,关闭
,关闭 、
、 ,原因是
,原因是 _______ ;②将装置C中所得溶液经一系列操作,最后洗涤、干燥,得到 样品。洗涤时为尽可能避免产品损失应选用的试剂是
样品。洗涤时为尽可能避免产品损失应选用的试剂是 _______ 。
a.水 b.乙醇 c.氢氧化钠溶液 d.稀盐酸
制备 的上述装置的明显不足是
的上述装置的明显不足是 _______ 。
(3) 样品纯度的测定:称取
样品纯度的测定:称取 样品,配制成200mL溶液;在锥形瓶中加入
样品,配制成200mL溶液;在锥形瓶中加入

 溶液和过量的酸性KI溶液,再滴入几滴淀粉溶液,立即用所配
溶液和过量的酸性KI溶液,再滴入几滴淀粉溶液,立即用所配  溶液滴定,当
溶液滴定,当 _______ 时达到滴定终点,测得消耗 溶液的体积为
溶液的体积为  ,则样品中硫代硫酸钠的质量分数为
,则样品中硫代硫酸钠的质量分数为 _______  。
。 已知:
已知: 的相对分子质量为158 , 相关反应:
的相对分子质量为158 , 相关反应: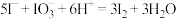 ;
; 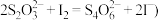
(4) 的应用:其溶液可除去漂白的织物及纸浆中残留的氯气,硫代硫酸钠被氧化成
的应用:其溶液可除去漂白的织物及纸浆中残留的氯气,硫代硫酸钠被氧化成 ,反应的离子方程式为
,反应的离子方程式为_______ 。
 是重要的化工原料,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在,在酸性溶液中易生成S和
是重要的化工原料,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在,在酸性溶液中易生成S和 。工业上用硫化碱法制备
。工业上用硫化碱法制备 的反应方程式为:
的反应方程式为: ,实验室用此法制备
,实验室用此法制备 的装置如图所示:
的装置如图所示:
请回答下列问题:
(1)仪器a的名称为
(2)
 的制备:①先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开
的制备:①先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开  ,关闭
,关闭 ,调节
,调节 使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开
使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开  ,关闭
,关闭 、
、 ,原因是
,原因是  样品。洗涤时为尽可能避免产品损失应选用的试剂是
样品。洗涤时为尽可能避免产品损失应选用的试剂是 a.水 b.乙醇 c.氢氧化钠溶液 d.稀盐酸
制备
 的上述装置的明显不足是
的上述装置的明显不足是 (3)
 样品纯度的测定:称取
样品纯度的测定:称取 样品,配制成200mL溶液;在锥形瓶中加入
样品,配制成200mL溶液;在锥形瓶中加入

 溶液和过量的酸性KI溶液,再滴入几滴淀粉溶液,立即用所配
溶液和过量的酸性KI溶液,再滴入几滴淀粉溶液,立即用所配  溶液滴定,当
溶液滴定,当  溶液的体积为
溶液的体积为  ,则样品中硫代硫酸钠的质量分数为
,则样品中硫代硫酸钠的质量分数为  。
。 已知:
已知: 的相对分子质量为158 , 相关反应:
的相对分子质量为158 , 相关反应: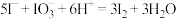 ;
; 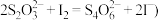
(4)
 的应用:其溶液可除去漂白的织物及纸浆中残留的氯气,硫代硫酸钠被氧化成
的应用:其溶液可除去漂白的织物及纸浆中残留的氯气,硫代硫酸钠被氧化成 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
2 . 氯化亚砜( )是一种无色易挥发的液体,沸点为
)是一种无色易挥发的液体,沸点为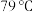 ,与水剧烈反应时液面上有雾生成,并有刺激性气体逸出。
,与水剧烈反应时液面上有雾生成,并有刺激性气体逸出。 可以作脱水剂,与
可以作脱水剂,与 混合共热制取无水
混合共热制取无水 。某实验小组同学欲用下列装置制取无水
。某实验小组同学欲用下列装置制取无水 ,同时回收剩余的
,同时回收剩余的 并验证生成物中有
并验证生成物中有 。下列说法错误的是
。下列说法错误的是

 )是一种无色易挥发的液体,沸点为
)是一种无色易挥发的液体,沸点为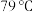 ,与水剧烈反应时液面上有雾生成,并有刺激性气体逸出。
,与水剧烈反应时液面上有雾生成,并有刺激性气体逸出。 可以作脱水剂,与
可以作脱水剂,与 混合共热制取无水
混合共热制取无水 。某实验小组同学欲用下列装置制取无水
。某实验小组同学欲用下列装置制取无水 ,同时回收剩余的
,同时回收剩余的 并验证生成物中有
并验证生成物中有 。下列说法错误的是
。下列说法错误的是
A.装置的连接顺序为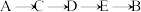 |
| B.B中新增的阴离子可能有3种 |
C.该小组同学认为直接将 置于坩埚中加热也能制得无水 置于坩埚中加热也能制得无水 |
D.若用 作 作 的脱水剂可能会发生氧化还原反应,可以用酸性 的脱水剂可能会发生氧化还原反应,可以用酸性 溶液来检验是否有 溶液来检验是否有 生成 生成 |
您最近一年使用:0次
名校
解题方法
3 . 钴酸锂电池的正极材料含有钴酸锂(LiCoO2)、铝箔及少量铁等,其通过如下图流程可回收铝、钴、锂。请回答下列问题:
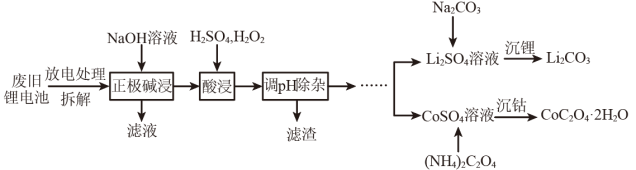
(1) 中Co的化合价为
中Co的化合价为_______ 。
(2)钴酸锂电池放电总反应为: ,则其负极的电极反应式为
,则其负极的电极反应式为_______ 。
(3)“酸浸”时Co、Li元素的浸出率随温度的变化如图所示:
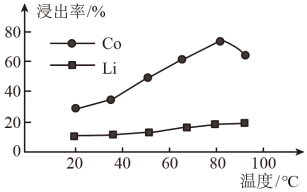
“酸浸”的适宜温度约为_______ ℃[所填数据限整数],若酸浸主要反应的化学方程式为:
 ,则上述反应过程中消耗的氧化剂与还原剂物质的量之比为
,则上述反应过程中消耗的氧化剂与还原剂物质的量之比为_______ 。
(4)“调pH除杂”的目的是使 沉淀完全[即
沉淀完全[即 ],则常温下应控制
],则常温下应控制
_______ [保留到小数点后1位,另外已知常温时 的
的 为
为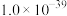 ]。
]。
(5)沉锂的离子反应方程式为_______ 。
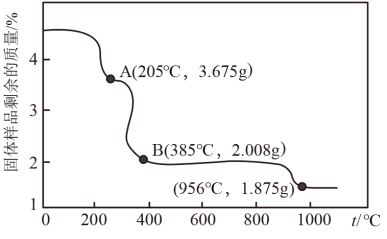
(6)准确称取4.575g的 样品,在空气中加热分解获取金属氧化物,固体样品的剩余质量随温度的变化如下图所示(已知385℃及以上残留固体均为金属氧化物),请写出B处物质与浓盐酸反应的化学方程式
样品,在空气中加热分解获取金属氧化物,固体样品的剩余质量随温度的变化如下图所示(已知385℃及以上残留固体均为金属氧化物),请写出B处物质与浓盐酸反应的化学方程式_______ 。

(1)
 中Co的化合价为
中Co的化合价为(2)钴酸锂电池放电总反应为:
 ,则其负极的电极反应式为
,则其负极的电极反应式为(3)“酸浸”时Co、Li元素的浸出率随温度的变化如图所示:

“酸浸”的适宜温度约为

 ,则上述反应过程中消耗的氧化剂与还原剂物质的量之比为
,则上述反应过程中消耗的氧化剂与还原剂物质的量之比为(4)“调pH除杂”的目的是使
 沉淀完全[即
沉淀完全[即 ],则常温下应控制
],则常温下应控制
 的
的 为
为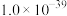 ]。
]。(5)沉锂的离子反应方程式为
(6)准确称取4.575g的
 样品,在空气中加热分解获取金属氧化物,固体样品的剩余质量随温度的变化如下图所示(已知385℃及以上残留固体均为金属氧化物),请写出B处物质与浓盐酸反应的化学方程式
样品,在空气中加热分解获取金属氧化物,固体样品的剩余质量随温度的变化如下图所示(已知385℃及以上残留固体均为金属氧化物),请写出B处物质与浓盐酸反应的化学方程式
您最近一年使用:0次
2022-01-17更新
|
294次组卷
|
2卷引用:湖南省岳阳市岳阳县2021-2022学年高三上学期入学考试化学试题
名校
4 . 写出下列方程式
(1)写出下列物质在水中的电离方程式:
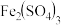
____________________ ,NaHSO4________________ ,
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应____________ ,
氢氧化钡溶液与稀硫酸反应_________ ;
(3)利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

①“酸溶”时,Fe2O3与硫酸反应的化学方程式为__________ 。
②已知滤渣Ⅰ的主要成分是FeS2、S和SiO2;Fe3+被FeS2还原的离子方程式为______ 。
③“氧化”中,生成FeOOH的离子方程式为_______ 。
(1)写出下列物质在水中的电离方程式:
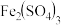
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应
氢氧化钡溶液与稀硫酸反应
(3)利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

①“酸溶”时,Fe2O3与硫酸反应的化学方程式为
②已知滤渣Ⅰ的主要成分是FeS2、S和SiO2;Fe3+被FeS2还原的离子方程式为
③“氧化”中,生成FeOOH的离子方程式为
您最近一年使用:0次
名校
5 . X溶液中含有下表所示离子中的5种,且其离子个数相等。向X溶液中加入足量稀盐酸有气体生成,反应前后阴离子种类不变。下列叙述错误 的是(已知 对应还原产物为NO)
对应还原产物为NO)
 对应还原产物为NO)
对应还原产物为NO)| 阳离子 | Na+、Fe3+、Ba2+、Fe2+、Mg2+、Al3+ |
| 阴离子 | OH-、 、 、 、 、 、 、 、Cl- 、Cl- |
| A.X溶液中含有3种阳离子、2种阴离子 |
| B.原溶液中一定含有Mg2+ |
C.溶液中不可能含有 和 和 |
D.生成气体的离子反应方程式为3Fe2++ +4H+=3Fe3++NO↑+2H2O +4H+=3Fe3++NO↑+2H2O |
您最近一年使用:0次
2021-12-04更新
|
786次组卷
|
6卷引用:湖南省岳阳县一中 汨罗市一中2021-2022学年高一上学期期中联考化学试题
名校
解题方法
6 . 用含铬不锈钢废渣(含SiO2、Cr2O3、Fe2O3、Al2O3等)制取Cr2O3(铬绿)的工艺流程如图所示:

回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是_______ (答一条即可)。
(2)Cr2O3、KOH、O2反应生成K2CrO4的化学方程式为_______ 。
(3)“水浸”时,碱熔渣中的KFeO2强烈与水反应生成的难溶物为_______ (填化学式,下同);为检验“水浸”后的滤液中是否含有Fe3+,可选用的化学试剂是_______ 溶液。
(4)常温下,“酸化”时pH不宜过低(pH低即酸性强)的原因是防止_______ (填元素名称)元素进入溶液;
(5)“还原”时发生反应的离子方程式为_______ 。

回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是
(2)Cr2O3、KOH、O2反应生成K2CrO4的化学方程式为
(3)“水浸”时,碱熔渣中的KFeO2强烈与水反应生成的难溶物为
(4)常温下,“酸化”时pH不宜过低(pH低即酸性强)的原因是防止
(5)“还原”时发生反应的离子方程式为
您最近一年使用:0次
名校
7 . 碳、硅、锗、锡、铅属于同一主族元素,其单质及化合物具有重要的用途。
(1)铅蓄电池是最早使用的充电电池,其构造示意图如图所示,放电时的离子反应方程式为PbO2+Pb+4H++2 =2PbSO4+2H2O。该电池的负极为
=2PbSO4+2H2O。该电池的负极为_______ ,电池放电时正极质量将_______ 。(填“增大”、“减小”或“不变”)

(2)PbO2可发生如图所示的转化:

①写出“还原”反应的离子方程式:__________ ;
②写出“复分解”反应的化学方程式:___________ 。
(3)1400℃~1450℃时,石英、焦炭和氮气可反应生成耐高温、硬度大的化合物X,该反应的化学方程式为3SiO2+6C+2N2 X+6CO。
X+6CO。
①X的化学式为_______ 。
②下列措施不 能提高该反应速率的是_______ (填字母)。
a.将石英和焦炭充分混合 b.增大N2的浓度 c.将粉末状石英换成块状石英
(4)甲醇是常见的燃料电池原料,CO2催化氢化可合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。在2L容器中充入1molCO2和3moH2的混合气体,反应10min后,气体的总物质的量变为原来的75%。则0~10min内,H2的平均反应速率为_______ 。
(1)铅蓄电池是最早使用的充电电池,其构造示意图如图所示,放电时的离子反应方程式为PbO2+Pb+4H++2
 =2PbSO4+2H2O。该电池的负极为
=2PbSO4+2H2O。该电池的负极为
(2)PbO2可发生如图所示的转化:

①写出“还原”反应的离子方程式:
②写出“复分解”反应的化学方程式:
(3)1400℃~1450℃时,石英、焦炭和氮气可反应生成耐高温、硬度大的化合物X,该反应的化学方程式为3SiO2+6C+2N2
 X+6CO。
X+6CO。①X的化学式为
②下列措施
a.将石英和焦炭充分混合 b.增大N2的浓度 c.将粉末状石英换成块状石英
(4)甲醇是常见的燃料电池原料,CO2催化氢化可合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。在2L容器中充入1molCO2和3moH2的混合气体,反应10min后,气体的总物质的量变为原来的75%。则0~10min内,H2的平均反应速率为
您最近一年使用:0次
2021-05-03更新
|
286次组卷
|
2卷引用:湖南省岳阳临湘市2020-2021学年高一下学期期末考试化学试题
名校
8 . 黄铁矿(主要成分FeS2),在空气中会被缓慢氧化,氧化过程如图所示。下列说法不正确的是


| A.发生反应a时,0.05 mol FeS2被氧化时消耗标准状况下氧气的体积大约3.92 L |
| B.为了验证b过程反应后溶液中含Fe2+,可选用KSCN溶液和氯水 |
C.c发生反应的离子方程式为:14Fe3++FeS2+8H2O=15Fe2++2 +16H+ +16H+ |
| D.已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,则该温度下d反应的逆反应的平衡常数为K=2.79×103 |
您最近一年使用:0次
名校
9 . 图中展示的是乙烯催化氧化的过程(部分配平相关离子未画出),下列描述错误的是


A.PbCl 和Cu2+在反应中都起到催化剂的作用 和Cu2+在反应中都起到催化剂的作用 |
| B.该转化过程中,仅O2和Cu2+均体现了氧化性 |
| C.该转化过程中,涉及反应4Cu+ +O2+4H+=4Cu2++2H2O |
D.乙烯催化氧化的反应方程式为2CH2=CH2 + O2  2CH3CHO 2CH3CHO |
您最近一年使用:0次
2020-12-18更新
|
1677次组卷
|
15卷引用:湖南省岳阳市2021届高三二模考试化学试题
湖南省岳阳市2021届高三二模考试化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)河北省唐山市一中2020-2021学年高二下学期期中考试化学试题安徽省六校教育研究会2022届高三第一次素质测试化学试题安徽省合肥市第六中学2022届高三上学期开学考试化学试题湖南省郴州市2022届高三上学期第一次月考化学试题河北省石家庄市第二中学2021-2022学年高三上学期10月联考化学试题安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题重庆市第八中学校2021届高三高考适应性月考卷(三)化学试题辽宁省协作体2021-2022学年下学期高三第一次模拟考试化学试题辽宁省阜新市实验中学2021-2022学年高三下学期第一次模拟考试化学试题辽宁省葫芦岛市四校2022-2023学年高三上学期期中联考化学试题天津市和平区2023届高三下学期第一次质量调查化学试题湖北省武汉市重点中学5G联合体2022-2023学年高二下学期期末考试化学试题
解题方法
10 . 铋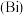 与氮同主族,在中性及碱性环境下常以
与氮同主族,在中性及碱性环境下常以 的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为
的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为 ,含少量杂质
,含少量杂质 等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是

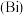 与氮同主族,在中性及碱性环境下常以
与氮同主族,在中性及碱性环境下常以 的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为
的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为 ,含少量杂质
,含少量杂质 等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
A.“浸出”产生S的主要离子反应为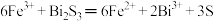 |
| B.“浸出”时盐酸可以还原杂质PbO2 |
| C.“浸出、置换、再生、电解精炼”工序中不全是氧化还原反应 |
| D.再生液可以加入“浸出”操作中循环利用 |
您最近一年使用:0次
2020-12-15更新
|
677次组卷
|
4卷引用:湖南省岳阳市2021届高三二模考试化学试题
湖南省岳阳市2021届高三二模考试化学试题广东省2021届高三“六校联盟”第二次联考化学试卷(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)江苏省(天一中学.海门中学.姜堰中学.淮阴中学)四校2021届高三4月联考化学试题



