某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 )。实现钴、镍、镁元素的回收。
)。实现钴、镍、镁元素的回收。
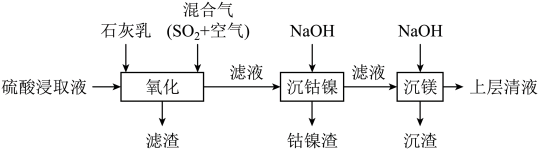
已知:
回答下列问题:
(1)基态Co原子的价层电子轨道表示式为___________ 。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(已知 的电离方程式为:
的电离方程式为: 、
、 )。“氧化”中先用石灰乳调节
)。“氧化”中先用石灰乳调节 ,再加入“混合气”,
,再加入“混合气”, 被
被 氧化为
氧化为 ,该氧化还原反应过程的离子方程式为:
,该氧化还原反应过程的离子方程式为:___________ ;得到滤渣的主要成分为 、
、___________ (填化学式)。
(3)“沉钴镍”中得到的 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为:
,该反应的化学方程式为:___________ 。
(4)“沉镁”中为使 沉淀完全(25℃),需控制pH不低于
沉淀完全(25℃),需控制pH不低于___________ (精确至0.1)。
(5)钴镍渣是湿法炼锌净化渣之一,其中含有少量Co(Ⅱ)、Cd(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:

下列说法正确的是:___________(填标号)。
(6)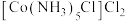 可用作聚氯乙烯的染色剂和稳定剂。氨气中
可用作聚氯乙烯的染色剂和稳定剂。氨气中 的键角比该配合物中
的键角比该配合物中 的键角小,其原因是
的键角小,其原因是___________ 。
 、
、 、
、 、
、 、
、 和
和 )。实现钴、镍、镁元素的回收。
)。实现钴、镍、镁元素的回收。
已知:
| 物质 |  |  |  |  |
 |  | 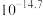 | 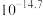 | 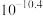 |
(1)基态Co原子的价层电子轨道表示式为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(已知
 的电离方程式为:
的电离方程式为: 、
、 )。“氧化”中先用石灰乳调节
)。“氧化”中先用石灰乳调节 ,再加入“混合气”,
,再加入“混合气”, 被
被 氧化为
氧化为 ,该氧化还原反应过程的离子方程式为:
,该氧化还原反应过程的离子方程式为: 、
、(3)“沉钴镍”中得到的
 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为:
,该反应的化学方程式为:(4)“沉镁”中为使
 沉淀完全(25℃),需控制pH不低于
沉淀完全(25℃),需控制pH不低于(5)钴镍渣是湿法炼锌净化渣之一,其中含有少量Co(Ⅱ)、Cd(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:

下列说法正确的是:___________(填标号)。
| A.粉碎矿渣、升高温度均可以提高“溶浸”率 |
B.通过高温焙烧可以将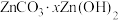 制得氧化锌 制得氧化锌 |
C.根据 中S的化合价分析, 中S的化合价分析, 具有强还原性 具有强还原性 |
D. 可与浓盐酸反应生成 可与浓盐酸反应生成 , , 参与反应可生成 参与反应可生成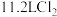 |
(6)
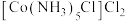 可用作聚氯乙烯的染色剂和稳定剂。氨气中
可用作聚氯乙烯的染色剂和稳定剂。氨气中 的键角比该配合物中
的键角比该配合物中 的键角小,其原因是
的键角小,其原因是
2024·湖南岳阳·一模 查看更多[2]
更新时间:2024-03-09 08:46:09
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
【推荐1】铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下:

已知:①Na2Cr2O7是一种强氧化剂
②常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式:___________________ ;
(2)酸化滤液D时,不选用盐酸的原因是___________ ;
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为___________ ;

(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为___________ ;
②下列溶液中可以代替上述流程中Na2S2O3溶液的是__________ (填选项序号)A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为________________________ ;
(5)根据有关国家标准,含 的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放。用以下方法处理废水:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。则加入可溶性钡盐后的废水中Ba2+的浓度应不小于
的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放。用以下方法处理废水:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。则加入可溶性钡盐后的废水中Ba2+的浓度应不小于___________ mol·L-1,废水处理后方能达到国家排放标准。

已知:①Na2Cr2O7是一种强氧化剂
②常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO

(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式:
(2)酸化滤液D时,不选用盐酸的原因是
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为

(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O
 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:
①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为
②下列溶液中可以代替上述流程中Na2S2O3溶液的是
③上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为
(5)根据有关国家标准,含
 的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放。用以下方法处理废水:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。则加入可溶性钡盐后的废水中Ba2+的浓度应不小于
的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放。用以下方法处理废水:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。则加入可溶性钡盐后的废水中Ba2+的浓度应不小于
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】废旧锌锰电池通过拆分煅烧后,可得棕色锰粉(主要成分为MnO、Mn2O3、Mn3O4、MnO2、ZnO和ZnMn2O4),从棕色锰粉中获得γ-MnO2和超细ZnO粉体的工艺流程如下图所示,结合流程回答以下问题:
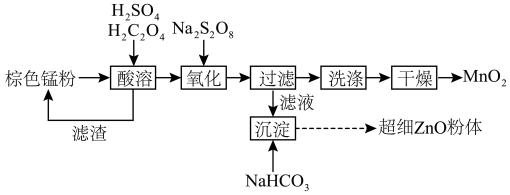
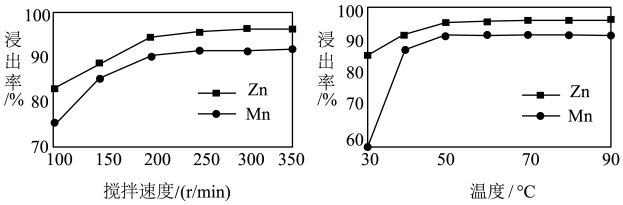
(1)某课题组研究酸溶过程中相关条件对锌、锰浸出率的影响,以获得酸溶反应的最佳条件。由下图可知,酸溶反应的最佳条件为:搅拌速度_______ r·min-1,温度_______ ℃。
(2)在上述确定的最佳条件下进行酸溶反应。酸溶的目的是将锌、锰元素转化为Zn2+、Mn2+,则酸溶过程,H2C2O4的主要作用是作_______ ,判断酸溶反应结束的现象是_______ ,酸溶过程不用H2O2代替H2C2O4的理由是:_______ 。
(3)Na2S2O8被还原为 ,请写出“氧化”步骤的离子方程式:
,请写出“氧化”步骤的离子方程式:_______ 。
(4)洗涤步骤中,判断洗涤干净的操作是_______ 。
(5)可用0.2500mol/L的EDTA测定ZnO纯度(已知EDTA与Zn2+按物质的量1:1反应,杂质不参与反应),取1.800g制得的超细ZnO溶于适量硫酸,将溶液稀释至100mL,取25.00mL用EDTA滴定,消耗20.00mLEDTA,则制得的ZnO纯度为_______ 。

(1)某课题组研究酸溶过程中相关条件对锌、锰浸出率的影响,以获得酸溶反应的最佳条件。由下图可知,酸溶反应的最佳条件为:搅拌速度

(2)在上述确定的最佳条件下进行酸溶反应。酸溶的目的是将锌、锰元素转化为Zn2+、Mn2+,则酸溶过程,H2C2O4的主要作用是作
(3)Na2S2O8被还原为
 ,请写出“氧化”步骤的离子方程式:
,请写出“氧化”步骤的离子方程式:(4)洗涤步骤中,判断洗涤干净的操作是
(5)可用0.2500mol/L的EDTA测定ZnO纯度(已知EDTA与Zn2+按物质的量1:1反应,杂质不参与反应),取1.800g制得的超细ZnO溶于适量硫酸,将溶液稀释至100mL,取25.00mL用EDTA滴定,消耗20.00mLEDTA,则制得的ZnO纯度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】垃圾分类正在全国逐渐推广,垃圾资源化是可持续、绿色发展的重要途径。由金属废料(主要含铁、铜和它们的氧化物)制得碱式碳酸铜和摩尔盐[(NH4)2SO4·FeSO4·xH2O]的工艺流程如下图所示:
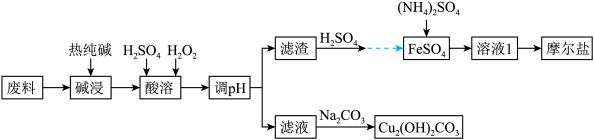
已知:Ksp[Fe(OH)3]=1×10-38 ,Ksp[Cu(OH)2]= 2.2×10-21,一般认为某离子浓度小于或等于10-5mol/L时,该离子转化或去除完全。
请回答下列问题:
(1)热纯碱的作用是_______________ ,H2O2的电子式为___________ 。
(2)调pH步骤可选用的试剂为______________ 。
A.CuO B.Cu(OH)2 C.Fe2O3 D.Fe(OH)3
(3)若所得溶液中c(Cu2+)=0.22 mol·L-1,则需要调节的pH范围是_______________ 。
(4)溶液1经过加热、蒸发至溶液中出现晶体时,自然冷却即可得到晶体,然后抽滤,用酒精洗涤晶体,酒精洗涤的目的是____________________________________ 。
(5)写出该流程中生成碱式碳酸铜的离子方程式________________________________ 。
(6)取3.92g摩尔盐产品,在隔绝空气的条件下加热至135°C时完全失去结晶水,此时固体质量为2.84g,则该摩尔盐结晶水个数x=________ 。

已知:Ksp[Fe(OH)3]=1×10-38 ,Ksp[Cu(OH)2]= 2.2×10-21,一般认为某离子浓度小于或等于10-5mol/L时,该离子转化或去除完全。
请回答下列问题:
(1)热纯碱的作用是
(2)调pH步骤可选用的试剂为
A.CuO B.Cu(OH)2 C.Fe2O3 D.Fe(OH)3
(3)若所得溶液中c(Cu2+)=0.22 mol·L-1,则需要调节的pH范围是
(4)溶液1经过加热、蒸发至溶液中出现晶体时,自然冷却即可得到晶体,然后抽滤,用酒精洗涤晶体,酒精洗涤的目的是
(5)写出该流程中生成碱式碳酸铜的离子方程式
(6)取3.92g摩尔盐产品,在隔绝空气的条件下加热至135°C时完全失去结晶水,此时固体质量为2.84g,则该摩尔盐结晶水个数x=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】以菱镁矿(主要成分是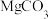 ,含少量
,含少量 、
、 、
、 和
和 等)为原料制备镁和铁红,流程如下,回答下列问题:
等)为原料制备镁和铁红,流程如下,回答下列问题:
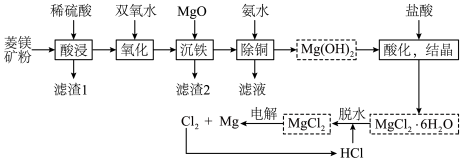
(1)写出“氧化”的离子方程式___________ ;以石墨为电极,“电解”中阳极的电极反应式为___________ 。
(2)“脱水”中 的作用是
的作用是___________ 。
(3)已知: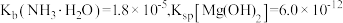 。“除铜”中,
。“除铜”中,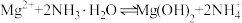 的平衡常数
的平衡常数
___________ 。
(4)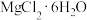 的热重曲线如图所示。
的热重曲线如图所示。
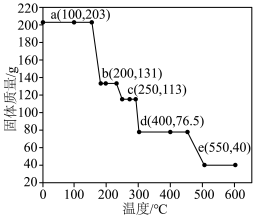
①200℃时固体产物的化学式为___________ 。
②写出400℃时生成固体产物(一种碱式盐)的化学方程式___________ 。
(5)镁铁晶胞如图所示。已知:晶胞参数为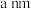 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
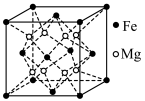
2个最近的Fe原子之间距离为________ nm,该晶体密度为_______ g/cm3(以上两空均用含字母的式子表示)。
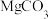 ,含少量
,含少量 、
、 、
、 和
和 等)为原料制备镁和铁红,流程如下,回答下列问题:
等)为原料制备镁和铁红,流程如下,回答下列问题:
(1)写出“氧化”的离子方程式
(2)“脱水”中
 的作用是
的作用是(3)已知:
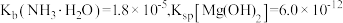 。“除铜”中,
。“除铜”中,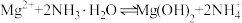 的平衡常数
的平衡常数
(4)
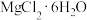 的热重曲线如图所示。
的热重曲线如图所示。
①200℃时固体产物的化学式为
②写出400℃时生成固体产物(一种碱式盐)的化学方程式
(5)镁铁晶胞如图所示。已知:晶胞参数为
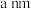 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
2个最近的Fe原子之间距离为
您最近一年使用:0次
【推荐2】I.已知:乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10−2,K2=5.4×10−5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10−7,K2=4.7×10−11.草酸钙的Ksp=4.0×10−8,碳酸钙的Ksp=2.5×10−9.回答下列问题:
(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH___________ (填“大”、“小”或“相等”)
(2)常温下将20mL 0.4mol/L的KOH溶液与20mL 0.2mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为___________ 。
(3)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×10−4mol/L的草酸钾溶液20mL,能否产生沉淀___________ (填“能”或“不能”)。
Ⅱ. 目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:
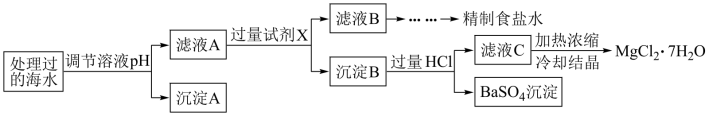
注:离子的浓度小于1.0×10−5mol·L−1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10−38,Ksp[Mg(OH)2]=5.0×10−12;操作过程中溶液体积的变化忽略不计。
(4)根据表中列出的离子浓度计算a=___________ ;沉淀A是___________ (填化学式)。
(5)在调节溶液pH时,理论上应调节的pH范围是___________ ;加入的过量试剂X为___________ (填化学式)。
(6)加入过量HCl的作用为___________ 。
(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH
(2)常温下将20mL 0.4mol/L的KOH溶液与20mL 0.2mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为
(3)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×10−4mol/L的草酸钾溶液20mL,能否产生沉淀
Ⅱ. 目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
| 离子 | SO | Mg2+ | Fe3+ | Na+ | Cl− |
| 浓度/(mol·L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |

注:离子的浓度小于1.0×10−5mol·L−1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10−38,Ksp[Mg(OH)2]=5.0×10−12;操作过程中溶液体积的变化忽略不计。
(4)根据表中列出的离子浓度计算a=
(5)在调节溶液pH时,理论上应调节的pH范围是
(6)加入过量HCl的作用为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
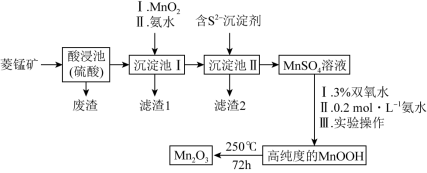
【推荐3】Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图:
已知:氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
(1)MnOOH中Mn的化合价为_______ 价。
(2)向“沉淀池I”中加入MnO2,MnO2的作用是_______ ,在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为_______ (当溶液中某离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(3)MnSO4转化为MnOOH的离子方程式为_______ 。
(4)MnSO4转化为MnOOH中“III实验操作”包含过滤、洗涤、干燥,检验MnOOH是否洗涤干净,具体操作为_______ 。
(5)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示。_______ 。
②已知:MnS晶体的边长为bnm,NA为阿伏加德罗常数的值,则MnS晶胞密度为_______ g•cm-3(列出计算式即可)。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
(1)MnOOH中Mn的化合价为
(2)向“沉淀池I”中加入MnO2,MnO2的作用是
(3)MnSO4转化为MnOOH的离子方程式为
(4)MnSO4转化为MnOOH中“III实验操作”包含过滤、洗涤、干燥,检验MnOOH是否洗涤干净,具体操作为
(5)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示。
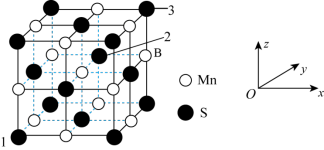
②已知:MnS晶体的边长为bnm,NA为阿伏加德罗常数的值,则MnS晶胞密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有两种同分异构体。科学研究表明,两种分子都具有抗癌活性。
(1)吡啶分子是大体积平面配体,其结构简式如图所示 ,氮原子的杂化轨道方式是
,氮原子的杂化轨道方式是_____ 。吡啶分子中,各元素的电负性由大到小的顺序为_____ 。吡啶分子中含有_____ 个σ 键。
(2)二氯二吡啶合铂分子中存在的微粒间作用力有_____ (填序号)。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
(3)二氯二吡啶合铂分子中,Pt2+的配位数是 4,但是其轨道杂化方式并不是 sp3。简述理由:_____________ 。
(4)其中一种二氯二吡啶合铂分子结构如图所示,该分子是_____ 分子(选填“极性”、“非极性”)。

(5)CO(NH2)2易溶于水的最主要原因是_________________________ 。
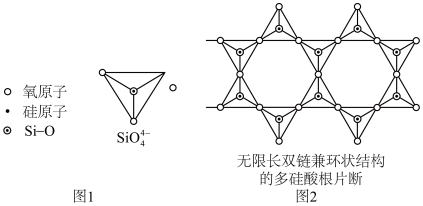
(6)Si 元素以 Si-O-Si 链构成矿物界,由许多四面体(图 l)连接成无限长的单链或双链(图 2)结构。图 2 所示的多硅酸根离子的化学式通式为_____ (以含正整数n 的代数式表示)。
(1)吡啶分子是大体积平面配体,其结构简式如图所示
 ,氮原子的杂化轨道方式是
,氮原子的杂化轨道方式是(2)二氯二吡啶合铂分子中存在的微粒间作用力有
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
(3)二氯二吡啶合铂分子中,Pt2+的配位数是 4,但是其轨道杂化方式并不是 sp3。简述理由:
(4)其中一种二氯二吡啶合铂分子结构如图所示,该分子是

(5)CO(NH2)2易溶于水的最主要原因是
(6)Si 元素以 Si-O-Si 链构成矿物界,由许多四面体(图 l)连接成无限长的单链或双链(图 2)结构。图 2 所示的多硅酸根离子的化学式通式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】[化学——选修3:物质结构与性质]
黄铜专指铜锌合金,始于明代《明会典》,古代黄铜主要用于铸币和铸造雕塑。回答下列问题:
(1)Zn元素在周期表中的位置为_____________ ,基态Zn2+外围电子排布式为_____________ 。
(2)硝酸铜溶液可与乙二胺( )形成配位化合物[Cu(en)2](NO3)2(“en”表示乙二胺)。
)形成配位化合物[Cu(en)2](NO3)2(“en”表示乙二胺)。
①NO3-的空间构型为_____________ 。
②Cu2+与乙二胺分子之间存在的化学键类型为______________ ,在乙二胺分子中提供孤电子对的原子是_____________ 。
③在乙二胺分子中C的杂化轨道类型是_____________ 。
④乙二胺的沸点116℃,而相对分子质量比乙二胺大1的三甲胺( )的沸点只有2.87℃,其原因是
)的沸点只有2.87℃,其原因是____________________ 。
(3)铜的晶胞实物堆积模型如图所示,设铜的密度为ρg·cm-3。
①铜的晶体堆积方式为_____________ 。
②铜晶胞参数a=_____________ cm(列出式子即可,设铜的摩尔质量为Mg·mol-1,阿伏伽德罗常数值为NA)。
黄铜专指铜锌合金,始于明代《明会典》,古代黄铜主要用于铸币和铸造雕塑。回答下列问题:
(1)Zn元素在周期表中的位置为
(2)硝酸铜溶液可与乙二胺(
 )形成配位化合物[Cu(en)2](NO3)2(“en”表示乙二胺)。
)形成配位化合物[Cu(en)2](NO3)2(“en”表示乙二胺)。①NO3-的空间构型为
②Cu2+与乙二胺分子之间存在的化学键类型为
③在乙二胺分子中C的杂化轨道类型是
④乙二胺的沸点116℃,而相对分子质量比乙二胺大1的三甲胺(
 )的沸点只有2.87℃,其原因是
)的沸点只有2.87℃,其原因是(3)铜的晶胞实物堆积模型如图所示,设铜的密度为ρg·cm-3。

①铜的晶体堆积方式为
②铜晶胞参数a=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】Fe、Co、Ni 均为第VIII族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Fe原子的核外电子排布式为________ ; 在[Fe(OCN)6]4-中, C、N、O三种元素的第一电离能由大到小的顺序为_______ 。
(2)Co3+的一种配离子[Co(N3)NH3)5]2+中,配位体NH3中心原子杂化类型为_______ ;空间构型为_______ ;NH3的沸点高于CH4,这是因为_____ 。
(3) 1 mol [Ni(CN)4]2-中含有σ键的数目为_______ ,与CN-互为等电子体的一种分子为_______ (填化学式)。
(4)Ni的晶胞结构如图所示,镍晶体中每个镍原子周围距离最近的镍原子数为______ 。

(1)基态Fe原子的核外电子排布式为
(2)Co3+的一种配离子[Co(N3)NH3)5]2+中,配位体NH3中心原子杂化类型为
(3) 1 mol [Ni(CN)4]2-中含有σ键的数目为
(4)Ni的晶胞结构如图所示,镍晶体中每个镍原子周围距离最近的镍原子数为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】铁、钴、镍性质非常相似,被称为铁系元素。铁系元素在生产生活中有重要用途。
I. 氯化钴可用于化学反应催化剂,油漆催干剂等。用金属钴板(含少量Fe、Ni)制备氯化钴流程如下:
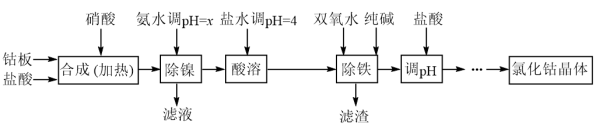
已知:①钴与盐酸反应极慢,需加入催化剂硝酸才能进行实际生产。
②有关钴、镍和铁化合物的性质见下表:
(1)实验室测溶液pH要用到的玻璃仪器有__________ 。
(2)“除镍”步骤中,NH3•H2O用量对残留Ni2+含量的影响见表:从表中可知x=_________ 时,除镍效果最好。
(3)“除铁”步骤中加入纯碱的作用是(利用水解平衡原理并结合必要的文字作答)__________________________ 。
(4)加盐酸调pH的目的是______________________ 。
II. 当代技术利用铁的氧化物循环裂解水制氢气的过程如下图所示。
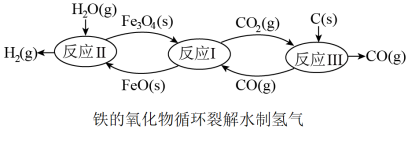
(5)已知:在20MPa、800℃下
Fe3O4(s) + CO(g)=3FeO(s) + CO2(g) ΔH1= +19.3 kJ·mol-1
3FeO(s) + H2O(g)=Fe3O4(s) + H2(g) ΔH2= -57.2 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH3= +172.4 kJ·mol-1
则该条件下,铁氧化物循环裂解水制氢气总反应的热化学方程式是__________ 。
III. 我国镍氢电池居世界先进水平。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为:LaNi5H6+6NiO(OH) LaNi5+6Ni(OH)2。
LaNi5+6Ni(OH)2。
(6)则该电池放电时负极反应式为:____________________ 。
(7)用镍氢电池做电源,在铁件的表面镀铜防止铁被腐蚀。装置示意图如下。

若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为4.48 g,则电镀时电路中通过的电子的物质的量为_______ 。
I. 氯化钴可用于化学反应催化剂,油漆催干剂等。用金属钴板(含少量Fe、Ni)制备氯化钴流程如下:

已知:①钴与盐酸反应极慢,需加入催化剂硝酸才能进行实际生产。
②有关钴、镍和铁化合物的性质见下表:
| 化学式 | 沉淀完全时的pH | 钴镍性质 |
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑  +2NH3•H2O= +2NH3•H2O=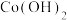 ↓+2 ↓+2 Ni+ 2HCl=NiCl2+H2↑ Co2++2H2O⇌ 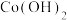 +2H+ +2H+Ni2++ 6NH3•H2O=[Ni  ]2++6H2O ]2++6H2O |
| Fe(OH)2 | 9.6 | |
| Fe(OH)3 | 3.7 |
(1)实验室测溶液pH要用到的玻璃仪器有
(2)“除镍”步骤中,NH3•H2O用量对残留Ni2+含量的影响见表:从表中可知x=
| 加氨水调pH | Ni2+含量 |
| 9 | 0.08% |
| 9.5 | 0.05% |
| 10 | 0.005% |
| 10.3 | 0.005% |
(3)“除铁”步骤中加入纯碱的作用是(利用水解平衡原理并结合必要的文字作答)
(4)加盐酸调pH的目的是
II. 当代技术利用铁的氧化物循环裂解水制氢气的过程如下图所示。

(5)已知:在20MPa、800℃下
Fe3O4(s) + CO(g)=3FeO(s) + CO2(g) ΔH1= +19.3 kJ·mol-1
3FeO(s) + H2O(g)=Fe3O4(s) + H2(g) ΔH2= -57.2 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH3= +172.4 kJ·mol-1
则该条件下,铁氧化物循环裂解水制氢气总反应的热化学方程式是
III. 我国镍氢电池居世界先进水平。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为:LaNi5H6+6NiO(OH)
 LaNi5+6Ni(OH)2。
LaNi5+6Ni(OH)2。 (6)则该电池放电时负极反应式为:
(7)用镍氢电池做电源,在铁件的表面镀铜防止铁被腐蚀。装置示意图如下。

若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为4.48 g,则电镀时电路中通过的电子的物质的量为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】垃圾分类正在全国逐渐推广,垃圾资源化是可持续、绿色发展的重要途径。由金属废料(主要含铁、铜和它们的氧化物)制得碱式碳酸铜和摩尔盐[(NH4)2SO4·FeSO4·xH2O]的工艺流程如下图所示:

已知:Ksp[Fe(OH)3]=1×10-38 ,Ksp[Cu(OH)2]= 2.2×10-21,一般认为某离子浓度小于或等于10-5mol/L时,该离子转化或去除完全。
请回答下列问题:
(1)热纯碱的作用是_______________ ,H2O2的电子式为___________ 。
(2)调pH步骤可选用的试剂为______________ 。
A.CuO B.Cu(OH)2 C.Fe2O3 D.Fe(OH)3
(3)若所得溶液中c(Cu2+)=0.22 mol·L-1,则需要调节的pH范围是_______________ 。
(4)溶液1经过加热、蒸发至溶液中出现晶体时,自然冷却即可得到晶体,然后抽滤,用酒精洗涤晶体,酒精洗涤的目的是____________________________________ 。
(5)写出该流程中生成碱式碳酸铜的离子方程式________________________________ 。
(6)取3.92g摩尔盐产品,在隔绝空气的条件下加热至135°C时完全失去结晶水,此时固体质量为2.84g,则该摩尔盐结晶水个数x=________ 。

已知:Ksp[Fe(OH)3]=1×10-38 ,Ksp[Cu(OH)2]= 2.2×10-21,一般认为某离子浓度小于或等于10-5mol/L时,该离子转化或去除完全。
请回答下列问题:
(1)热纯碱的作用是
(2)调pH步骤可选用的试剂为
A.CuO B.Cu(OH)2 C.Fe2O3 D.Fe(OH)3
(3)若所得溶液中c(Cu2+)=0.22 mol·L-1,则需要调节的pH范围是
(4)溶液1经过加热、蒸发至溶液中出现晶体时,自然冷却即可得到晶体,然后抽滤,用酒精洗涤晶体,酒精洗涤的目的是
(5)写出该流程中生成碱式碳酸铜的离子方程式
(6)取3.92g摩尔盐产品,在隔绝空气的条件下加热至135°C时完全失去结晶水,此时固体质量为2.84g,则该摩尔盐结晶水个数x=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】高纯硝酸锶 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:

已知: 滤渣1的成分为
滤渣1的成分为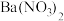 、
、 ;
; 铬酸
铬酸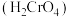 为弱酸。
为弱酸。
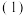 酸浸不能采用高温的原因是
酸浸不能采用高温的原因是____________ ,滤液1的主要溶质是________ 。
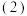 相对于水洗,用浓硝酸洗涤的优点是
相对于水洗,用浓硝酸洗涤的优点是___________ 。
 滤液2中过量的
滤液2中过量的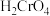 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式:
,同时放出无污染的气体,写出发生反应的离子方程式:________ 。
 已知
已知 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是 结合离子方程式说明理由
结合离子方程式说明理由
__________ 。
 为了测定滤渣2中
为了测定滤渣2中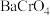 的含量,进行以下实验:
的含量,进行以下实验:
mg滤渣2 溶液
溶液
滴定终点时消耗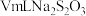 溶液
溶液 已知:
已知: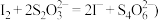 。
。
 滤渣2中
滤渣2中 摩尔质量为
摩尔质量为 的质量分数为
的质量分数为___________  用代数式表示
用代数式表示 。
。
 若加入的HI溶液过量太多,测定结果会
若加入的HI溶液过量太多,测定结果会_________  “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响” 。
。
 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
已知:
 滤渣1的成分为
滤渣1的成分为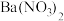 、
、 ;
; 铬酸
铬酸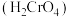 为弱酸。
为弱酸。 酸浸不能采用高温的原因是
酸浸不能采用高温的原因是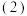 相对于水洗,用浓硝酸洗涤的优点是
相对于水洗,用浓硝酸洗涤的优点是 滤液2中过量的
滤液2中过量的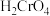 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式:
,同时放出无污染的气体,写出发生反应的离子方程式: 已知
已知 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是 结合离子方程式说明理由
结合离子方程式说明理由
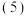 为了测定滤渣2中
为了测定滤渣2中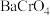 的含量,进行以下实验:
的含量,进行以下实验:mg滤渣2
 溶液
溶液
滴定终点时消耗
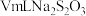 溶液
溶液 已知:
已知: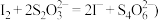 。
。 滤渣2中
滤渣2中 摩尔质量为
摩尔质量为 的质量分数为
的质量分数为 用代数式表示
用代数式表示 。
。 若加入的HI溶液过量太多,测定结果会
若加入的HI溶液过量太多,测定结果会 “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响” 。
。
您最近一年使用:0次



