1 . 全球能源结构正在向多元、清洁、低碳转型。太阳能的利用是热门研究方向之一,例如,可以利用太阳能将水转化为 ,某种光分解水的过程如图所示,下列说法不正确的是
,某种光分解水的过程如图所示,下列说法不正确的是
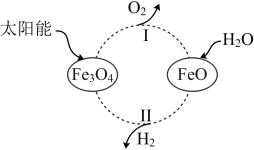
 ,某种光分解水的过程如图所示,下列说法不正确的是
,某种光分解水的过程如图所示,下列说法不正确的是
A.该转化发生的总反应为 |
B.该转化过程中循环利用的物质有 |
C.过程Ⅰ中每产生 ,同时产生 ,同时产生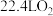 |
D.过程Ⅱ中生成 和 和 的物质的量之比为 的物质的量之比为 |
您最近一年使用:0次
2 . 根据所学知识,进行作答
(1)2023年第19届杭州亚运会场馆实现 覆盖,制作
覆盖,制作 芯片的材料为
芯片的材料为 (氮化镓),镓原子结构示意图为
(氮化镓),镓原子结构示意图为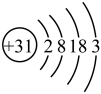 ,镓元素在元素周期表中的位置
,镓元素在元素周期表中的位置___________ 。
(2)2023年10月26日神舟十七号飞船成功对接太空站,为使宇航员有良好的生存环境,飞船中装有盛 颗粒的供氧装置。
颗粒的供氧装置。
① 中的氧元素的化合价为
中的氧元素的化合价为___________ 价。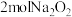 与水完全反应时,生成的氧气在标准状况下体积为
与水完全反应时,生成的氧气在标准状况下体积为___________ L。
②如用 (超氧化钾)代替
(超氧化钾)代替 ,也能达到同样的目的。写出
,也能达到同样的目的。写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
(3)2023年12月18日甘肃省发生地震灾害,受灾废墟需喷洒大量84消毒液的稀溶液进行消毒。84消毒液可由 与
与 溶液反应制得,其主要成分为
溶液反应制得,其主要成分为 。
。
①资料(3)涉及的物质中,属于碱的是___________ (填化学式,下同);属于盐的是___________ 。
②“84消毒液”与稀盐酸混合使用可增强其漂白效果,原因是___________ (用离子方程式表示),但“84消毒液”却不能与“洁厕灵”(浓盐酸)混合使用,原因是___________ (用离子方程式表示)。
(1)2023年第19届杭州亚运会场馆实现
 覆盖,制作
覆盖,制作 芯片的材料为
芯片的材料为 (氮化镓),镓原子结构示意图为
(氮化镓),镓原子结构示意图为 ,镓元素在元素周期表中的位置
,镓元素在元素周期表中的位置(2)2023年10月26日神舟十七号飞船成功对接太空站,为使宇航员有良好的生存环境,飞船中装有盛
 颗粒的供氧装置。
颗粒的供氧装置。①
 中的氧元素的化合价为
中的氧元素的化合价为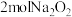 与水完全反应时,生成的氧气在标准状况下体积为
与水完全反应时,生成的氧气在标准状况下体积为②如用
 (超氧化钾)代替
(超氧化钾)代替 ,也能达到同样的目的。写出
,也能达到同样的目的。写出 与
与 反应的化学方程式
反应的化学方程式(3)2023年12月18日甘肃省发生地震灾害,受灾废墟需喷洒大量84消毒液的稀溶液进行消毒。84消毒液可由
 与
与 溶液反应制得,其主要成分为
溶液反应制得,其主要成分为 。
。①资料(3)涉及的物质中,属于碱的是
②“84消毒液”与稀盐酸混合使用可增强其漂白效果,原因是
您最近一年使用:0次
3 . 钒(V)广泛应用于冶金、化工、航天等领域。一种以钒渣(主要成分是 、
、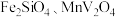 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示:
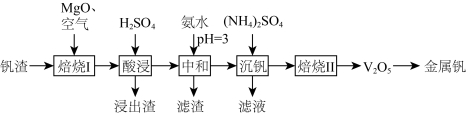
已知:① 具有强氧化性,主要存在于
具有强氧化性,主要存在于 的溶液中,
的溶液中,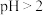 时转化成酸式多钒酸盐。
时转化成酸式多钒酸盐。
②溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1) 中
中 为
为 价,
价, 的化合价为
的化合价为_______ ;基态 原子价层电子排布图为
原子价层电子排布图为_______ 。
(2)“焙烧Ⅰ”中将 和空气分别加入炉中,焙烧将
和空气分别加入炉中,焙烧将 转化为
转化为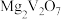 和
和 的化学方程式为
的化学方程式为_______ 。
(3)“酸浸”所得浸出液中除含有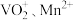 外,还含有的金属阳离子有
外,还含有的金属阳离子有_______ 。
(4)“沉钒”可得到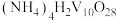 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为_______ 。
(5)“沉钒”所得滤液中加入氨水调节溶液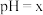 ,过滤得到
,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制
,应控制
_______ 。
 、
、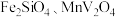 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示:
已知:①
 具有强氧化性,主要存在于
具有强氧化性,主要存在于 的溶液中,
的溶液中,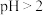 时转化成酸式多钒酸盐。
时转化成酸式多钒酸盐。②溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 1.9 | 7.0 | 8.1 | 8.9 |
沉淀完全时 的 的 | 3.2 | 9.0 | 10.1 | 10.9 |
(1)
 中
中 为
为 价,
价, 的化合价为
的化合价为 原子价层电子排布图为
原子价层电子排布图为(2)“焙烧Ⅰ”中将
 和空气分别加入炉中,焙烧将
和空气分别加入炉中,焙烧将 转化为
转化为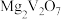 和
和 的化学方程式为
的化学方程式为(3)“酸浸”所得浸出液中除含有
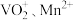 外,还含有的金属阳离子有
外,还含有的金属阳离子有(4)“沉钒”可得到
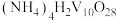 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为(5)“沉钒”所得滤液中加入氨水调节溶液
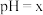 ,过滤得到
,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制
,应控制
您最近一年使用:0次
4 . 硫化钠可广泛用于染料、医药行业。工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列问题:
(1)工业上常用芒硝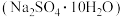 和煤粉在高温下生产硫化钠,同时生成
和煤粉在高温下生产硫化钠,同时生成 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(2)溶解回流装置如图所示,装置中球形冷凝管应从_______ (填“a”或“b”)口进水;

(3)回流前无需加入沸石,其原因是_______ 。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3.若气雾上升过高,可采取的措施是_______ 。
(4)回流结束后,需进行的操作有①停止加热②关闭冷凝水③移去水浴,正确的顺序为_______(填标号)。
(5)该实验趁热过滤除去的杂质为_______ 。若滤纸上析出大量晶体,则可能的原因是_______ 。
(6)滤液冷却、结晶、过滤,晶体用少量_______ 洗涤,干燥,得到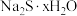 。
。
(1)工业上常用芒硝
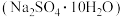 和煤粉在高温下生产硫化钠,同时生成
和煤粉在高温下生产硫化钠,同时生成 ,该反应的化学方程式为
,该反应的化学方程式为(2)溶解回流装置如图所示,装置中球形冷凝管应从

(3)回流前无需加入沸石,其原因是
(4)回流结束后,需进行的操作有①停止加热②关闭冷凝水③移去水浴,正确的顺序为_______(填标号)。
| A.①②③ | B.③①② | C.②①③ | D.①③② |
(6)滤液冷却、结晶、过滤,晶体用少量
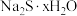 。
。
您最近一年使用:0次
解题方法
5 . 氮化镓(GaN)具有优异的光电性能。一种利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)2、铁酸锌ZnFe2O4、SiO2]制备GaN的工艺流程如下:
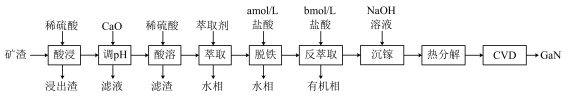
已知:
①Ga与Al同主族,化学性质相似。
②常温下, ,
, ,
, 。
。
③ 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
回答下列问题:
(1)“酸浸”时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。“酸溶”所得滤渣的主要成分是___________ (填化学式)。
(2)“酸浸”所得浸出液中 、
、 浓度分别为0.003mol/L和1mol/L。常温下,为尽可能多地提取
浓度分别为0.003mol/L和1mol/L。常温下,为尽可能多地提取 并确保不混入
并确保不混入 ,“调pH”时需用CaO调pH略小于
,“调pH”时需用CaO调pH略小于___________ (假设调pH时溶液体积不变)。
(3)“反萃取”时,所用盐酸的浓度
___________ (选填上表中盐酸的浓度)。
(4)“沉镓”时,若加入NaOH的量过多,会导致 的沉淀率降低,原因是
的沉淀率降低,原因是___________ (用离子方程式表示)。
(5)利用CVD(化学气相沉积)技术,将热分解得到的 与
与 在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为
在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为___________ 。
(6)①GaN的熔点为1700℃, 的熔点为77.9℃,则
的熔点为77.9℃,则 晶体类型为
晶体类型为___________ 。
②GaN晶体的一种立方晶胞如图所示。该晶体密度为 ,GaN的式量为Mr,则晶胞边长为
,GaN的式量为Mr,则晶胞边长为___________ nm。(列出计算式, 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)


已知:
①Ga与Al同主族,化学性质相似。
②常温下,
 ,
, ,
, 。
。③
 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。盐酸浓度/ | 反萃取率/% | |
 |  | |
| 2 | 86.9 | 9.4 |
| 4 | 69.1 | 52.1 |
| 6 | 17.5 | 71.3 |
(1)“酸浸”时
 发生反应的离子方程式为
发生反应的离子方程式为(2)“酸浸”所得浸出液中
 、
、 浓度分别为0.003mol/L和1mol/L。常温下,为尽可能多地提取
浓度分别为0.003mol/L和1mol/L。常温下,为尽可能多地提取 并确保不混入
并确保不混入 ,“调pH”时需用CaO调pH略小于
,“调pH”时需用CaO调pH略小于(3)“反萃取”时,所用盐酸的浓度

(4)“沉镓”时,若加入NaOH的量过多,会导致
 的沉淀率降低,原因是
的沉淀率降低,原因是(5)利用CVD(化学气相沉积)技术,将热分解得到的
 与
与 在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为
在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为(6)①GaN的熔点为1700℃,
 的熔点为77.9℃,则
的熔点为77.9℃,则 晶体类型为
晶体类型为②GaN晶体的一种立方晶胞如图所示。该晶体密度为
 ,GaN的式量为Mr,则晶胞边长为
,GaN的式量为Mr,则晶胞边长为 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
名校
解题方法
6 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
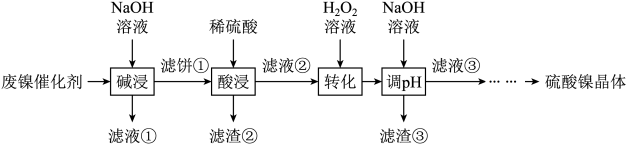
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)Ni在元素周期表中的位置___________ 。
(2)“碱浸”中NaOH的两个作用,一个是溶解铝及其氧化物,另一个是___________ 。为回收金属,用稀硫酸将“滤液①”中的铝元素恰好完全转化为沉淀的pH为___________ 。(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全; :
: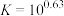 ,
,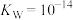 ,
, )
)
(3)“转化”中发生的离子反应为___________ ,可替代 的物质是
的物质是___________ 。
(4)利用上述表格数据,如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是___________ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式___________ 。
(6)由滤液③得到硫酸镍晶体的一系列操作为___________ 。
 ):
):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH沉淀完全时(  )的pH )的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
回答下列问题:
(1)Ni在元素周期表中的位置
(2)“碱浸”中NaOH的两个作用,一个是溶解铝及其氧化物,另一个是
 为沉淀完全;
为沉淀完全; :
: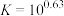 ,
,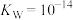 ,
, )
)(3)“转化”中发生的离子反应为
 的物质是
的物质是(4)利用上述表格数据,如果“转化”后的溶液中
 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)由滤液③得到硫酸镍晶体的一系列操作为
您最近一年使用:0次
名校
解题方法
7 . 化学从微观层次认识物质,以符号形式描述物质。下列实验对应的离子方程式书写正确的是
A.向饱和氯化钠溶液中依次通入足量 和 和 : : |
B.向碳酸氢钙溶液中滴加少量石灰水: |
C.磁性氧化铁溶于HI溶液: |
D.用亚硫酸钠溶液吸收少量氯气: |
您最近一年使用:0次
8 . 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为_______ ,其中氧化剂是_______ 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是_______ 反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_______ (填“大于”或“小于”)生成物化学键形成放出的总能量。

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_______ (填序号)。
A. 容器中N2、H2、NH3共存
B. N2、NH3浓度相等
C. N2、H2、NH3的物质的量之比为1:3:2
D. 容器中的压强不随时间变化
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为_______ 。用氯气和烧碱可进一步反应,制得消毒液,反应的离子方程式为_______ 。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)
 2NH3(g)。
2NH3(g)。①合成氨的反应中的能量变化如图所示。该反应是

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是
A. 容器中N2、H2、NH3共存
B. N2、NH3浓度相等
C. N2、H2、NH3的物质的量之比为1:3:2
D. 容器中的压强不随时间变化
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为
您最近一年使用:0次
名校
解题方法
9 . 铁粉在弱酸性条件下去除废水中 的反应原理如下图。
的反应原理如下图。
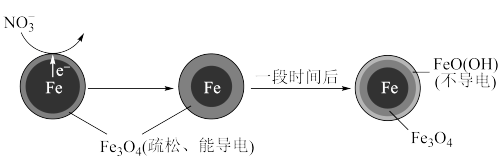
下列说法正确的是
 的反应原理如下图。
的反应原理如下图。
下列说法正确的是
A.上述条件下加入的 能完全反应 能完全反应 |
B.正极的电极反应式: |
C. 的产生与 的产生与 被氧化和溶液pH升高有关 被氧化和溶液pH升高有关 |
D.废水中溶解氧的含量不会影响 的去除率 的去除率 |
您最近一年使用:0次
2022-04-01更新
|
1132次组卷
|
12卷引用:湖南省岳阳市2021-2022学年高二下学期期末教学质量监测化学试题
湖南省岳阳市2021-2022学年高二下学期期末教学质量监测化学试题北京市海淀区2022届高三一模化学试题(已下线)秘籍14 电化学知识的综合应用-备战2022年高考化学抢分秘籍(全国通用)湖北省鄂东南三校2022届高三下学期5月联考化学试题北京市顺义区牛栏山第一中学2021-2022学年高一下学期阶段性检测化学试题(已下线)2022年辽宁省高考真题变式题(1-10)北京市第二十中学2022-2023学年高三上学期12月月考化学试题(已下线)广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(1-10)(已下线)北京市海淀区2022届高三一模(选择题11-14)(已下线)2022年辽宁高考真题化学试题变式题(选择题6-10)(已下线)北京市第四中学2023-2024学年高二上学期期中考试化学试题北京市第五中学2023-2024学年高二下学期开学考试化学试题
名校
10 . 二氧化氯(ClO2)为新型绿色消毒剂,沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。用CH3OH和NaClO3在硫酸催化作用下反应可制得ClO2。利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置如图所示。

| A.为配制分液漏斗中的混合液,应将甲醇溶液倒入浓硫酸中搅拌 |
| B.若装置甲烧瓶内氧化产物为HCOOH,则氧化剂与还原剂的物质的量之比为4:1 |
C.实验中通入 气体的速率应尽可能慢 气体的速率应尽可能慢 |
| D.装置乙中应使用热水浴,以加快反应速率 |
您最近一年使用:0次
2022-03-09更新
|
544次组卷
|
8卷引用:湖南省岳阳市岳阳县2022-2023学年高三下学期6月期末化学试题



