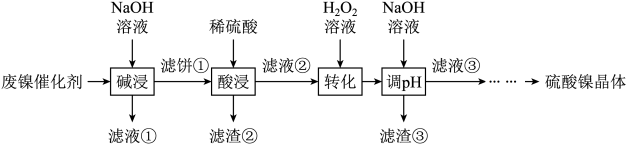
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)Ni在元素周期表中的位置___________ 。
(2)“碱浸”中NaOH的两个作用,一个是溶解铝及其氧化物,另一个是___________ 。为回收金属,用稀硫酸将“滤液①”中的铝元素恰好完全转化为沉淀的pH为___________ 。(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全; :
: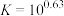 ,
,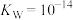 ,
, )
)
(3)“转化”中发生的离子反应为___________ ,可替代 的物质是
的物质是___________ 。
(4)利用上述表格数据,如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是___________ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式___________ 。
(6)由滤液③得到硫酸镍晶体的一系列操作为___________ 。
 ):
):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH沉淀完全时(  )的pH )的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
回答下列问题:
(1)Ni在元素周期表中的位置
(2)“碱浸”中NaOH的两个作用,一个是溶解铝及其氧化物,另一个是
 为沉淀完全;
为沉淀完全; :
: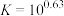 ,
,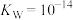 ,
, )
)(3)“转化”中发生的离子反应为
 的物质是
的物质是(4)利用上述表格数据,如果“转化”后的溶液中
 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)由滤液③得到硫酸镍晶体的一系列操作为
更新时间:2023-02-09 19:24:18
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】工业上以铬铁矿(主要成分FeO·Cr2O3,含Al2O3、SiO2等杂质)为主要原料制备红矾钠(Na2Cr2O7·2H2O)的工艺流程如图a。回答下列问题:

(1)“焙烧”时,将矿料磨碎且气体与矿料逆流而行,其目的是
(2)“焙烧”的目的是将FeO·Cr2O3转化为Na2CrO4,并将Al、Si氧化物转化为可溶性钠盐,写出焙烧时FeO·Cr2O3发生的化学方程式
(3)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图b所示。当溶液中可溶组分浓度c≤1.0×10-5mol/L时,可认为已除尽。

试分析:“中和”时pH的理论范围为
(4)蒸发结晶步骤中的副产品主要是
(5)此方法生产过程中会产生大量含
 的酸性废水,可以用如图c装置处理。向废水中加入适量的NaCl进行电解,
的酸性废水,可以用如图c装置处理。向废水中加入适量的NaCl进行电解, 被电极产物还原为Cr2+,然后生成Cr(OH)3沉淀除去,废水则可以达到排放标准。
被电极产物还原为Cr2+,然后生成Cr(OH)3沉淀除去,废水则可以达到排放标准。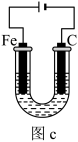
①写出阳极的电极方程式
②已知Ksp[Cr(OH)3]=1.0×10-32,若电解一段时间后,调节pH测得溶液中c(Fe3+)=1.0×10-12mol/L,则此时c(Cr3+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】“高压氢还原法”可直接从溶液中提取金属Cu粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
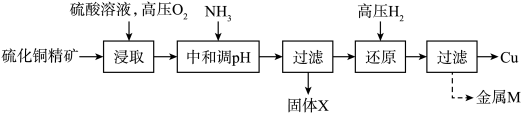
请回答下列问题:
(1)“浸取”时,能够提高浸取率的措施有___________ (任写一条即可)。
(2)“浸取”过程中,1mol CuS参与反应时,转移2NA电子,写出该过程CuS发生的离子反应方程式___________ 。
(3)工业上对硫化铜精矿的预处理有很多方法,相比于高压氢还原法的“浸取”步骤,在空气中“高温焙烧法”最大的缺点是___________ 。
(4)流程图中“中和调pH”一步,氨水调节的pH范围为___________ 。
(5)“过滤”操作用到的玻璃仪器有___________ 。
(6)固体X的主要成分是___________ ,金属M的成分___________ 。

 |  |  | |
| 开始沉淀pH | 1.9 | 4.2 | 6.2 |
| 沉淀完全pH | 3.2 | 6.7 | 8.2 |
(1)“浸取”时,能够提高浸取率的措施有
(2)“浸取”过程中,1mol CuS参与反应时,转移2NA电子,写出该过程CuS发生的离子反应方程式
(3)工业上对硫化铜精矿的预处理有很多方法,相比于高压氢还原法的“浸取”步骤,在空气中“高温焙烧法”最大的缺点是
(4)流程图中“中和调pH”一步,氨水调节的pH范围为
(5)“过滤”操作用到的玻璃仪器有
(6)固体X的主要成分是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】辉铜矿(主要成分是Cu2S)是提炼铜的重要矿物原料之一、以H2O2作为氧化剂在硫酸环境中对辉铜矿浸出生成CuSO4的模型如下:
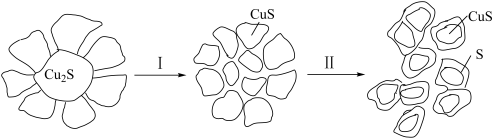
(1)根据上述转化关系,请回答。
①I和Ⅱ的转化过程中,被氧化的元素是_______ 。
②将过程Ⅰ的化学方程式补充完整:Cu2S+H2O2+_____=CuS+_____+____,_______ 。
③过程Ⅱ中,H2O2起主要作用,但加入Fe2(SO4)3可以提高浸出率。过程Ⅱ的浸出模型如图。结合难溶电解质的溶解平衡,解释加入Fe2(SO4)3的作用_______ 。
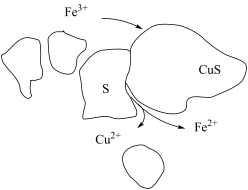
④在浸出过程中,Fe3+可以不断再生,其离子方程式是_______ 。
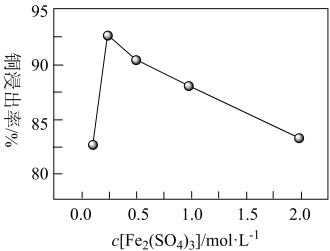
⑤在相同时间内,测得Fe2(SO4)3浓度对Cu2+浸出率的影响如下图所示。当c[Fe2(SO4)3]>0.25mol·L-1后,图中曲线下降的可能原因是_______ 。
(2)测定浸出液中Cu2+浓度,其过程如下:
i.取a mL浸出液,煮沸除尽过量H2O2,调节溶液的酸度。加入KF(除去Fe3+);
ii.加入过量KI溶液,与Cu2+反应生成CuI白色沉淀和I2
iii.用0.1000mol·L-1 Na2S2O3标准溶液滴定生成的I2,消耗Na2S2O3镕液b mL。(已知: )
)
①ii中反应的离子方程式是_______ 。
②浸出液中的c(Cu2+)=_____________ mol∙L-1。

(1)根据上述转化关系,请回答。
①I和Ⅱ的转化过程中,被氧化的元素是
②将过程Ⅰ的化学方程式补充完整:Cu2S+H2O2+_____=CuS+_____+____,
③过程Ⅱ中,H2O2起主要作用,但加入Fe2(SO4)3可以提高浸出率。过程Ⅱ的浸出模型如图。结合难溶电解质的溶解平衡,解释加入Fe2(SO4)3的作用

④在浸出过程中,Fe3+可以不断再生,其离子方程式是
⑤在相同时间内,测得Fe2(SO4)3浓度对Cu2+浸出率的影响如下图所示。当c[Fe2(SO4)3]>0.25mol·L-1后,图中曲线下降的可能原因是

(2)测定浸出液中Cu2+浓度,其过程如下:
i.取a mL浸出液,煮沸除尽过量H2O2,调节溶液的酸度。加入KF(除去Fe3+);
ii.加入过量KI溶液,与Cu2+反应生成CuI白色沉淀和I2
iii.用0.1000mol·L-1 Na2S2O3标准溶液滴定生成的I2,消耗Na2S2O3镕液b mL。(已知:
 )
)①ii中反应的离子方程式是
②浸出液中的c(Cu2+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】铜在自然界中常以多种形态存在,现以孔雀石矿石[成分为Cu2(OH)2CO3、CuFeS2、SiO2、Fe2O3等]为原料生产主产品胆矾和副产品铁红的工艺流程如图:
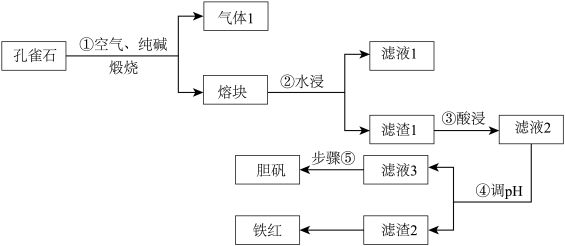
(1)气体1的成分除H2O(g)外,还有_______________ ,步骤①中发生氧化还原反应的化学方程式为 ___________________________________________________ ,滤液1的主要成分的用途之一为________________________________________ 。
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有__________ (答出两点)。
(3)步骤④调pH所用试剂为_____________ 。
(4)室温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,则滤液3中c(Fe3+)=____________ 。
(5)步骤⑤操作为___________________________________________________________ .。
(6)假设使用孔雀石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则孔雀石矿石中铁元素的含量为______________________ 。

(1)气体1的成分除H2O(g)外,还有
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有
(3)步骤④调pH所用试剂为
(4)室温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,则滤液3中c(Fe3+)=
(5)步骤⑤操作为
(6)假设使用孔雀石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则孔雀石矿石中铁元素的含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】碳酸锂是一种白色粉末,微溶于水,是常用的锂离子电池原料,也可用于制备陶瓷和催化剂。此外,碳酸锂有明显的抑制躁狂症作用,可以改善精神分裂症的情感障碍,因此碳酸锂也是一种重要的药物。工业上使用锂辉石(主要成分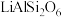 ,含少量
,含少量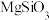 和
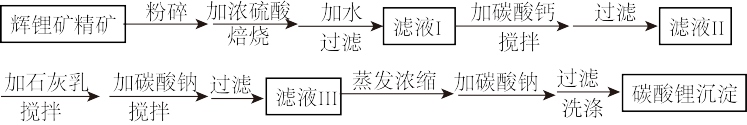
和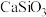 )制备碳酸锂,我国目前主要采用三种方法:石灰石焙烧法、硫酸法和硫酸盐法。硫酸法的主要流程如下图所示:
)制备碳酸锂,我国目前主要采用三种方法:石灰石焙烧法、硫酸法和硫酸盐法。硫酸法的主要流程如下图所示:
已知: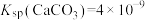 ,
,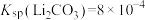 。
。
(1)将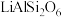 写成氧化物的形式
写成氧化物的形式___________ 。
(2)滤液Ⅰ中所含的浓度较大的两种金属阳离子是___________ 。在滤液Ⅰ中加碳酸钙的目的是___________ 。
(3)在滤液Ⅱ中加入石灰乳的目的之一是除去 ,写出发生反应的离子方程式
,写出发生反应的离子方程式___________ 。
(4)向滤液Ⅱ中加完石灰乳再加碳酸钠时,为了将 恰好沉淀完全[
恰好沉淀完全[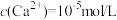 ]),此时
]),此时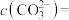
___________ mol/L。假设此时溶液中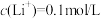 ,试通过计算说明此时是否会生成碳酸锂沉淀:
,试通过计算说明此时是否会生成碳酸锂沉淀:___________ 。
(5)有人研究出一种从碳酸锂制备锂单质的新方法:将碳酸锂和氧化铝混合后加强热,该反应有一种常见温室气体生成;充分反应后再加入铝粉继续加强热,反应后进行分离即可得到锂单质,写出这两步反应的化学方程式:___________ ,___________ 。
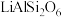 ,含少量
,含少量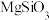 和
和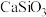 )制备碳酸锂,我国目前主要采用三种方法:石灰石焙烧法、硫酸法和硫酸盐法。硫酸法的主要流程如下图所示:
)制备碳酸锂,我国目前主要采用三种方法:石灰石焙烧法、硫酸法和硫酸盐法。硫酸法的主要流程如下图所示:
已知:
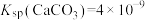 ,
,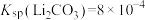 。
。(1)将
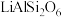 写成氧化物的形式
写成氧化物的形式(2)滤液Ⅰ中所含的浓度较大的两种金属阳离子是
(3)在滤液Ⅱ中加入石灰乳的目的之一是除去
 ,写出发生反应的离子方程式
,写出发生反应的离子方程式(4)向滤液Ⅱ中加完石灰乳再加碳酸钠时,为了将
 恰好沉淀完全[
恰好沉淀完全[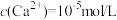 ]),此时
]),此时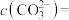
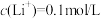 ,试通过计算说明此时是否会生成碳酸锂沉淀:
,试通过计算说明此时是否会生成碳酸锂沉淀:(5)有人研究出一种从碳酸锂制备锂单质的新方法:将碳酸锂和氧化铝混合后加强热,该反应有一种常见温室气体生成;充分反应后再加入铝粉继续加强热,反应后进行分离即可得到锂单质,写出这两步反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】我国科学家以ZrO2、Al2O3、TiO2和活性炭为载体合成具有低温活性的钨酸盐催化剂。以天然锆英石(主要成分是ZrSiO4,含少量FeO、Al2O3、CuO,SiO2等杂质)为原料制备ZrO2的流程如下(部分条件和产物省略):

请回答下列问题:
(1)锆单质晶体有最密面心立方、体心立方两种,如图所示。图1、图2晶胞中锆原子配位数之比为_______ 。

(2)“粉碎过筛”的目的是_______ 。
(3)滤渣1的主要成分是_______ (填化学式);实验室完成操作A时,装Zr(OH)4的仪器名称为_______ 。
(4)室温下,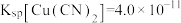 。为了使
。为了使 ,溶液
,溶液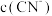 范围为
范围为_______ 。
(5)利用滤渣2可以制备铁红,其操作过程是:将滤渣2溶于过量的烧碱溶液,经过_______ (填操作名称)、洗涤、灼烧得到纯铁红。
(6)滤液1中CN-经处理达标后才能排放,常用电化学法处理,装置如图所示。

处理CN-的离子方程式为_______ 。石墨(1)上产生4.48L气体(标准状况),理论上通过交换膜的主要离子的物质的量及符号为_______ 离子。

请回答下列问题:
(1)锆单质晶体有最密面心立方、体心立方两种,如图所示。图1、图2晶胞中锆原子配位数之比为

(2)“粉碎过筛”的目的是
(3)滤渣1的主要成分是
(4)室温下,
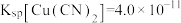 。为了使
。为了使 ,溶液
,溶液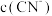 范围为
范围为(5)利用滤渣2可以制备铁红,其操作过程是:将滤渣2溶于过量的烧碱溶液,经过
(6)滤液1中CN-经处理达标后才能排放,常用电化学法处理,装置如图所示。

处理CN-的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】钨是熔点最高的金属,是重要的战略物资.自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物.由黑钨矿冶炼钨的工艺流程如图:

已知:①滤渣I的主要成分是Fe2O3、MnO2。
②上述流程中,除最后一步外,其余步骤钨的化合价未变。
③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为______ ,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式______ 。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32﹣、HAsO32﹣、HAsO42﹣、HPO42﹣等,则“净化”过程中,加入H2O2时发生反应的离子方程式为______ ,滤渣Ⅱ的主要成分是______ 。

(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则T1时Ksp(CaWO4)=______ mol2•L﹣2.将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_____ ,T2时该反应的平衡常数为___ mol•L﹣1.
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2.该阳极反应式为______ 。

已知:①滤渣I的主要成分是Fe2O3、MnO2。
②上述流程中,除最后一步外,其余步骤钨的化合价未变。
③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32﹣、HAsO32﹣、HAsO42﹣、HPO42﹣等,则“净化”过程中,加入H2O2时发生反应的离子方程式为

(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则T1时Ksp(CaWO4)=
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2.该阳极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
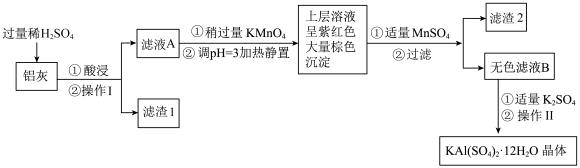
(1)明矾净水的原理是____________ (用离子方程式表示)。
(2)操作Ⅱ是蒸发浓缩、__________ 、过滤、__________ 、干燥,
(3)检验滤液A中是否存在Fe2+的试剂是________________ (只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_________ ,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):________
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:_________________ ,滤渣2含有的物质是_______________ 。

(1)明矾净水的原理是
(2)操作Ⅱ是蒸发浓缩、
(3)检验滤液A中是否存在Fe2+的试剂是
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为___________________________ 。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为__________________________________________________ 。
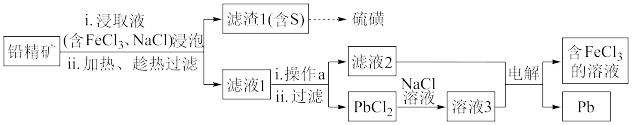
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
已知:①不同温度下PbCl2的溶解度如下表所示。
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq) PbCl42-(aq)
PbCl42-(aq)
(3)浸取液中FeCl3的作用是___________________________ 。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是____________________________________ 。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于_______________ (填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的原理:_____________________ 。
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为_______________ 。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:①不同温度下PbCl2的溶解度如下表所示。
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
 PbCl42-(aq)
PbCl42-(aq) (3)浸取液中FeCl3的作用是
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于
②简述滤液2电解后再生为FeCl3的原理:
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】亚氯酸钠(NaClO2)是一种强氧化物,广泛用于纺织和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计的生产NaClO2的主要流程如下(部分产品未标出):

(1)Ⅰ中反应的还原产物是______ (填化学式,下同),Ⅱ中反应的氧化产物是______ 。
(2)Ⅱ中反应的化学方程式是______ 。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中的还原剂是______ 。
②研究表明,在上述过程中会发生副反应NaClO2+4HCl=NaCl+2Cl2↑+2H2O。若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。推测其原因是______ 。

(1)Ⅰ中反应的还原产物是
(2)Ⅱ中反应的化学方程式是
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中的还原剂是
②研究表明,在上述过程中会发生副反应NaClO2+4HCl=NaCl+2Cl2↑+2H2O。若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。推测其原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

(1)试剂X应选择________ (选填“氢氧化钠溶液”、“盐酸”),反应①过滤后所得沉淀为__ ;反应①的离子方程式_____ ;
(2)反应②中Y是_____ (写化学式);
(3)写出由Al(OH)3加热为Al2O3的反应方程式_______

(1)试剂X应选择
(2)反应②中Y是
(3)写出由Al(OH)3加热为Al2O3的反应方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】铜及其化合物有广泛的应用。氯化亚铜(CuCl)微溶于水,不溶于酒精,在潮湿空气中易水解氧化。某课外小组以某工业废渣(主要成分为硅、铜、碳等)为原料制备CuCl的流程示意图如图所示。
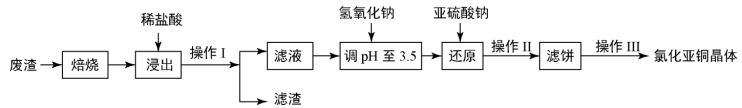
(1)“滤渣”的主要成分为______ (填化学式)。
(2)“还原”过程中Cu2+还原为CuCl,请写出反应的离子方程式:_________ 。
(3)还原过程中加入的Na2SO3过量,目的是除去氧气防止CuCl被氧化,原理是______ (用化学方程式表示)。
(4)CuCl在潮湿的环境中容易被氧化生成Cu2(OH)3Cl,反应化学方程式是__________ 。
(5)CuCl粗品中含有Cu2+加入铜粉和盐酸,Cu2+转化为CuCl,反应的离子方程式是__________ ,操作Ⅲ中包括对滤饼的醇洗,醇洗的目的是_________ 。
(6)CuCl在含有Cl-的溶液中存在平衡:CuCl+2Cl- [CuCl3]2-,加水稀释,Cl-浓度
[CuCl3]2-,加水稀释,Cl-浓度__________ (填写“变大”、“变小”或“”不变)。

(1)“滤渣”的主要成分为
(2)“还原”过程中Cu2+还原为CuCl,请写出反应的离子方程式:
(3)还原过程中加入的Na2SO3过量,目的是除去氧气防止CuCl被氧化,原理是
(4)CuCl在潮湿的环境中容易被氧化生成Cu2(OH)3Cl,反应化学方程式是
(5)CuCl粗品中含有Cu2+加入铜粉和盐酸,Cu2+转化为CuCl,反应的离子方程式是
(6)CuCl在含有Cl-的溶液中存在平衡:CuCl+2Cl-
 [CuCl3]2-,加水稀释,Cl-浓度
[CuCl3]2-,加水稀释,Cl-浓度
您最近一年使用:0次



