1 . A、储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质—碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、 、
、 、
、 、
、 、
、 和
和 七种。
七种。
(1)请用上述物质填空(不用配平):_____
 。
。
(2)上述反应中氧化剂是(填化学式)______ ,被氧化的元素是(填元素符号)______ 。
(3) 在上述反应中表现出来的性质是(填选项序号)______。
在上述反应中表现出来的性质是(填选项序号)______。
B、 与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为:
与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为: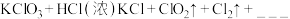
(4)请完成该化学方程式__________________
(5)浓盐酸在反应中显示出来的性质是______ (填写编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(6)若产生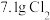 ,则生成
,则生成 的质量为
的质量为_____  。
。
(7) 具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是
具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是 的
的_____ 倍(小数点后保留两位数字)。
 、
、 、
、 、
、 、
、 和
和 七种。
七种。(1)请用上述物质填空(不用配平):
 。
。(2)上述反应中氧化剂是(填化学式)
(3)
 在上述反应中表现出来的性质是(填选项序号)______。
在上述反应中表现出来的性质是(填选项序号)______。| A.氧化性 | B.氧化性和酸性 | C.酸性 | D.还原性和酸性 |
B、
 与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为:
与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为: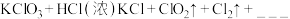
(4)请完成该化学方程式
(5)浓盐酸在反应中显示出来的性质是
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(6)若产生
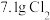 ,则生成
,则生成 的质量为
的质量为 。
。(7)
 具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是
具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是 的
的
您最近一年使用:0次
2 . 按要求填空。
(1)反应 在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,
在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,___________ (填分子式,下同)是氧化剂,___________ 是还原产物。
(2)适量服用维生素C有利于铁元素的吸收,原因是维生素C可以将 转变为
转变为 。这说明维生素C具有:
。这说明维生素C具有:___________ (填“氧化性”或“还原性”)。
(3)已知有 ,
,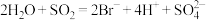 ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为___________ 。
(4)含氮废水不仅会引起水体富营养化而导致黑臭,而且对人群及其他生物产生毒害作用。现采用铝还原法来将 还原为
还原为 。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:
。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:________
___________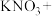 ___________Al+___________
___________Al+___________ ___________
___________ ___________
___________ ___________KOH
___________KOH
(5)元素G的一种含氧酸化学式为 ,属于二元酸,则
,属于二元酸,则 与过量氢氧化钠溶液反应生成的产物
与过量氢氧化钠溶液反应生成的产物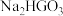 为
为___________ (填“酸式盐”或“正盐”)。
(1)反应
 在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,
在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,(2)适量服用维生素C有利于铁元素的吸收,原因是维生素C可以将
 转变为
转变为 。这说明维生素C具有:
。这说明维生素C具有:(3)已知有
 ,
,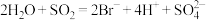 ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为(4)含氮废水不仅会引起水体富营养化而导致黑臭,而且对人群及其他生物产生毒害作用。现采用铝还原法来将
 还原为
还原为 。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:
。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:___________
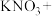 ___________Al+___________
___________Al+___________ ___________
___________ ___________
___________ ___________KOH
___________KOH(5)元素G的一种含氧酸化学式为
 ,属于二元酸,则
,属于二元酸,则 与过量氢氧化钠溶液反应生成的产物
与过量氢氧化钠溶液反应生成的产物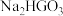 为
为
您最近一年使用:0次
名校
解题方法
3 . KClO3和浓盐酸在一定温度下反应生成黄绿色的易爆物二氧化氯.其变化可表述为 KClO3+
KClO3+ HCl(浓)=
HCl(浓)= KCl+
KCl+ ClO2↑+
ClO2↑+ Cl2↑+
Cl2↑+ ______。
______。
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)______ 。
(2)浓盐酸在反应中显示出来的性质是______ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生1分子Cl2,转移的电子为______ 个。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的______ 倍(保留小数点后两位)。
 KClO3+
KClO3+ HCl(浓)=
HCl(浓)= KCl+
KCl+ ClO2↑+
ClO2↑+ Cl2↑+
Cl2↑+ ______。
______。(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生1分子Cl2,转移的电子为
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的
您最近一年使用:0次
名校
解题方法
4 . 实验室制备Cl2有三种常用方法:
a.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
b. KMnO4+
KMnO4+ HCl(浓)=
HCl(浓)= KCl+
KCl+ MnCl2+
MnCl2+ Cl2↑+
Cl2↑+ H2O
H2O
c.KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(1)常温下,医用酒精、Cl2、KMnO4、MnCl2、浓盐酸中能导电的是______ ,属于混合物的是______ ,属于电解质的是______ 。
(2)写出反应c对应的离子方程式:______ [已知HCl(浓)可拆分为H+和Cl-]。
(3)配平反应b的方程式______ 。
(4)当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应______ (填“a”“b”或“c”,下同);当得到等质量的Cl2时,消耗HCl的质量最多的是反应______ 。
a.MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2Ob.
 KMnO4+
KMnO4+ HCl(浓)=
HCl(浓)= KCl+
KCl+ MnCl2+
MnCl2+ Cl2↑+
Cl2↑+ H2O
H2Oc.KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(1)常温下,医用酒精、Cl2、KMnO4、MnCl2、浓盐酸中能导电的是
(2)写出反应c对应的离子方程式:
(3)配平反应b的方程式
(4)当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应
您最近一年使用:0次
名校
解题方法
5 . 氧化还原反应是重要的化学反应类型,在生活、生产、科研领域都有广泛的应用,请回答以下问题。
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐会导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。以上过程中分别体现了亚硝酸盐、维生素C的什么性质:______ 、______ (填“氧化性”或“还原性”)。
(2)生活中若将“84”消毒液(有效成分是NaClO)和洁厕精(主要成分是HCl)混合,易产生黄绿色有毒气体Cl2。
①将方程式补充完整:______ 。
______NaClO+______HCl(浓)=______NaCl+______Cl2↑+______H2O
②该反应中氧化剂是______ (填化学式),氧化产物与还原产物个数比为______ 。
③砒霜(As2O3)可与Zn反应:As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O。每生成1个AsH3分子转移______ 个电子。
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐会导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。以上过程中分别体现了亚硝酸盐、维生素C的什么性质:
(2)生活中若将“84”消毒液(有效成分是NaClO)和洁厕精(主要成分是HCl)混合,易产生黄绿色有毒气体Cl2。
①将方程式补充完整:
______NaClO+______HCl(浓)=______NaCl+______Cl2↑+______H2O
②该反应中氧化剂是
③砒霜(As2O3)可与Zn反应:As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O。每生成1个AsH3分子转移
您最近一年使用:0次
6 . 完成下列问题
(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的 转变为易吸收的
转变为易吸收的 ,这说明维生素C具有
,这说明维生素C具有_______ (填“氧化性”或“还原性”)。
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为: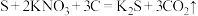 +________,
+________,_______ (完善方程式,填化学式,下同);在该反应中氧化剂是_______ ;方程式中所涉及的物质,哪些是氧化物_______ ,哪些是电解质_______ 。
(3)把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。
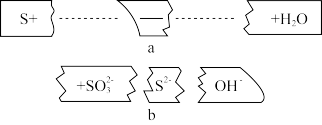
写出并配平该反应的离子方程式:_______ 。
(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的
 转变为易吸收的
转变为易吸收的 ,这说明维生素C具有
,这说明维生素C具有(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:
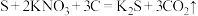 +________,
+________,(3)把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。

写出并配平该反应的离子方程式:
您最近一年使用:0次
7 . 2021年,贵阳市空气质量优良率达98.9%,这得益于贵阳市对含硫化合物等排放的有效控制。回答下列问题:
(1)燃煤的烟气中含有 ,为了治理雾霾,工厂采用如图所示多种方法实现烟气脱硫。
,为了治理雾霾,工厂采用如图所示多种方法实现烟气脱硫。
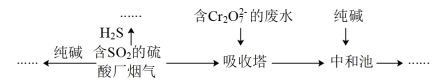
①写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
②用含 的烟气处理含
的烟气处理含 的酸性废水时,所发生的离子反应为
的酸性废水时,所发生的离子反应为___________ :
___________ +___________
+___________ +___________
+___________ =___________
=___________ +___________
+___________ +___________
+___________
配平该离子反应,并判断该处理方式利用了 的
的___________ 性。
(2)实验室提供以下试剂:浓 、稀
、稀 、酸性
、酸性 溶液、
溶液、 溶液、Cu、品红溶液。若要实现
溶液、Cu、品红溶液。若要实现 的转化,可选择的试剂是
的转化,可选择的试剂是___________ ,所发生反应的化学方程式为___________ ;设计实验,证明能实现该转化的操作和现象为___________ 。
(1)燃煤的烟气中含有
 ,为了治理雾霾,工厂采用如图所示多种方法实现烟气脱硫。
,为了治理雾霾,工厂采用如图所示多种方法实现烟气脱硫。
①写出
 与
与 反应的化学方程式
反应的化学方程式②用含
 的烟气处理含
的烟气处理含 的酸性废水时,所发生的离子反应为
的酸性废水时,所发生的离子反应为___________
 +___________
+___________ +___________
+___________ =___________
=___________ +___________
+___________ +___________
+___________
配平该离子反应,并判断该处理方式利用了
 的
的(2)实验室提供以下试剂:浓
 、稀
、稀 、酸性
、酸性 溶液、
溶液、 溶液、Cu、品红溶液。若要实现
溶液、Cu、品红溶液。若要实现 的转化,可选择的试剂是
的转化,可选择的试剂是
您最近一年使用:0次
2022-07-14更新
|
373次组卷
|
2卷引用:湖南省株洲市炎陵县2022-2023学年高一下学期3月月考化学试题
名校
解题方法
8 . 铁及其化合物与生产、生活关系密切
(1)生铁(以赤铁矿为例)是通过高炉冶炼而得,用化学方程式表示其原理为_______________ 。
(2)在钢铁厂的生产中,炽热的铁水注入模具之前,必须对模具进行充分的干燥处理,不得留有水,原因是____________ (用化学方程式表示)。
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若要检验是否有Fe3+生成,方法是_________________ 。
②步骤II中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________ 。
③上述生产流程中,能体现“绿色化学”思想的是_____________ (任写一项)。
(4)Fe2O3可制取新型、高效水处理剂高铁酸钾K2FeO4。
_____Fe2O3+ _____NaClO+ _____KOH _____K2FeO4(高铁酸钾)+ _____NaCl+ _____H2O
_____K2FeO4(高铁酸钾)+ _____NaCl+ _____H2O
①配平上述反应,并用单线桥法表示反应过程中转移电子数目和方向_____ 。此过程中氧化剂是______ (填化学式)。
②高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用是_________ 、___________ 。
(1)生铁(以赤铁矿为例)是通过高炉冶炼而得,用化学方程式表示其原理为
(2)在钢铁厂的生产中,炽热的铁水注入模具之前,必须对模具进行充分的干燥处理,不得留有水,原因是
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若要检验是否有Fe3+生成,方法是
②步骤II中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为
③上述生产流程中,能体现“绿色化学”思想的是
(4)Fe2O3可制取新型、高效水处理剂高铁酸钾K2FeO4。
_____Fe2O3+ _____NaClO+ _____KOH
 _____K2FeO4(高铁酸钾)+ _____NaCl+ _____H2O
_____K2FeO4(高铁酸钾)+ _____NaCl+ _____H2O ①配平上述反应,并用单线桥法表示反应过程中转移电子数目和方向
②高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用是
您最近一年使用:0次
2022-04-24更新
|
403次组卷
|
2卷引用:湖南省株洲市第二中学2022-2023学年高一上学期第三次月考化学试题
名校
9 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。家庭中常常使用的消毒剂主要是84消毒液,可以说化学让生活更美好。下图为84消毒液说明书。请回答下列问题。
(1)84消毒液的有效氯指的是每升含氯消毒剂的氧化能力(得失电子数)相当于多少克Cl2的氧化能力(Cl均转化为Cl-)。若该84消毒液商品的有效氯按53.25g·L-1计算,该消毒液的NaClO的物质的量浓度是___________ 。
(2)常温下用烧碱溶液吸收Cl2制备84消毒液。写出该反应的离子方程式:___________ ,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为___________ ,从氧化还原角度分析Cl2表现了___________ 性。
(3)家庭用84消毒液用法强调,为家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是(用离子方程式表示)___________ (已知酸性:H2CO3>HClO>HCO )。
)。
(4)游泳池水的消毒多用漂粉精,但酸碱性对漂粉精的消毒效果影响明显。池水碱性过强,杀毒作用会___________ (填“增强”或“减弱”)。
(5)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、84消毒液,主要目的是___________。
 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g·L-1~60.00g·L-1 | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物、浴缸等1∶200水溶液 餐饮具、瓜果等1∶100水溶液 |
(2)常温下用烧碱溶液吸收Cl2制备84消毒液。写出该反应的离子方程式:
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(3)家庭用84消毒液用法强调,为家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是(用离子方程式表示)
 )。
)。(4)游泳池水的消毒多用漂粉精,但酸碱性对漂粉精的消毒效果影响明显。池水碱性过强,杀毒作用会
(5)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、84消毒液,主要目的是___________。
| A.增强漂白能力和消毒作用 |
| B.使它转化为较稳定物质,便于保存和运输 |
| C.使它转化为较易溶于水的物质 |
| D.提高氯的质量分数,有利于漂白、消毒 |
您最近一年使用:0次
2021-12-21更新
|
183次组卷
|
2卷引用:湖南省攸县第三中学2022-2023年高一上学期第三次月考化学试题
名校
解题方法
10 . 按要求回答下列问题:
(1)3S+6KOH K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为
K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为_______ 。
(2)下列实验方案中,能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的方案有_______ 。
A.取a克混合物与稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
(3)NH3催化还原氮氧化物可用于烟气中氮氧化物脱除,反应原理如图所示:
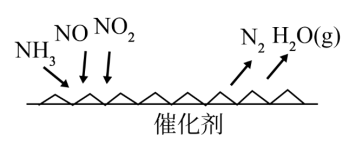
①该反应的还原剂为_______ 。
②写出烟气中NO2与足量氨气反应的化学方程式_______ 。
(4)“地康法”制取氯气的总反应方程式4HCl+O2=2H2O+2Cl2,其反应原理如图所示:
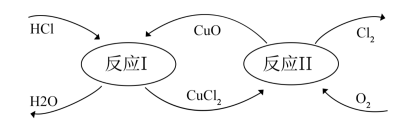
反应I:CuO+2HCl=CuCl2+H2O
反应Ⅱ:..
反应Ⅱ的化学方程式为_______ 。
(1)3S+6KOH
 K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为
K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为(2)下列实验方案中,能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的方案有
A.取a克混合物与稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
(3)NH3催化还原氮氧化物可用于烟气中氮氧化物脱除,反应原理如图所示:

①该反应的还原剂为
②写出烟气中NO2与足量氨气反应的化学方程式
(4)“地康法”制取氯气的总反应方程式4HCl+O2=2H2O+2Cl2,其反应原理如图所示:

反应I:CuO+2HCl=CuCl2+H2O
反应Ⅱ:..
反应Ⅱ的化学方程式为
您最近一年使用:0次
2021-11-30更新
|
172次组卷
|
2卷引用:湖南省株洲市攸县第三中学2022-2023学年高一上学期期中考试化学试题



