1 . 现有下列六种物质:①液态氯化氢;②二氧化碳;③硫酸铜溶液;④熔融氯化钠;⑤ 固体;⑥铁丝.
固体;⑥铁丝.
(1)上述六种物质中,属于非电解质的是__________ ,能导电的电解质是__________ (填序号)。
(2)③和⑥反应的基本反应类型为__________ ,其离子方程式为__________ 。
(3)氯化氢在水溶液中的电离方程式为__________ 。
(4)向③中加入⑤的水溶液的现象为__________ 。
(5) 与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失
与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失______ 。
__________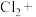 __________
__________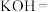 __________
__________ __________
__________ __________
__________
 固体;⑥铁丝.
固体;⑥铁丝.(1)上述六种物质中,属于非电解质的是
(2)③和⑥反应的基本反应类型为
(3)氯化氢在水溶液中的电离方程式为
(4)向③中加入⑤的水溶液的现象为
(5)
 与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失
与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失__________
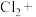 __________
__________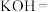 __________
__________ __________
__________ __________
__________
您最近一年使用:0次
名校
2 . 无机化合物可根据其组成和性质进行分类,分类比较是研究物质性质常用的一类方法。
(1)砷有多种化合物,其中As2O5溶于水缓慢化合生成一种三元酸(H3AsO4)。某工业废渣中含有As2O5、Fe2O3和MgO三种物质。现要分离提取 出砷元素,有同学建议用NaOH溶液,理由是_______ 。
(2)As2O3俗称砒霜,是宫廷剧中“鹤顶红”的有效成分,可以用马氏试砷法来检测砒霜。具体方法是:用Zn、盐酸和试样混在一起,将生成的气体导入热玻璃管,若试样中有砒霜,就会在热玻璃管中产生As,As积集而成亮黑色的“砷镜”。生成“砷镜”过程中共发生两个反应,①_______ ;②2AsH3=2As+3H2
(1)砷有多种化合物,其中As2O5溶于水缓慢化合生成一种三元酸(H3AsO4)。某工业废渣中含有As2O5、Fe2O3和MgO三种物质。现要
(2)As2O3俗称砒霜,是宫廷剧中“鹤顶红”的有效成分,可以用马氏试砷法来检测砒霜。具体方法是:用Zn、盐酸和试样混在一起,将生成的气体导入热玻璃管,若试样中有砒霜,就会在热玻璃管中产生As,As积集而成亮黑色的“砷镜”。生成“砷镜”过程中共发生两个反应,①
您最近一年使用:0次
名校
解题方法
3 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。
Ⅰ.某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:
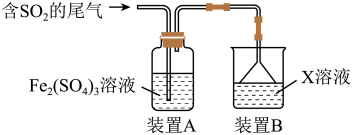
(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的化学方程式:___________ 。
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为___________ ;若要检验SO2是否过量,可用试剂为___________ 。
(3)装置B中所用X溶液常为碱溶液,其作用是___________ 。
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00 mL装置A中溶液,向其中逐滴加入0.100 0 mol/L Ce(SO4)2溶液,发生反应Fe2++Ce4+= Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00 mL。则FeSO4的物质的量浓度为___________ 。
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。结合化学方程式说明用水吸收NO2的缺陷___________ 。
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:___________ 。
Ⅰ.某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:

(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的化学方程式:
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为
(3)装置B中所用X溶液常为碱溶液,其作用是
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00 mL装置A中溶液,向其中逐滴加入0.100 0 mol/L Ce(SO4)2溶液,发生反应Fe2++Ce4+= Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00 mL。则FeSO4的物质的量浓度为
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。结合化学方程式说明用水吸收NO2的缺陷
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
您最近一年使用:0次
4 . 高锰酸钾是一种典型的强氧化剂。完成下列填空:
Ⅰ:在用 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生的反应如下:
和CuS的混合物时,发生的反应如下:
①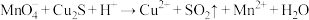 (未配平)
(未配平)
②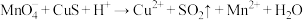 (未配平)
(未配平)
(1)下列关于反应①的说法中错误的是___________ (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下) ,转移电子的物质的量是0.8mol
,转移电子的物质的量是0.8mol
d.还原性的强弱关系是: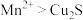
Ⅱ:在稀硫酸中, 与也能发生氧化还原反应。
与也能发生氧化还原反应。
(2)配平 与
与 反应的离子方程式:
反应的离子方程式:___________

(3)欲配制480mL0.1mol/L 溶液,需称取
溶液,需称取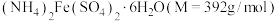 的质量为
的质量为___________ g,需要的玻璃仪器有___________ 。
Ⅲ:实验室可由软锰矿(主要成分为 )制备
)制备 ,方法如下:高温下使软锰矿与过量
,方法如下:高温下使软锰矿与过量 和
和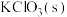 反应,生成
反应,生成 (锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,
(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液, 转化为
转化为 和
和 ;再滤去沉淀
;再滤去沉淀 ,浓缩结晶得到
,浓缩结晶得到 晶体。请回答:
晶体。请回答:
(4)用软锰矿制备 的化学方程式是:
的化学方程式是:___________ 。
(5) 转化为
转化为 的反应中氧化剂和还原剂的物质的量之比为
的反应中氧化剂和还原剂的物质的量之比为___________ 。
Ⅰ:在用
 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生的反应如下:
和CuS的混合物时,发生的反应如下:①
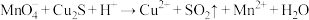 (未配平)
(未配平)②
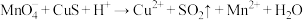 (未配平)
(未配平)(1)下列关于反应①的说法中错误的是
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下)
 ,转移电子的物质的量是0.8mol
,转移电子的物质的量是0.8mold.还原性的强弱关系是:
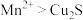
Ⅱ:在稀硫酸中,
 与也能发生氧化还原反应。
与也能发生氧化还原反应。(2)配平
 与
与 反应的离子方程式:
反应的离子方程式:
(3)欲配制480mL0.1mol/L
 溶液,需称取
溶液,需称取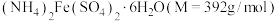 的质量为
的质量为Ⅲ:实验室可由软锰矿(主要成分为
 )制备
)制备 ,方法如下:高温下使软锰矿与过量
,方法如下:高温下使软锰矿与过量 和
和 反应,生成
反应,生成 (锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,
(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液, 转化为
转化为 和
和 ;再滤去沉淀
;再滤去沉淀 ,浓缩结晶得到
,浓缩结晶得到 晶体。请回答:
晶体。请回答:(4)用软锰矿制备
 的化学方程式是:
的化学方程式是:(5)
 转化为
转化为 的反应中氧化剂和还原剂的物质的量之比为
的反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
解题方法
5 . 元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具。如图是钠的价类二维图:
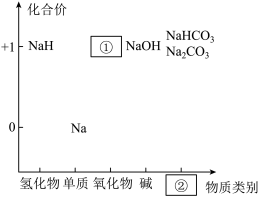
(1)②处应填的物质类别是___________ ;
(2)将钠放入水中发生反应的离子方程式是___________ ;
(3)Na可用石蜡封存,实验室少量Na保存于___________ 中;
(4)将Na2O2投入盛有CuSO4溶液的烧杯中,观察到的现象是___________(填标号);
(5)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:
____ +____Na2O2+______→ ______Mn2++______Na++_____+_____H2O(未配平)
+____Na2O2+______→ ______Mn2++______Na++_____+_____H2O(未配平)
首先请补全方程式并配平__________ ,然后回答反应中被还原的元素是___________ ;反应中每消耗1molNa2O2的同时有___________ mol电子转移。

(1)②处应填的物质类别是
(2)将钠放入水中发生反应的离子方程式是
(3)Na可用石蜡封存,实验室少量Na保存于
(4)将Na2O2投入盛有CuSO4溶液的烧杯中,观察到的现象是___________(填标号);
| A.有气体生成 | B.无气体生成 | C.有蓝色沉淀生成 | D.大量红色固体铜生成 |
(5)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:
____
 +____Na2O2+______→ ______Mn2++______Na++_____+_____H2O(未配平)
+____Na2O2+______→ ______Mn2++______Na++_____+_____H2O(未配平)首先请补全方程式并配平
您最近一年使用:0次
名校
解题方法
6 . 硫、氮化合物的资源化利用既能解决环保问题,又能提供化工原料,缓解能源紧张问题,具有重要的现实意义和广阔的应用前景。
(1) 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。氨水吸收少量
。氨水吸收少量 ,可生成
,可生成 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(2)上述所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为_______ 。
(3)工业或机动车尾气中的 会造成环境问题,可用多种方法脱除。
会造成环境问题,可用多种方法脱除。
①碱液吸收: 溶液可吸收硝酸工业尾气(含
溶液可吸收硝酸工业尾气(含 、
、 ),获得副产品
),获得副产品 。等物质的量的
。等物质的量的 与
与 被
被 溶液吸收,反应的离子方程式为
溶液吸收,反应的离子方程式为_______ 。
②上述碱液吸收时,若 与
与 的比例控制不当,则吸收液经浓缩结晶、过滤得到的
的比例控制不当,则吸收液经浓缩结晶、过滤得到的 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是_______ (填化学式)。排放的尾气中含量较高的氮氧化物是_______ (填化学式)。
③还原法:尿素水溶液热解产生的 可去除尾气中的
可去除尾气中的 ,流程如下:
,流程如下:

A.写出“催化反应"过程中 还原
还原 的化学方程式:
的化学方程式:_______ 。
B.若氧化处理后的尾气中混有 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低
,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程:
的去除率。试分析硫酸盐的产生过程:_______ 。
(1)
 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。氨水吸收少量
。氨水吸收少量 ,可生成
,可生成 ,反应的离子方程式为
,反应的离子方程式为(2)上述所得溶液再用
 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为(3)工业或机动车尾气中的
 会造成环境问题,可用多种方法脱除。
会造成环境问题,可用多种方法脱除。①碱液吸收:
 溶液可吸收硝酸工业尾气(含
溶液可吸收硝酸工业尾气(含 、
、 ),获得副产品
),获得副产品 。等物质的量的
。等物质的量的 与
与 被
被 溶液吸收,反应的离子方程式为
溶液吸收,反应的离子方程式为②上述碱液吸收时,若
 与
与 的比例控制不当,则吸收液经浓缩结晶、过滤得到的
的比例控制不当,则吸收液经浓缩结晶、过滤得到的 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是③还原法:尿素水溶液热解产生的
 可去除尾气中的
可去除尾气中的 ,流程如下:
,流程如下:
A.写出“催化反应"过程中
 还原
还原 的化学方程式:
的化学方程式:B.若氧化处理后的尾气中混有
 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低
,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程:
的去除率。试分析硫酸盐的产生过程:
您最近一年使用:0次
2023-03-14更新
|
460次组卷
|
3卷引用:湖南省邵阳市绥宁县第一中2022-2023学年高一下学期期中考试化学试题
7 . 回答下列问题:
(1)标准状况下,5.6LCO物质的量是______ ,质量______ 。相同质量的CO和CO2所含原子个数比是_____ 。20gNaOH溶于水得到0.5升溶液其物质的量浓度为______ mol•L-1。
(2)NH4NO3是______ (填电解质或非电解质),写出硫酸铁的电离方程式______ 。
(3)写出将碳酸氢钠溶液与稀盐酸混合,反应的离子方程式为______ ;向氯化亚铁溶液中通入氯气的离子方程式是______ 。
(4)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式(未配平)表示为:
_______ClO-+_______Fe3++_______OH-=_______FeO +_______Cl-+_______H2O
+_______Cl-+_______H2O
请配平上述反应方程式______ ;上述反应中氧化剂是______ ,还原剂是______ 。
(1)标准状况下,5.6LCO物质的量是
(2)NH4NO3是
(3)写出将碳酸氢钠溶液与稀盐酸混合,反应的离子方程式为
(4)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式(未配平)表示为:
_______ClO-+_______Fe3++_______OH-=_______FeO
 +_______Cl-+_______H2O
+_______Cl-+_______H2O请配平上述反应方程式
您最近一年使用:0次
8 . 唐朝初年,瘟疫频发,人们把它归因于一种叫“年”的怪兽。一位叫李田的人就把硝石、硫磺和木炭装在竹筒里,点燃后驱赶怪兽。后来人们靠此驱散了山林瘴气,战胜了疫情。中国古代四大发明之一的“黑火药”是由“一硫二硝三木炭”混合而成。
(1)写出“黑火药”爆炸的化学反应方程式_______ 。
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的SO2气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是_______ (用文字表述,任写一条合理途径)。
(3)古代曾用硝土[含有 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:

①“反应”过程中的离子反应方程式为_______ 。
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和_______ ;
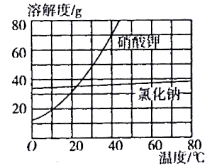
③如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液_______ 、过滤洗涤、干燥等步骤。
(4)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油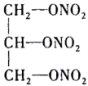 (
(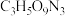 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为_______ ;
②实验室制备硝化甘油的化学方程式为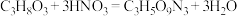 ,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
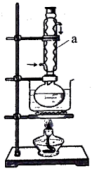
该装置中仪器a名称为_______ ,采用水浴加热而不用酒精灯直接加热的原因是_______ ,从反应后混合溶液中分离硝化甘油的简单方法是_______ 。
(1)写出“黑火药”爆炸的化学反应方程式
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的SO2气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是
(3)古代曾用硝土[含有
 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:
①“反应”过程中的离子反应方程式为
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和
③如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液

(4)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油
 (
(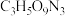 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为
②实验室制备硝化甘油的化学方程式为
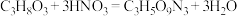 ,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
该装置中仪器a名称为
您最近一年使用:0次
解题方法
9 . A、B、C、D四种物质之间有下图所示的转化关系。已知A是气体单质,C是红棕色气体。

回答下列问题:
(1)A的电子式:_______ ,C的化学式:_______ 。
(2)在上图D→B的过程中,D表现出强_______ (填“氧化性”或“还原性”)。
(3)写出C→D转化的化学方程式:_______ 。

回答下列问题:
(1)A的电子式:
(2)在上图D→B的过程中,D表现出强
(3)写出C→D转化的化学方程式:
您最近一年使用:0次
10 . 磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素在元素周期表中的位置:_______ ,AlP遇水蒸气会发生反应放出PH3气体,PH3中的P原子的杂化方式为_______ 杂化,该反应的另一种产物的化学式为_______ 。
(2) 具有强还原性,能与
具有强还原性,能与 溶液反应,配平该反应的化学方程式:
溶液反应,配平该反应的化学方程式:_______ 。

(3)工业制备 的流程如图所示。
的流程如图所示。

① 次磷酸属于_______ 元酸。
② 白磷和烧碱溶液反应的化学方程式为:_______ 。
③ 若起始时有1 mol P4参加反应,则整个工业流程中共生成_______ mol  (不考虑产物损失)
(不考虑产物损失)
(1)磷元素在元素周期表中的位置:
(2)
 具有强还原性,能与
具有强还原性,能与 溶液反应,配平该反应的化学方程式:
溶液反应,配平该反应的化学方程式:
(3)工业制备
 的流程如图所示。
的流程如图所示。
① 次磷酸属于
② 白磷和烧碱溶液反应的化学方程式为:
③ 若起始时有1 mol P4参加反应,则整个工业流程中共生成
 (不考虑产物损失)
(不考虑产物损失)
您最近一年使用:0次



