解题方法
1 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_______ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_______ 。
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:_______ 。
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2.取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:_______ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2.取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:
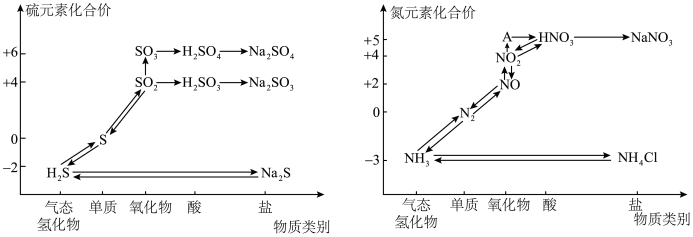
(1)根据 A 对应的化合价和物质类别,A 为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式___________ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ ,反应的离子方程式为___________ 。
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:
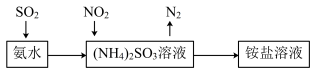
NO2 被吸收过程的离子方程式是___________ 。

(1)根据 A 对应的化合价和物质类别,A 为
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:

NO2 被吸收过程的离子方程式是
您最近一年使用:0次
名校
解题方法
3 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_______ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式_______ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_______ ,反应的离子方程式为_______ 。
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:
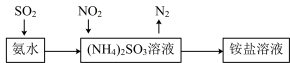
NO2被吸收过程的离子方程式是_______ 。

(1)根据A对应的化合价和物质类别,A为
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:

NO2被吸收过程的离子方程式是
您最近一年使用:0次
2021-09-07更新
|
232次组卷
|
2卷引用:湖南省长沙市长郡中学2021-2022学年高二上学期入学考试化学试题
名校
4 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
(2)我国用 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:___________ 。将该反应化学方程式改写为离子方程式:___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下降 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为___________ 。
(5)实验室用下列方法均可制取氯气
①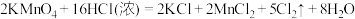 ③
③
②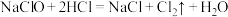 ②
②
③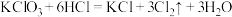 ④
④
若各反应转移的电子数相同,①②③生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下降
 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为(5)实验室用下列方法均可制取氯气
①
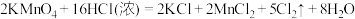 ③
③②
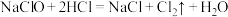 ②
②③
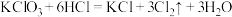 ④
④若各反应转移的电子数相同,①②③生成的氯气质量比为
您最近一年使用:0次
名校
5 . 氧化还原反应在日常生活和工业生产中有重要应用。
I. 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: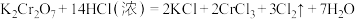 。
。
(1)该反应中被氧化的元素是_______ ,还原产物是_______ 。
(2)该反应中氧化剂与还原剂的个数比为_______ 。
(3)生成标准状况下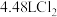 ,转移的电子个数为
,转移的电子个数为_______ (用 表示)。
表示)。
II.阅读下面一段材料并回答问题。
(4)K2FeO4中铁元素的化合价为_______ 。
(5)下列关于K2FeO4的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:_______ 。
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
I.
 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: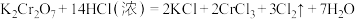 。
。(1)该反应中被氧化的元素是
(2)该反应中氧化剂与还原剂的个数比为
(3)生成标准状况下
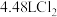 ,转移的电子个数为
,转移的电子个数为 表示)。
表示)。II.阅读下面一段材料并回答问题。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准 |
(5)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
您最近一年使用:0次
解题方法
6 . 回答下列问题:
Ⅰ.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究 的性质,请补全实验现象b.
的性质,请补全实验现象b._______ ,根据实验2现象写出该反应的离子方程式_______ 。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与 反应产生促进藻类快速生长。该反应说明氧化性:NaClO
反应产生促进藻类快速生长。该反应说明氧化性:NaClO_______  (填“>”或“<”);当有0.2mol
(填“>”或“<”);当有0.2mol 生成时,转移电子的物质的量为
生成时,转移电子的物质的量为_______ mol。
Ⅱ.亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
_______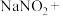 _______
_______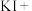 _______=_______
_______=_______ _______
_______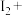 _______
_______ _______
_______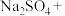 _______
_______
(3)请完成该化学方程式并配平。_______
(4)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目_______ 。
Ⅰ.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究
 的性质,请补全实验现象b.
的性质,请补全实验现象b.| 序号 | 实验 | 实验现象 |
| 1 | 向5% 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去; b._______ |
| 2 | 向含5% 的酸性溶液中滴加淀粉碘化钾溶液 的酸性溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与
 反应产生促进藻类快速生长。该反应说明氧化性:NaClO
反应产生促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当有0.2mol
(填“>”或“<”);当有0.2mol 生成时,转移电子的物质的量为
生成时,转移电子的物质的量为Ⅱ.亚硝酸钠(
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______
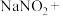 _______
_______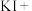 _______=_______
_______=_______ _______
_______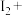 _______
_______ _______
_______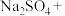 _______
_______
(3)请完成该化学方程式并配平。
(4)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目
您最近一年使用:0次
2022-11-02更新
|
234次组卷
|
2卷引用:湖南省长沙市三湘教育联盟2022-2023学年高一上学期11月联考化学试题
名校
解题方法
7 . 亚硝酸钠(NaNO2)是一种用途广泛的工业盐,其外观和食盐相似容易误食中毒。
(1)人体正常的血红蛋白中含有 ,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的
,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的 转化为
转化为 而使人体中毒,服用维生素C可解毒。
而使人体中毒,服用维生素C可解毒。 转化为
转化为 时,
时, 在反应中被
在反应中被_______ (填“氧化”或“还原”);服用维生素C可使血红蛋白中的 转变成
转变成 ,说明维生素C作
,说明维生素C作_______ (填“氧化”或“还原”)剂。
(2)已知 能发生反应:
能发生反应: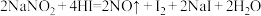 ,淀粉遇碘会变蓝色。则鉴别
,淀粉遇碘会变蓝色。则鉴别 固体和NaCl固体,无须选用的物质为
固体和NaCl固体,无须选用的物质为_______ (填标号)。
①水 ②碘化钾淀粉试纸 ③食醋 ④白酒
(3)某厂废液中含有2%~5%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是_______ (填标号)。
A.NaCl B. C.
C.
(4) 也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定。可用酸性
也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定。可用酸性 测定
测定 样品纯度,配平下列反应并用单线桥法标出该反应中电子转移的方向和数目:
样品纯度,配平下列反应并用单线桥法标出该反应中电子转移的方向和数目:_________ 。
_______ _______
_______ _______
_______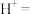 _______
_______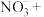 _______
_______ _______
_______
(5)可用Cl2将溶液中的NO 氧化为NO
氧化为NO ,同时生成Cl-,则该反应的离子方程式为
,同时生成Cl-,则该反应的离子方程式为_______ 。
(1)人体正常的血红蛋白中含有
 ,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的
,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的 转化为
转化为 而使人体中毒,服用维生素C可解毒。
而使人体中毒,服用维生素C可解毒。 转化为
转化为 时,
时, 在反应中被
在反应中被 转变成
转变成 ,说明维生素C作
,说明维生素C作(2)已知
 能发生反应:
能发生反应: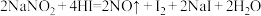 ,淀粉遇碘会变蓝色。则鉴别
,淀粉遇碘会变蓝色。则鉴别 固体和NaCl固体,无须选用的物质为
固体和NaCl固体,无须选用的物质为①水 ②碘化钾淀粉试纸 ③食醋 ④白酒
(3)某厂废液中含有2%~5%的
 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是A.NaCl B.
 C.
C.
(4)
 也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定。可用酸性
也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定。可用酸性 测定
测定 样品纯度,配平下列反应并用单线桥法标出该反应中电子转移的方向和数目:
样品纯度,配平下列反应并用单线桥法标出该反应中电子转移的方向和数目:_______
 _______
_______ _______
_______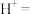 _______
_______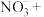 _______
_______ _______
_______
(5)可用Cl2将溶液中的NO
 氧化为NO
氧化为NO ,同时生成Cl-,则该反应的离子方程式为
,同时生成Cl-,则该反应的离子方程式为
您最近一年使用:0次
2022-10-28更新
|
103次组卷
|
2卷引用:湖南省衡阳市衡阳县第二中学2023-2024学年高一上学期期中考试化学试题
8 . 回答下列问题:
(1)向沸水中逐滴滴加适量饱和FeCl3溶液,继续加热至液体呈透明的红褐色,形成该分散系的分散质粒子的直径范围是_______ 。利用_______ 效应,证明该分散系。
(2)①56g氮气在标准状况下的体积为_______ ;密度为_______ 。
②3.9gNa2O2中阴、阳离子的个数比为_______ 。
③现有标准状况下CO和CO2混合气体6.72L,其质量为11.6g, 则此混合气体中,CO2和CO的物质的量之比是_______ 。
(3)阅读下列《高铁酸钾使用说明书》,回答问题:
①K2FeO4中铁元素的化合价为_______ 。
②制备K2FeO4需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
③下列关于K2FeO4的说法中,不正确的是_______ 。
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快,安全性好、无异味
④将K2FeO4与水反应的化学方程式补充完整:_______ 。
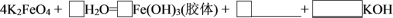
(1)向沸水中逐滴滴加适量饱和FeCl3溶液,继续加热至液体呈透明的红褐色,形成该分散系的分散质粒子的直径范围是
(2)①56g氮气在标准状况下的体积为
②3.9gNa2O2中阴、阳离子的个数比为
③现有标准状况下CO和CO2混合气体6.72L,其质量为11.6g, 则此混合气体中,CO2和CO的物质的量之比是
(3)阅读下列《高铁酸钾使用说明书》,回答问题:
| 高铁酸钾使用说明书 [化学式] K2FeO4 [性状]暗紫色具有金属光泽的粉末,无臭无味 [产品特点]干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 [用途]主要用于饮用水消毒净化、城市生活污水和工业污水处理 [用量]消毒净化1 L水投放5 mg K2FeO4即可达到卫生标准 |
②制备K2FeO4需要在
③下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快,安全性好、无异味
④将K2FeO4与水反应的化学方程式补充完整:
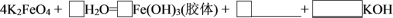
您最近一年使用:0次
解题方法
9 . 氧化还原反应在生产生活中具有广泛的用途。
(1)在碱性条件下铝粉可与 反应,其化学方程式为
反应,其化学方程式为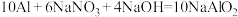
 。反应中氧化剂是
。反应中氧化剂是______ (填化学式)。
(2)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为
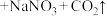 ,氧化剂与还原剂的质量之比为
,氧化剂与还原剂的质量之比为______ 。
(3) 可在野外作生氢剂,反应原理为
可在野外作生氢剂,反应原理为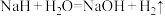 ,
, 中氢元素
中氢元素______ (填“被氧化”或“被还原”)。
(4)在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为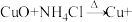
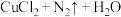 。配平此氧化还原反应方程式并用双线桥法标出电子的转移方向和数目:
。配平此氧化还原反应方程式并用双线桥法标出电子的转移方向和数目:______ 。
(1)在碱性条件下铝粉可与
 反应,其化学方程式为
反应,其化学方程式为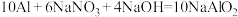
 。反应中氧化剂是
。反应中氧化剂是(2)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为

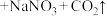 ,氧化剂与还原剂的质量之比为
,氧化剂与还原剂的质量之比为(3)
 可在野外作生氢剂,反应原理为
可在野外作生氢剂,反应原理为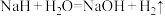 ,
, 中氢元素
中氢元素(4)在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为
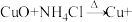
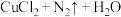 。配平此氧化还原反应方程式并用双线桥法标出电子的转移方向和数目:
。配平此氧化还原反应方程式并用双线桥法标出电子的转移方向和数目:
您最近一年使用:0次
2021-02-04更新
|
143次组卷
|
2卷引用:湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(B卷)
名校
10 . 碳、硅、锗、锡、铅属于同一主族元素,其单质及化合物具有重要的用途。
(1)铅蓄电池是最早使用的充电电池,其构造示意图如图所示,放电时的离子反应方程式为PbO2+Pb+4H++2 =2PbSO4+2H2O。该电池的负极为
=2PbSO4+2H2O。该电池的负极为_______ ,电池放电时正极质量将_______ 。(填“增大”、“减小”或“不变”)

(2)PbO2可发生如图所示的转化:

①写出“还原”反应的离子方程式:__________ ;
②写出“复分解”反应的化学方程式:___________ 。
(3)1400℃~1450℃时,石英、焦炭和氮气可反应生成耐高温、硬度大的化合物X,该反应的化学方程式为3SiO2+6C+2N2 X+6CO。
X+6CO。
①X的化学式为_______ 。
②下列措施不 能提高该反应速率的是_______ (填字母)。
a.将石英和焦炭充分混合 b.增大N2的浓度 c.将粉末状石英换成块状石英
(4)甲醇是常见的燃料电池原料,CO2催化氢化可合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。在2L容器中充入1molCO2和3moH2的混合气体,反应10min后,气体的总物质的量变为原来的75%。则0~10min内,H2的平均反应速率为_______ 。
(1)铅蓄电池是最早使用的充电电池,其构造示意图如图所示,放电时的离子反应方程式为PbO2+Pb+4H++2
 =2PbSO4+2H2O。该电池的负极为
=2PbSO4+2H2O。该电池的负极为
(2)PbO2可发生如图所示的转化:

①写出“还原”反应的离子方程式:
②写出“复分解”反应的化学方程式:
(3)1400℃~1450℃时,石英、焦炭和氮气可反应生成耐高温、硬度大的化合物X,该反应的化学方程式为3SiO2+6C+2N2
 X+6CO。
X+6CO。①X的化学式为
②下列措施
a.将石英和焦炭充分混合 b.增大N2的浓度 c.将粉末状石英换成块状石英
(4)甲醇是常见的燃料电池原料,CO2催化氢化可合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。在2L容器中充入1molCO2和3moH2的混合气体,反应10min后,气体的总物质的量变为原来的75%。则0~10min内,H2的平均反应速率为
您最近一年使用:0次
2021-05-03更新
|
285次组卷
|
2卷引用:湖南省岳阳临湘市2020-2021学年高一下学期期末考试化学试题



