名校
1 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。
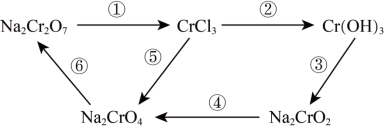
(1)Na2Cr2O7中Cr元素的化合价是______ 。
(2)浓HCl能实现反应①的转化,在浓HCl和Na2Cr2O7的反应中,Na2Cr2O7发生______ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:______ 。
(3)反应④在碱性条件下发生,反应的离子方程式为: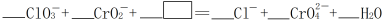 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式______ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)浓HCl能实现反应①的转化,在浓HCl和Na2Cr2O7的反应中,Na2Cr2O7发生
(3)反应④在碱性条件下发生,反应的离子方程式为:
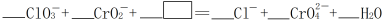 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
2 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。

(1)Na2Cr2O7中Cr元素的化合价是___________ ,在上述转化中,Cr元素化合价不变的步骤是___________ (填序号)。
(2)下列物质中能实现反应①转化的是___________ 。(填字母)
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生___________ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:___________ 。
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:___________ 。
(4)反应④在碱性条件下发生,反应的离子方程式为: ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式___________ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)下列物质中能实现反应①转化的是
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:
(4)反应④在碱性条件下发生,反应的离子方程式为:
 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
3 . 阅读下面一段材料并回答问题。
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)制备 需要在
需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,不正确的是
的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)消毒净化 水,至少需要
水,至少需要 的质量为
的质量为_______ kg。
(5)高铁酸钠 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取:
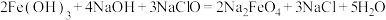
①该反应中氧化剂是_____ (用化学式表示,下同),____ 元素被氧化,还原产物为____ 。
②用双线桥法在方程式中标出电子转移的情况:_____ 。
(6)将 与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目
与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目____ 。
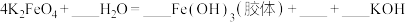
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气  通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用 胶体,可除去水中细微的悬浮物,有净水作用【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mg  ,即可达到卫生标准 ,即可达到卫生标准…… |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,不正确的是
的说法中,不正确的是a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)消毒净化
 水,至少需要
水,至少需要 的质量为
的质量为(5)高铁酸钠
 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取: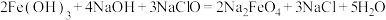
①该反应中氧化剂是
②用双线桥法在方程式中标出电子转移的情况:
(6)将
 与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目
与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目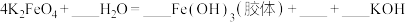
您最近一年使用:0次
4 . 氧化还原反应在工业生产、环保及科研中有广泛的应用,请根据以上信息,结合自己所掌握的化学知识,回答下列问题:
Ⅰ、氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
(1)写出CuH在氯气中燃烧的化学反应方程式:___________ 。
(2)CuH溶解在稀盐酸中生成的气体是___________ (填化学式)。
(3)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:___________ 。
Ⅱ、钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:
(4)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是___________ 。
(5)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式。___________
ClO +___________VO2++___________=___________Cl-+___________VO
+___________VO2++___________=___________Cl-+___________VO +
+
(6)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则SO 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是___________ 。
(7)在20.00 mL 0.1 mol·L-1 VO 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是___________。
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是___________。
Ⅰ、氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
(1)写出CuH在氯气中燃烧的化学反应方程式:
(2)CuH溶解在稀盐酸中生成的气体是
(3)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:
Ⅱ、钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:
(4)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是
(5)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式。
ClO
 +___________VO2++___________=___________Cl-+___________VO
+___________VO2++___________=___________Cl-+___________VO +
+(6)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则SO
 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是(7)在20.00 mL 0.1 mol·L-1 VO
 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是___________。
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是___________。| A.VO2+ | B.VO | C.V2+ | D.V |
您最近一年使用:0次
2021-08-30更新
|
498次组卷
|
4卷引用:宁夏银川一中2022届高三第一次月考理科综合化学试题
名校
5 . 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原
反应的关系”可用如图表达。
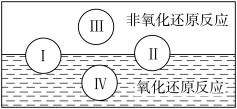
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_____________________________ ,其中水为________ 剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:___ CuO+____ NH4Cl 
____ Cu+____ CuCl2+____ N2↑+____ H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______ (填元素名称),氧化剂是________ (填化学式)。
③反应中若产生0.2mol的气体,则有________ mol的电子转移。
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原
反应的关系”可用如图表达。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:

①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是
③反应中若产生0.2mol的气体,则有
您最近一年使用:0次
2019-11-14更新
|
140次组卷
|
2卷引用:宁夏银川一中2019-2020学年高一上学期期中考试化学试题
6 . 亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液pH
用pH试纸分别测定0.1mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是__________ (用离子方程式解释),NaNO2溶液中c(HNO2)=__________ (用溶液中其它离子的浓度关系式表示)。
(2)沉淀法
取2mL0.1mol•L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两支试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。该温度下Ksp(AgNO2)=2×10-8 (mol•L-1)2; Ksp(AgCl)=1.8×10-10(mol•L-1)2,则反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=__________ (计算结果写成分数)。
(二)实验室可用如下装置(略去部分夹持仪器)备亚硝酸钠。
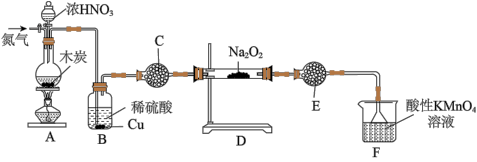
已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(3)加热装置A前,先通一段时间N2,目的是__________ 。
(4)装置A中发生反应的化学方程式为__________ ,装置B的作用是__________ 。
(5)仪器C的名称为__________ ,其中盛放的药品为__________ (填名称)。
㈠鉴别NaCl和NaNO2
(1)测定溶液pH
用pH试纸分别测定0.1mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是
(2)沉淀法
取2mL0.1mol•L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两支试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。该温度下Ksp(AgNO2)=2×10-8 (mol•L-1)2; Ksp(AgCl)=1.8×10-10(mol•L-1)2,则反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=
(二)实验室可用如下装置(略去部分夹持仪器)备亚硝酸钠。

已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(3)加热装置A前,先通一段时间N2,目的是
(4)装置A中发生反应的化学方程式为
(5)仪器C的名称为
您最近一年使用:0次
解题方法
7 . 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
(1)下列四种化合物中含铜量最高的是________ (填字母)
A.Cu5FeS4 B.CuFeS2 C.Cu2S D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为__________ 万吨.(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物.在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂﹣﹣肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O).
①该制备过程的反应方程式为_________________ .
②工业上常用的固液分离设备有_______ (填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀.如图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图:
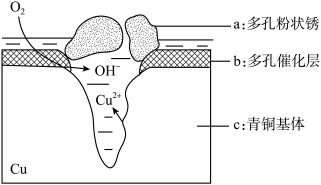
①腐蚀过程中,负极是_________ (填“a”“b”或“c”),正极反应方程式为_______________ .
②环境中的Cl﹣扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为___________________ .
(1)下列四种化合物中含铜量最高的是
A.Cu5FeS4 B.CuFeS2 C.Cu2S D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为
(3)可溶性铜盐常用于生产其它含铜化合物.在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂﹣﹣肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O).
①该制备过程的反应方程式为
②工业上常用的固液分离设备有
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀.如图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图:

①腐蚀过程中,负极是
②环境中的Cl﹣扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为
您最近一年使用:0次



