名校
1 . 含氯化合物在生产生活中具有重要用途,不同价态的含氯化合物在适当条件下可以相互转化。回答下列问题:
(1)氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺( 、
、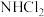 和
和 )等。
)等。
①氯胺作饮用水消毒剂是因为其与水反应生成了具有强烈杀菌作用的物质A。该物质(A)属于________ (填“强酸”或“弱酸”);其中二氯胺与水反应的化学方程式为_________________________________________ 。
②将
 通入足量
通入足量 溶液中,
溶液中, 被氧化为
被氧化为 ,则反应中转移电子的数目为
,则反应中转移电子的数目为________  。
。
(2) 有强氧化性,在强碱性介质中,
有强氧化性,在强碱性介质中, 与
与 反应生成紫红色高铁酸钾(
反应生成紫红色高铁酸钾( )溶液,
)溶液, 是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为
是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为________ 。
(3)把 溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为
溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为________________________________________________ 。
(4)二氧化氯( )气体是高效低毒的消毒剂。
)气体是高效低毒的消毒剂。 的稳定性差,因此常将其制成
的稳定性差,因此常将其制成 固体便于运输和贮存,其制备方法:将
固体便于运输和贮存,其制备方法:将 通入含
通入含 的
的 溶液中。该反应的化学方程式
溶液中。该反应的化学方程式_________________ 。
(1)氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(
 、
、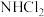 和
和 )等。
)等。①氯胺作饮用水消毒剂是因为其与水反应生成了具有强烈杀菌作用的物质A。该物质(A)属于
②将

 通入足量
通入足量 溶液中,
溶液中, 被氧化为
被氧化为 ,则反应中转移电子的数目为
,则反应中转移电子的数目为 。
。(2)
 有强氧化性,在强碱性介质中,
有强氧化性,在强碱性介质中, 与
与 反应生成紫红色高铁酸钾(
反应生成紫红色高铁酸钾( )溶液,
)溶液, 是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为
是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为(3)把
 溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为
溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为(4)二氧化氯(
 )气体是高效低毒的消毒剂。
)气体是高效低毒的消毒剂。 的稳定性差,因此常将其制成
的稳定性差,因此常将其制成 固体便于运输和贮存,其制备方法:将
固体便于运输和贮存,其制备方法:将 通入含
通入含 的
的 溶液中。该反应的化学方程式
溶液中。该反应的化学方程式
您最近一年使用:0次
解题方法
2 . N、O、Na、S、Cl的单质及其化合物在工农业生产中用途广泛,回答下列问题:
(1) 是一种淡黄色固体,其与
是一种淡黄色固体,其与 反应的化学方程式为
反应的化学方程式为_______ ,由该反应原理可知 的一种用途为
的一种用途为_______ 。
(2)大苏打( )具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量
)具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量 充分反应。取少量反应后的浸取液,滴入
充分反应。取少量反应后的浸取液,滴入 溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。
溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。 和
和 的反应中,二者的物质的量之比为
的反应中,二者的物质的量之比为_______ 。
(3)氮化钠(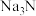 )是一种红色固体,常用作炸药及化学分析试剂。
)是一种红色固体,常用作炸药及化学分析试剂。
①当温度超过150℃时,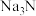 即分解为金属钠和氮气,对应的化学方程式为
即分解为金属钠和氮气,对应的化学方程式为_______ 。
②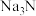 与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为
与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为_______ (填序号)。
A.湿润的淀粉-KI试纸 B.湿润的红色石蕊试纸 C.湿润的酚酞试纸
(4)氯及其化合物是重要的化工原料,在疫情防控、污水处理等方面发挥重要的作用。
①NaClO溶液能有效地灭杀新冠病毒,常用于环境的消毒,工业上制备NaClO溶液的化学方程式为_______ 。
②氨氮废水的处理是当前科学研究的热点问题之一,工业上常用 将酸性氨氮废水中
将酸性氨氮废水中 转化为无毒无害的气体和水,发生反应的离子方程式是
转化为无毒无害的气体和水,发生反应的离子方程式是_______ 。
(1)
 是一种淡黄色固体,其与
是一种淡黄色固体,其与 反应的化学方程式为
反应的化学方程式为 的一种用途为
的一种用途为(2)大苏打(
 )具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量
)具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量 充分反应。取少量反应后的浸取液,滴入
充分反应。取少量反应后的浸取液,滴入 溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。
溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。 和
和 的反应中,二者的物质的量之比为
的反应中,二者的物质的量之比为(3)氮化钠(
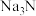 )是一种红色固体,常用作炸药及化学分析试剂。
)是一种红色固体,常用作炸药及化学分析试剂。①当温度超过150℃时,
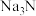 即分解为金属钠和氮气,对应的化学方程式为
即分解为金属钠和氮气,对应的化学方程式为②
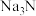 与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为
与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为A.湿润的淀粉-KI试纸 B.湿润的红色石蕊试纸 C.湿润的酚酞试纸
(4)氯及其化合物是重要的化工原料,在疫情防控、污水处理等方面发挥重要的作用。
①NaClO溶液能有效地灭杀新冠病毒,常用于环境的消毒,工业上制备NaClO溶液的化学方程式为
②氨氮废水的处理是当前科学研究的热点问题之一,工业上常用
 将酸性氨氮废水中
将酸性氨氮废水中 转化为无毒无害的气体和水,发生反应的离子方程式是
转化为无毒无害的气体和水,发生反应的离子方程式是
您最近一年使用:0次
名校
解题方法
3 . 硝酸是用途广泛的重要化工原料,自然乳和化工生产中合成硝酸各物质转化关系如下图所示,请结合你所学的知识回答以下问题:
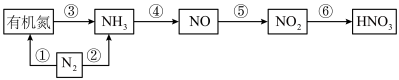
(1)上图①~⑥各步转化中,属于氮的固定的是_______ (填序号);
(2)氨的催化氧化是工业合成硝酸的重要步骤,其化学方程式为_______ 其中氧化剂与还原剂物质的量之比为_______ ;
(3)为提高NO→ 的转化率,可采取的措施是
的转化率,可采取的措施是_______ ;
(4)工业制硝酸时含有NO、 等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和
等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为_______ ;

(1)上图①~⑥各步转化中,属于氮的固定的是
(2)氨的催化氧化是工业合成硝酸的重要步骤,其化学方程式为
(3)为提高NO→
 的转化率,可采取的措施是
的转化率,可采取的措施是(4)工业制硝酸时含有NO、
 等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和
等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
您最近一年使用:0次
4 . 元素化合物在化工生产和环境科学中有着重要的用途。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为____ 、____ 、____ 。
(2)自然界中Cr主要以+3价和+6价形式存在。 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:____ 。
(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:____ 。
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+____ Br- (填“>”或“<”)。
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈____ 色,写出该反应的离子方程式____ 。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为
(2)自然界中Cr主要以+3价和+6价形式存在。
 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈
您最近一年使用:0次
名校
5 .  在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分 )粉碎后,与KOH圆体混合,通入空气充分培烧,生成暗绿色(
)粉碎后,与KOH圆体混合,通入空气充分培烧,生成暗绿色( )熔融态物质;
)熔融态物质;
Ⅱ.冷却,将固体研细,用KOH溶液浸取;过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入少量 ,溶液变为紫红色,同时生成黑色固体
,溶液变为紫红色,同时生成黑色固体 。
。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得 固体。
固体。
资料: 为暗绿色固体,在强碱性溶液中稳定,在接近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
为暗绿色固体,在强碱性溶液中稳定,在接近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)写出 在实验室的一种用途
在实验室的一种用途_______ ;
(2)Ⅰ中,粉碎软锰矿的目的是_______ ;
(3)Ⅰ中,生成 的化学方程式是
的化学方程式是_______ ;
(4)Ⅱ中,浸取时用KOH溶液的原因是_______ ;
(5)Ⅲ中, 和
和 在溶液中反应的离子方程式是
在溶液中反应的离子方程式是_______ ;
 在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
在实验室和工业上均有重要应用,其工业制备的部分工艺如下:Ⅰ.将软锰矿(主要成分
 )粉碎后,与KOH圆体混合,通入空气充分培烧,生成暗绿色(
)粉碎后,与KOH圆体混合,通入空气充分培烧,生成暗绿色( )熔融态物质;
)熔融态物质;Ⅱ.冷却,将固体研细,用KOH溶液浸取;过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入少量
 ,溶液变为紫红色,同时生成黑色固体
,溶液变为紫红色,同时生成黑色固体 。
。Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得
 固体。
固体。资料:
 为暗绿色固体,在强碱性溶液中稳定,在接近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
为暗绿色固体,在强碱性溶液中稳定,在接近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。(1)写出
 在实验室的一种用途
在实验室的一种用途(2)Ⅰ中,粉碎软锰矿的目的是
(3)Ⅰ中,生成
 的化学方程式是
的化学方程式是(4)Ⅱ中,浸取时用KOH溶液的原因是
(5)Ⅲ中,
 和
和 在溶液中反应的离子方程式是
在溶液中反应的离子方程式是
您最近一年使用:0次
6 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
_____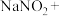 _____
_____ _____
_____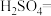 _____
_____ _____
_____ _____
_____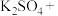 _____
_____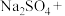 _____
_____
(1)请配平上述化学方程式。____________________
(2)从物质分类角度来看, 属于
属于________ (填字母)。
a.酸 b.酸式盐 c.正盐 d.碱
(3)上述反应的还原剂为________ (填化学式),氧化剂与还原剂的物质的量之比为________ 。
(4)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学方程式,并用单线桥表示其电子转移的方向和数目:_____________________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_____
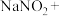 _____
_____ _____
_____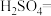 _____
_____ _____
_____ _____
_____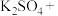 _____
_____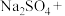 _____
_____
(1)请配平上述化学方程式。
(2)从物质分类角度来看,
 属于
属于a.酸 b.酸式盐 c.正盐 d.碱
(3)上述反应的还原剂为
(4)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。A. |
B. |
C.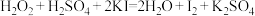 |
D. |
您最近一年使用:0次
名校
7 . 下表为元素周期表的一部分,请回答有关问题:
(1)已知元素⑩的一种核素,其中子数为45,用原子符号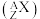 表示该核素为
表示该核素为_______ 。
(2)由元素②和④形成的三核分子的结构式为_______ 。
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程_______ 。
(4)由上述元素④和⑤构成的淡黄色固体,该化合物所含的化学键类型为_______ (填“离子键”、“极性键”或“非极性键”),④和⑦的氢化物沸点较高的是_______ (填化学式)。
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是_______ (用离子符号表示);元素⑨的最高价氧化物的水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(6)元素⑧的对应元素符号为Y,若在一定条件下,Y单质能够与硫反应生成一种用途广泛的硫化剂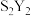 。该硫化剂
。该硫化剂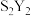 与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液提色的无色气体,则该反应的化学方程式是
与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液提色的无色气体,则该反应的化学方程式是_______ (元素Y请用具体元素符号表示)。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(1)已知元素⑩的一种核素,其中子数为45,用原子符号
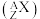 表示该核素为
表示该核素为(2)由元素②和④形成的三核分子的结构式为
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程
(4)由上述元素④和⑤构成的淡黄色固体,该化合物所含的化学键类型为
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是
(6)元素⑧的对应元素符号为Y,若在一定条件下,Y单质能够与硫反应生成一种用途广泛的硫化剂
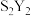 。该硫化剂
。该硫化剂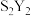 与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液提色的无色气体,则该反应的化学方程式是
与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液提色的无色气体,则该反应的化学方程式是
您最近一年使用:0次
8 . 氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应: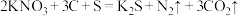 。其中被氧化的元素是
。其中被氧化的元素是___________ ,还原产物是___________ 。
(2)汽车尾气中存在CO、 、NO、
、NO、 四种气体,据此写出一个完整的化学方程式:2
四种气体,据此写出一个完整的化学方程式:2___________ 
___________ 。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:
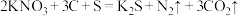 。其中被氧化的元素是
。其中被氧化的元素是(2)汽车尾气中存在CO、
 、NO、
、NO、 四种气体,据此写出一个完整的化学方程式:2
四种气体,据此写出一个完整的化学方程式:2
您最近一年使用:0次
9 . 钠及其化合物在自然界广泛存在,并有重要用途。
(1)写出过氧化钠中阴离子的电子式:_______ 。
(2)把一定量过氧化钠和未知量碳酸氢钠混合物放置在密闭体系中,充分加热后排出气体,固体残留物中一定含有的物质是_______ (填化学式)。
(3)熔融态的过氧化钠是非常好的氧化剂,可用于工业上氧化FeSO4制高铁酸钠(Na2FeO4)(称为干法制备),干法制备中每1mol FeSO4参加反应转移4mol电子,产物中还有氧气生成。写出干法制取高铁酸钠的化学方程式:_______ 。
(4)将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。实验小组对该白色物质进行如下探究:
【提出假设】假设1:白色物质是Na2O;
假设2:白色物质是Na2CO3;
假设3:白色物质是Na2O和Na2CO3的混合物。
该小组对燃烧后的白色产物进行如下探究:
【思考与交流】
①通过方案1和方案2的实验,上述三个假设中,_______ 成立。钠在二氧化碳中燃烧的化学方程式为_______ 。
②有同学认为白色物质可能是氢氧化钠,你是否同意他的观点,简述理由:_______ 。
(1)写出过氧化钠中阴离子的电子式:
(2)把一定量过氧化钠和未知量碳酸氢钠混合物放置在密闭体系中,充分加热后排出气体,固体残留物中一定含有的物质是
(3)熔融态的过氧化钠是非常好的氧化剂,可用于工业上氧化FeSO4制高铁酸钠(Na2FeO4)(称为干法制备),干法制备中每1mol FeSO4参加反应转移4mol电子,产物中还有氧气生成。写出干法制取高铁酸钠的化学方程式:
(4)将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。实验小组对该白色物质进行如下探究:
【提出假设】假设1:白色物质是Na2O;
假设2:白色物质是Na2CO3;
假设3:白色物质是Na2O和Na2CO3的混合物。
该小组对燃烧后的白色产物进行如下探究:
| 实验操作 | 实验现象 | 结论 | |
| 方案一 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞溶液 | 溶液变成红色 | 白色物质为Na2O |
| 方案二 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CuCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞溶液 | 无明显现象 |
【思考与交流】
①通过方案1和方案2的实验,上述三个假设中,
②有同学认为白色物质可能是氢氧化钠,你是否同意他的观点,简述理由:
您最近一年使用:0次
10 . 氧化还原反应是一类重要的反应,在工农业生产、生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生反应
 ,其中被氧化的元素是
,其中被氧化的元素是___________ ,还原产物是___________ (填化学式)。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有 的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为
的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为 (未配平)
(未配平)
①产物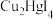 中,
中, 元素显
元素显___________ 价。(反应前后 元素均为
元素均为 价)
价)
②配平并用双线桥法标出上述反应电子转移的方向和数目___________ 。
③上述反应中,当有 参与反应时,转移电子
参与反应时,转移电子___________  。
。
(3)自来水中的 会对人类健康产生危害。为了降低自来水中
会对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出两种方案。
的浓度,某研究人员提出两种方案。
①方案a:微碱性条件下用 还原
还原 ,产物为
,产物为 。生成
。生成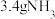 同时会生成
同时会生成___________  。
。
②方案 ;碱性条件下用
;碱性条件下用 粉还原
粉还原 ,产物是
,产物是 ,完成并配平下列方程式:
,完成并配平下列方程式:___________

(1)火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生反应

 ,其中被氧化的元素是
,其中被氧化的元素是(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有
 的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为
的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为 (未配平)
(未配平)①产物
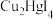 中,
中, 元素显
元素显 元素均为
元素均为 价)
价)②配平并用双线桥法标出上述反应电子转移的方向和数目
③上述反应中,当有
 参与反应时,转移电子
参与反应时,转移电子 。
。(3)自来水中的
 会对人类健康产生危害。为了降低自来水中
会对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出两种方案。
的浓度,某研究人员提出两种方案。①方案a:微碱性条件下用
 还原
还原 ,产物为
,产物为 。生成
。生成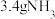 同时会生成
同时会生成 。
。②方案
 ;碱性条件下用
;碱性条件下用 粉还原
粉还原 ,产物是
,产物是 ,完成并配平下列方程式:
,完成并配平下列方程式:
您最近一年使用:0次



