名校
解题方法
1 . 以铁镍合金(含少量铜)为原料,生产电极材粗 的部分工艺流程如下:
的部分工艺流程如下:

已知:常温下,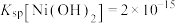 ,
,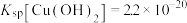 ,
,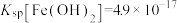 ,
,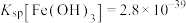 。
。
回答下列问题:
(1)基态Ni原子价层电子轨道表示式是_______ ;Cu原子位于周期表中_______ 区。
(2)“酸溶”时Ni转化为 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是_______ 。
(3)“氧化”时 的作用是(用离子方程式表示)
的作用是(用离子方程式表示)_______ 。
(4)“除铜”时若选用NaOH溶液,会导致部分 也产生沉淀,当常温时溶液中
也产生沉淀,当常温时溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中
_______ 。
(5)“沉镍”时得到碳酸镍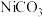 沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式是
,该反应的化学方程式是_______ 。
(6)金属镍的配合物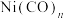 用途广泛,其中配体CO与
用途广泛,其中配体CO与 结构相似,CO分子内σ键与π键个数之比为
结构相似,CO分子内σ键与π键个数之比为_______ 。
 的部分工艺流程如下:
的部分工艺流程如下:
已知:常温下,
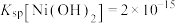 ,
,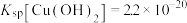 ,
,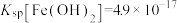 ,
,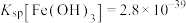 。
。回答下列问题:
(1)基态Ni原子价层电子轨道表示式是
(2)“酸溶”时Ni转化为
 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是(3)“氧化”时
 的作用是(用离子方程式表示)
的作用是(用离子方程式表示)(4)“除铜”时若选用NaOH溶液,会导致部分
 也产生沉淀,当常温时溶液中
也产生沉淀,当常温时溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中
(5)“沉镍”时得到碳酸镍
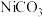 沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式是
,该反应的化学方程式是(6)金属镍的配合物
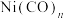 用途广泛,其中配体CO与
用途广泛,其中配体CO与 结构相似,CO分子内σ键与π键个数之比为
结构相似,CO分子内σ键与π键个数之比为
您最近半年使用:0次
名校
2 . 含氯化合物在生产生活中具有重要用途,不同价态的含氯化合物在适当条件下可以相互转化。回答下列问题:
(1)氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺( 、
、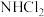 和
和 )等。
)等。
①氯胺作饮用水消毒剂是因为其与水反应生成了具有强烈杀菌作用的物质A。该物质(A)属于________ (填“强酸”或“弱酸”);其中二氯胺与水反应的化学方程式为_________________________________________ 。
②将
 通入足量
通入足量 溶液中,
溶液中, 被氧化为
被氧化为 ,则反应中转移电子的数目为
,则反应中转移电子的数目为________  。
。
(2) 有强氧化性,在强碱性介质中,
有强氧化性,在强碱性介质中, 与
与 反应生成紫红色高铁酸钾(
反应生成紫红色高铁酸钾( )溶液,
)溶液, 是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为
是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为________ 。
(3)把 溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为
溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为________________________________________________ 。
(4)二氧化氯( )气体是高效低毒的消毒剂。
)气体是高效低毒的消毒剂。 的稳定性差,因此常将其制成
的稳定性差,因此常将其制成 固体便于运输和贮存,其制备方法:将
固体便于运输和贮存,其制备方法:将 通入含
通入含 的
的 溶液中。该反应的化学方程式
溶液中。该反应的化学方程式_________________ 。
(1)氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(
 、
、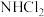 和
和 )等。
)等。①氯胺作饮用水消毒剂是因为其与水反应生成了具有强烈杀菌作用的物质A。该物质(A)属于
②将

 通入足量
通入足量 溶液中,
溶液中, 被氧化为
被氧化为 ,则反应中转移电子的数目为
,则反应中转移电子的数目为 。
。(2)
 有强氧化性,在强碱性介质中,
有强氧化性,在强碱性介质中, 与
与 反应生成紫红色高铁酸钾(
反应生成紫红色高铁酸钾( )溶液,
)溶液, 是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为
是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为(3)把
 溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为
溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为(4)二氧化氯(
 )气体是高效低毒的消毒剂。
)气体是高效低毒的消毒剂。 的稳定性差,因此常将其制成
的稳定性差,因此常将其制成 固体便于运输和贮存,其制备方法:将
固体便于运输和贮存,其制备方法:将 通入含
通入含 的
的 溶液中。该反应的化学方程式
溶液中。该反应的化学方程式
您最近半年使用:0次
名校
3 . Na2O2用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备Na2O2并检验其纯度的实验流程如图所示。

回答下列问题:
(1)生成Na2O2的化学方程式为___________ 。
(2)样液中加入MnO2后产生一种无色无味的气体单质,该气体的名称为___________ 。
(3)已知白色沉淀为BaCO3,生成该沉淀的化学方程式是___________ ,为防止Na2O2样品中含有的杂质生成需对空气进行预处理,预处理的措施是___________ 。
(4)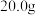 Na2O2样品可消耗
Na2O2样品可消耗 的BaCl2溶液
的BaCl2溶液 ,该样品的纯度为
,该样品的纯度为________ 。

回答下列问题:
(1)生成Na2O2的化学方程式为
(2)样液中加入MnO2后产生一种无色无味的气体单质,该气体的名称为
(3)已知白色沉淀为BaCO3,生成该沉淀的化学方程式是
(4)
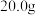 Na2O2样品可消耗
Na2O2样品可消耗 的BaCl2溶液
的BaCl2溶液 ,该样品的纯度为
,该样品的纯度为
您最近半年使用:0次
2023-08-10更新
|
236次组卷
|
6卷引用:陕西省西安市鄠邑区2023-2024学年高一上学期期中质量检测化学试题
解题方法
4 . N、O、Na、S、Cl的单质及其化合物在工农业生产中用途广泛,回答下列问题:
(1) 是一种淡黄色固体,其与
是一种淡黄色固体,其与 反应的化学方程式为
反应的化学方程式为_______ ,由该反应原理可知 的一种用途为
的一种用途为_______ 。
(2)大苏打( )具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量
)具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量 充分反应。取少量反应后的浸取液,滴入
充分反应。取少量反应后的浸取液,滴入 溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。
溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。 和
和 的反应中,二者的物质的量之比为
的反应中,二者的物质的量之比为_______ 。
(3)氮化钠(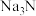 )是一种红色固体,常用作炸药及化学分析试剂。
)是一种红色固体,常用作炸药及化学分析试剂。
①当温度超过150℃时,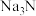 即分解为金属钠和氮气,对应的化学方程式为
即分解为金属钠和氮气,对应的化学方程式为_______ 。
②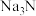 与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为
与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为_______ (填序号)。
A.湿润的淀粉-KI试纸 B.湿润的红色石蕊试纸 C.湿润的酚酞试纸
(4)氯及其化合物是重要的化工原料,在疫情防控、污水处理等方面发挥重要的作用。
①NaClO溶液能有效地灭杀新冠病毒,常用于环境的消毒,工业上制备NaClO溶液的化学方程式为_______ 。
②氨氮废水的处理是当前科学研究的热点问题之一,工业上常用 将酸性氨氮废水中
将酸性氨氮废水中 转化为无毒无害的气体和水,发生反应的离子方程式是
转化为无毒无害的气体和水,发生反应的离子方程式是_______ 。
(1)
 是一种淡黄色固体,其与
是一种淡黄色固体,其与 反应的化学方程式为
反应的化学方程式为 的一种用途为
的一种用途为(2)大苏打(
 )具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量
)具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量 充分反应。取少量反应后的浸取液,滴入
充分反应。取少量反应后的浸取液,滴入 溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。
溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。 和
和 的反应中,二者的物质的量之比为
的反应中,二者的物质的量之比为(3)氮化钠(
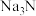 )是一种红色固体,常用作炸药及化学分析试剂。
)是一种红色固体,常用作炸药及化学分析试剂。①当温度超过150℃时,
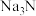 即分解为金属钠和氮气,对应的化学方程式为
即分解为金属钠和氮气,对应的化学方程式为②
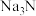 与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为
与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为A.湿润的淀粉-KI试纸 B.湿润的红色石蕊试纸 C.湿润的酚酞试纸
(4)氯及其化合物是重要的化工原料,在疫情防控、污水处理等方面发挥重要的作用。
①NaClO溶液能有效地灭杀新冠病毒,常用于环境的消毒,工业上制备NaClO溶液的化学方程式为
②氨氮废水的处理是当前科学研究的热点问题之一,工业上常用
 将酸性氨氮废水中
将酸性氨氮废水中 转化为无毒无害的气体和水,发生反应的离子方程式是
转化为无毒无害的气体和水,发生反应的离子方程式是
您最近半年使用:0次
5 . 单一盐R仅由Fe、N、O三种元素组成,某化学兴趣小组称取4.84 g盐R进行相关实验,数据和现象如下:
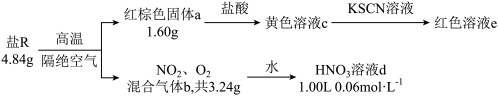
已知:①红棕色固体a为纯净物;
②混合气体b通入足量的水中,完全反应后,仅得到一种生成物;
③不考虑反应过程中的质量损失;
④ 遇KSCN溶液显血红色。
遇KSCN溶液显血红色。
回答下列问题:
(1)红棕色固体a为___________ (填化学式),其在生活中的用途有___________ (填一种即可)。
(2)盐R中Fe元素的化合价为___________ 价。
(3)写出盐R在上述条件下发生反应的化学方程式:___________ ,该反应中氧化产物与还原产物的总物质的量之比为___________ 。
(4)写出上述混合气体b通入水中发生反应的离子方程式:___________ 。
(5)研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铜加入上述所得的稀释后的溶液d中(假设溶液d很稀),恰好完全反应,无气体放出,则消耗铜的质量为___________ g。

已知:①红棕色固体a为纯净物;
②混合气体b通入足量的水中,完全反应后,仅得到一种生成物;
③不考虑反应过程中的质量损失;
④
 遇KSCN溶液显血红色。
遇KSCN溶液显血红色。回答下列问题:
(1)红棕色固体a为
(2)盐R中Fe元素的化合价为
(3)写出盐R在上述条件下发生反应的化学方程式:
(4)写出上述混合气体b通入水中发生反应的离子方程式:
(5)研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铜加入上述所得的稀释后的溶液d中(假设溶液d很稀),恰好完全反应,无气体放出,则消耗铜的质量为
您最近半年使用:0次
2023-04-18更新
|
252次组卷
|
6卷引用:陕西省西安市第八十三中学2022-2023学年高一下学期中考试化学试题
解题方法
6 . 优化的 复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是
复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如图所示。
的流程如图所示。
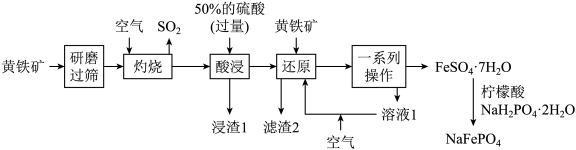
已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度 时,认为沉淀完全,
时,认为沉淀完全, )
)
回答下列问题:
(1) 中
中 元素化合价为
元素化合价为___________ 价;“研磨”的目的是___________ 。
(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为___________ (填一种)。
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为___________ (答一条即可)。
(4)“浸渣1”的主要成分是___________ (填化学式),列举出一种该物质的用途:___________ 。
(5)“还原”中 与
与 反应的离子方程式为
反应的离子方程式为___________ ;通入空气的条件下,“溶液1”可在“还原”步骤中循环利用,则通入空气的目的是___________ 。
(6)“一系列操作”包括___________ 、___________ 、过滤、洗涤和低温干燥。
 复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是
复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如图所示。
的流程如图所示。
已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度
 时,认为沉淀完全,
时,认为沉淀完全, )
)| 离子 |  |  |
 |  | 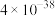 |
(1)
 中
中 元素化合价为
元素化合价为(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为
(4)“浸渣1”的主要成分是
(5)“还原”中
 与
与 反应的离子方程式为
反应的离子方程式为(6)“一系列操作”包括
您最近半年使用:0次
2023-05-07更新
|
348次组卷
|
2卷引用:陕西省榆林市2023届高三下学期第四次模拟检测理综化学试题
名校
解题方法
7 . 硝酸是用途广泛的重要化工原料,自然乳和化工生产中合成硝酸各物质转化关系如下图所示,请结合你所学的知识回答以下问题:
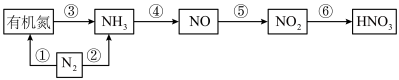
(1)上图①~⑥各步转化中,属于氮的固定的是_______ (填序号);
(2)氨的催化氧化是工业合成硝酸的重要步骤,其化学方程式为_______ 其中氧化剂与还原剂物质的量之比为_______ ;
(3)为提高NO→ 的转化率,可采取的措施是
的转化率,可采取的措施是_______ ;
(4)工业制硝酸时含有NO、 等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和
等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为_______ ;

(1)上图①~⑥各步转化中,属于氮的固定的是
(2)氨的催化氧化是工业合成硝酸的重要步骤,其化学方程式为
(3)为提高NO→
 的转化率,可采取的措施是
的转化率,可采取的措施是(4)工业制硝酸时含有NO、
 等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和
等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
您最近半年使用:0次
名校
解题方法
8 . 草酸(H2C2O4)用途广泛,是一种易溶于水的二元有机弱酸,具有还原性,为探究草酸被氧化的速率问题,高二化学小组进行如下实验:
Ⅰ.探究H2C2O4与KMnO4溶液反应
(1)为探究外界条件对反应速率的影响,阳阳进行了如下实验:
对比实验_______ (填实验编号),可探究草酸浓度对反应速率的影响;实验测得t3< t2,由此得出的结论是_______ 。
Ⅱ.探究H2C2O4与 溶液反应
溶液反应
查阅资料:H2C2O4与 溶液反应很慢,需数月时间才能完成。依据此资料,阳阳设计如下实验证实了这一点。
溶液反应很慢,需数月时间才能完成。依据此资料,阳阳设计如下实验证实了这一点。
(2)H2C2O4与 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
(3)实验Ⅳ的目的是:_______ 。
(4)对比实验Ⅱ、Ⅲ、Ⅳ,可得出的结论是_______ 。
Ⅰ.探究H2C2O4与KMnO4溶液反应
(1)为探究外界条件对反应速率的影响,阳阳进行了如下实验:
| 实验编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至无色所需时间/min | |||
| 0.01mol/L H2C2O4溶液 | 0.01mol/L KMnO4溶液 | 3.0mol/L稀硫酸 | 水 | 温度/℃ | ||
| 1 | 8.0 | 2.0 | 2.0 | 3.0 | 20 | t1 |
| 2 | 6.0 | 2.0 | 2.0 | 5.0 | 20 | t2 |
| 3 | 6.0 | 2.0 | 2.0 | 5.0 | 30 | t3 |
| 4 | 5.0 | 2.0 | 2.0 | 5.0 | 30 | t4 |
Ⅱ.探究H2C2O4与
 溶液反应
溶液反应查阅资料:H2C2O4与
 溶液反应很慢,需数月时间才能完成。依据此资料,阳阳设计如下实验证实了这一点。
溶液反应很慢,需数月时间才能完成。依据此资料,阳阳设计如下实验证实了这一点。| 实验Ⅱ | 实验Ⅲ | 实验Ⅳ | |
| 实验操作 | 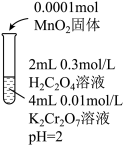 | 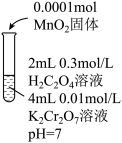 | 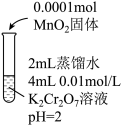 |
| 实验现象 | 6min后固体完全溶解,溶液橙色变浅,温度不变 | 6min后固体未溶解,溶液颜色无明显变化 | 6min后固体未溶解,溶液颜色无明显变化 |
 溶液反应的离子方程式为
溶液反应的离子方程式为(3)实验Ⅳ的目的是:
(4)对比实验Ⅱ、Ⅲ、Ⅳ,可得出的结论是
您最近半年使用:0次
9 . 元素化合物在化工生产和环境科学中有着重要的用途。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为____ 、____ 、____ 。
(2)自然界中Cr主要以+3价和+6价形式存在。 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:____ 。
(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:____ 。
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+____ Br- (填“>”或“<”)。
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈____ 色,写出该反应的离子方程式____ 。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为
(2)自然界中Cr主要以+3价和+6价形式存在。
 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈
您最近半年使用:0次
10 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
_____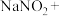 _____
_____ _____
_____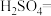 _____
_____ _____
_____ _____
_____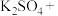 _____
_____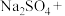 _____
_____
(1)请配平上述化学方程式。____________________
(2)从物质分类角度来看, 属于
属于________ (填字母)。
a.酸 b.酸式盐 c.正盐 d.碱
(3)上述反应的还原剂为________ (填化学式),氧化剂与还原剂的物质的量之比为________ 。
(4)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学方程式,并用单线桥表示其电子转移的方向和数目:_____________________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_____
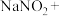 _____
_____ _____
_____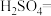 _____
_____ _____
_____ _____
_____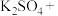 _____
_____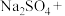 _____
_____
(1)请配平上述化学方程式。
(2)从物质分类角度来看,
 属于
属于a.酸 b.酸式盐 c.正盐 d.碱
(3)上述反应的还原剂为
(4)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。A. |
B. |
C.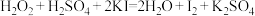 |
D. |
您最近半年使用:0次



