23-24高一上·湖北武汉·阶段练习
1 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
(2)我国从2000年起逐步用 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为___________ 。
(5)请完成该过程的化学方程式并配平。
______ _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) ___________
若反应生成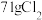 ,被氧化的HCl质量为
,被氧化的HCl质量为___________ 。
(6)已知氧化性: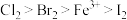 ,则:
,则:
① 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: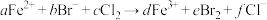 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是___________ 。
A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
② 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为___________ 。
(7)实验室用下列方法均可制取氯气
①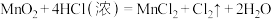
②
③
④
若各反应转移的电子数相同,①②③④生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、
 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为(5)请完成该过程的化学方程式并配平。
______
 _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) 若反应生成
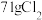 ,被氧化的HCl质量为
,被氧化的HCl质量为(6)已知氧化性:
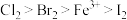 ,则:
,则:①
 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: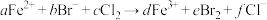 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
②
 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为(7)实验室用下列方法均可制取氯气
①
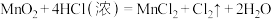
②

③

④

若各反应转移的电子数相同,①②③④生成的氯气质量比为
您最近半年使用:0次
2023-10-11更新
|
779次组卷
|
3卷引用:结构与性质
名校
2 . 阅读下面一段材料并回答问题。
(1)K2FeO4中铁元素的化合价为___________ 。
(2)制备K2FeO4需要在___________ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于K2FeO4的说法中,不正确的是___________ 。
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整:___________ 。
4K2FeO4+口H2O=口Fe(OH)3(胶体)+口__________+口KOH
(5)消毒净化500m3水,至少需要K2FeO4的质量为___________ kg。[M(K2FeO4)=198g/mol]
| 高铁酸钾使用说明书 【化学式】K2FeO4 【性状]暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气 K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准…… |
(2)制备K2FeO4需要在
(3)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整:
4K2FeO4+口H2O=口Fe(OH)3(胶体)+口__________+口KOH
(5)消毒净化500m3水,至少需要K2FeO4的质量为
您最近半年使用:0次
2024-01-12更新
|
161次组卷
|
4卷引用:北京师范大学2023--2024学年附属实验中学高一上学期化学12月统练
3 . 溴及其化合物在医药、农药、染料、阻燃剂等领域有广泛的用途。利用空气吹出法从海水(弱碱性)中提取溴的流程如图。

已知:溴单质的沸点为58.5℃。
(1)溴元素在元素周期表中的位置是_______ 。
(2)“吹出塔”中利用了溴的_______ 性。
(3)“吸收塔”中发生反应的离子方程式为_______ 。
(4)“蒸馏塔”中温度应控制在_______ (填序号)。
A.40~50℃
B.70~80℃
C.100℃以上
(5)物质A_______ (填化学式)可以循环利用,降低成本。
(6)探究“氧化”的适宜条件,测得不同条件下溶液中Br2的含量如图。
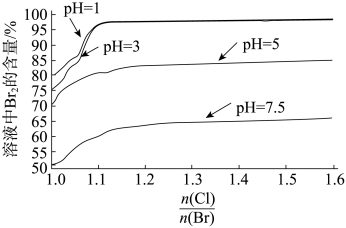
注: 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。
①“氧化”的适宜条件为_______ 。
②用离子方程式说明pH=7.5时溶液中Br2的含量较低的原因:_______ 。

已知:溴单质的沸点为58.5℃。
(1)溴元素在元素周期表中的位置是
(2)“吹出塔”中利用了溴的
(3)“吸收塔”中发生反应的离子方程式为
(4)“蒸馏塔”中温度应控制在
A.40~50℃
B.70~80℃
C.100℃以上
(5)物质A
(6)探究“氧化”的适宜条件,测得不同条件下溶液中Br2的含量如图。

注:
 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。①“氧化”的适宜条件为
②用离子方程式说明pH=7.5时溶液中Br2的含量较低的原因:
您最近半年使用:0次
2022-07-07更新
|
170次组卷
|
2卷引用:北京市朝阳区2020-2021学年高一下学期期末化学试题
21-22高三上·山东·阶段练习
名校
解题方法
4 . 重铬酸钠在工业生产上具有广泛用途。一种以铬铁矿(含FeCr2O4及少量Al2O3、SiO2等)为原料制备Na2Cr2O7的工艺流程如下:
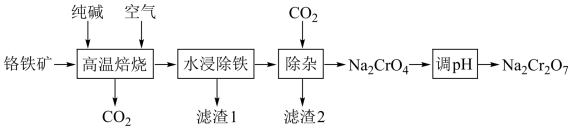
已知滤渣1为Fe2O3。下列说法错误的是

已知滤渣1为Fe2O3。下列说法错误的是
| A.流程中可循环使用的物质有CO2 |
| B.滤渣2的成分是Al(OH)3和H2SiO3 |
| C.“调pH”是向溶液中加NaOH使pH增大,促进氧化还原反应进行 |
D.“高温焙烧"发生的主要反应为4FeCr2O4+7O2+8Na2CO3 2Fe2O3+8Na2CrO4+8CO2 2Fe2O3+8Na2CrO4+8CO2 |
您最近半年使用:0次
2021-12-26更新
|
600次组卷
|
6卷引用:一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)山东省普通高中名校2021-2022学年高三上学期12月大联考化学试题(已下线)解密11 化学实验(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)重庆育才中学2021-2022高三下学期入学考试化学试题(已下线)考点50 物质的分离、提纯和检验-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
5 . 中国地质科学院、矿产综合利用研究所的研究员对安徽某矿山富含的铜多金属矿的综合利用进行了研究。从铜多金属矿石(主要含 、FeS、CaS、
、FeS、CaS、 和
和 )中综合回收金属钪的工艺流程如下:
)中综合回收金属钪的工艺流程如下:

已知:①“萃取”时发生反应:
 。
。
②常温下,“萃取”前溶液中 ,
,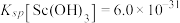
请回答下列问题:
(1)“煅烧”所得尾气的一种工业用途为___________ 。
(2)滤渣I的主要成分为___________ ;滤渣II的主要成分的电子式为___________ 。
(3)“煅烧”时FeS发生反应的化学方程式为___________ 。
(4)“还原”工序的目的为___________ 。
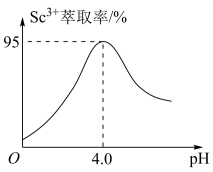
(5)“萃取”过程中有机试剂的 萃取率与溶液pH的关系如下图。当pH大于4.0时随着pH增大
萃取率与溶液pH的关系如下图。当pH大于4.0时随着pH增大 萃取率减小的原因为
萃取率减小的原因为___________ 。
(6)“沉铳”过程中发生反应的离子方程式为___________ 。
 、FeS、CaS、
、FeS、CaS、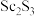 和
和 )中综合回收金属钪的工艺流程如下:
)中综合回收金属钪的工艺流程如下:
已知:①“萃取”时发生反应:

 。
。②常温下,“萃取”前溶液中
 ,
,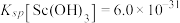
请回答下列问题:
(1)“煅烧”所得尾气的一种工业用途为
(2)滤渣I的主要成分为
(3)“煅烧”时FeS发生反应的化学方程式为
(4)“还原”工序的目的为
(5)“萃取”过程中有机试剂的
 萃取率与溶液pH的关系如下图。当pH大于4.0时随着pH增大
萃取率与溶液pH的关系如下图。当pH大于4.0时随着pH增大 萃取率减小的原因为
萃取率减小的原因为
(6)“沉铳”过程中发生反应的离子方程式为
您最近半年使用:0次
2021·河北衡水·模拟预测
名校
解题方法
6 . 磷及其化合物在工农业生产中具有重要用途。回答下列问题:
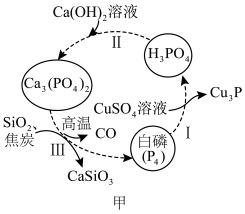
(1)如图甲所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为___________ ,过程Ⅲ的化学方程式为___________ 。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图乙所示:
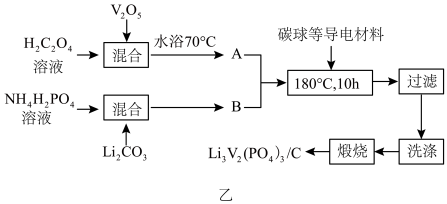
①向复合材料中加入碳单质的作用是___________ 。
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为___________ 。
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,___________ ,得到LiHCO3溶液,控温加热使LiHCO3分解形成Li2CO3沉淀,过滤、洗涤、干燥得到Li2CO3纯品。
④锂离子电池是一种二次电池。若用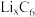 和Li3V2(PO4)3/C作电极,放电时的电池总反应为
和Li3V2(PO4)3/C作电极,放电时的电池总反应为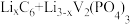 =Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
=Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为___________ 。
(1)如图甲所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图乙所示:

①向复合材料中加入碳单质的作用是
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,
④锂离子电池是一种二次电池。若用
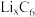 和Li3V2(PO4)3/C作电极,放电时的电池总反应为
和Li3V2(PO4)3/C作电极,放电时的电池总反应为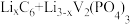 =Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
=Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
您最近半年使用:0次
2022-02-22更新
|
813次组卷
|
6卷引用:二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)河北省衡水中学2021-2022学年高三上学期五调考试化学试题(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题河北省新乐市第一中学2023-2024学年上学期高三第一次月考化学试题
名校
解题方法
7 . 金、银是生活中常见的贵重金属,用途非常广泛。工业上常利用氰化法从一种含金矿石(成分为Au、Ag、Fe2O3和其它不溶性杂质)中提取金。工艺流程如图:

已知:①Zn+ O2 +H2O=Zn(OH)2
O2 +H2O=Zn(OH)2
② Zn2+(aq)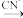 Zn(CN)2(s)
Zn(CN)2(s)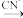 Zn(CN)
Zn(CN) (aq)
(aq)
(1)步骤2中浸出应选用_______ (填盐酸、硫酸或硝酸)。
(2)步骤4浸出的目的是将单质Au转化为 进入溶液,该反应的离子方程式为
进入溶液,该反应的离子方程式为_______ 。
(3)步骤4中为提高金的浸出速率可适当升高温度,但温度过高浸出速率反而会降低,原因是_______ 。
(4)步骤6的目的是_______ 。
(5)步骤7置换的总反应为:2Au(CN) +3Zn+4CN-+2H2O=2Au+2Zn(CN)
+3Zn+4CN-+2H2O=2Au+2Zn(CN) +ZnO
+ZnO +2H2↑
+2H2↑
①在置换过程中,为防止生成Zn(CN)2沉淀影响置换速率,应采取的措施是_______ 。
②关于步骤7,以下说法正确的是(填字母)_______ 。
a.步骤7进行前要先脱氧,否则会增加锌的用量
b.该反应最好在强酸性环境下进行
c.脱金贫液含有大量Zn2+
(6)脱金贫液(主要含有CN-)会破坏环境,可通过化学方法转化为无毒废水净化排放。碱性条件下,用NaClO将贫液中的CN-氧化成无毒的CO 和N2,该反应的离子方程式为
和N2,该反应的离子方程式为_______ 。

已知:①Zn+
 O2 +H2O=Zn(OH)2
O2 +H2O=Zn(OH)2② Zn2+(aq)
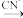 Zn(CN)2(s)
Zn(CN)2(s)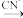 Zn(CN)
Zn(CN) (aq)
(aq)(1)步骤2中浸出应选用
(2)步骤4浸出的目的是将单质Au转化为
 进入溶液,该反应的离子方程式为
进入溶液,该反应的离子方程式为(3)步骤4中为提高金的浸出速率可适当升高温度,但温度过高浸出速率反而会降低,原因是
(4)步骤6的目的是
(5)步骤7置换的总反应为:2Au(CN)
 +3Zn+4CN-+2H2O=2Au+2Zn(CN)
+3Zn+4CN-+2H2O=2Au+2Zn(CN) +ZnO
+ZnO +2H2↑
+2H2↑①在置换过程中,为防止生成Zn(CN)2沉淀影响置换速率,应采取的措施是
②关于步骤7,以下说法正确的是(填字母)
a.步骤7进行前要先脱氧,否则会增加锌的用量
b.该反应最好在强酸性环境下进行
c.脱金贫液含有大量Zn2+
(6)脱金贫液(主要含有CN-)会破坏环境,可通过化学方法转化为无毒废水净化排放。碱性条件下,用NaClO将贫液中的CN-氧化成无毒的CO
 和N2,该反应的离子方程式为
和N2,该反应的离子方程式为
您最近半年使用:0次
2021-04-09更新
|
716次组卷
|
5卷引用:北京市首都师范大学附属中学2023-2024学年高一下学期开学化学试题
北京市首都师范大学附属中学2023-2024学年高一下学期开学化学试题北京市首都师范大学附属中学2023-2024学年高一下学期3月月考化学(选考)试题吉林省长春市普通高中2021届高三4月质量监测(三)理综化学试卷题(已下线)2021年高考化学押题预测卷(辽宁卷)(03)(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)
8 . 氧化还原反应是一类重要的化学反应,广泛存在于生产生活中。
(1)下列变化中,与氧化还原反应有关的是_______ (填字母)。
a.食物的腐败 b.钢铁的锈蚀 c.钟乳石的形成 d.燃料的燃烧
(2)汽车尾气中的CO和NO在催化剂作用下发生反应,生成CO2和N2。写出化学方程式:_______ 。
(3)FeSO4、K2FeO4是水处理中常用的物质。
①选择两种属于不同基本反应类型 的方法制取FeSO4,用离子方程式表示该方法:_______ 、_______ 。
②依据“性质决定用途”的学科观念,分析K2FeO4的性质,预测K2FeO4在处理含 的废水中的作用。简述分析过程:
的废水中的作用。简述分析过程:_______ 。
(1)下列变化中,与氧化还原反应有关的是
a.食物的腐败 b.钢铁的锈蚀 c.钟乳石的形成 d.燃料的燃烧
(2)汽车尾气中的CO和NO在催化剂作用下发生反应,生成CO2和N2。写出化学方程式:
(3)FeSO4、K2FeO4是水处理中常用的物质。
①选择两种属于
②依据“性质决定用途”的学科观念,分析K2FeO4的性质,预测K2FeO4在处理含
 的废水中的作用。简述分析过程:
的废水中的作用。简述分析过程:
您最近半年使用:0次
名校
9 . Cl2是一种重整的化工原料,在生产、生活和工业上均有很多用途。
(1)可与氢气化合制得盐酸。化学方程式为________________ 。
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为_______________ 。
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为_______________ 。其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是_____________ 。
②Ⅰ中,生成K2MnO4的化学方程式是____________ 。
③Ⅱ中,浸取时用稀KOH溶液的原因是_____________ 。
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为____________ 。
(1)可与氢气化合制得盐酸。化学方程式为
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是
②Ⅰ中,生成K2MnO4的化学方程式是
③Ⅱ中,浸取时用稀KOH溶液的原因是
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO
 +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为
您最近半年使用:0次
10 . 过氧化钙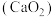 在水中能缓慢放出氧气,是一种用途广泛的供氧剂,可用于鱼塘养殖。
在水中能缓慢放出氧气,是一种用途广泛的供氧剂,可用于鱼塘养殖。
(1) 中所含化学键的类型是
中所含化学键的类型是___________ 、___________ 。
(2) 与水反应的化学方程式是
与水反应的化学方程式是___________ 。
(3)由电石渣(主要成分为氢氧化钙)制备过氧化钙可实现工业废渣的资源化,其制备流程如下:
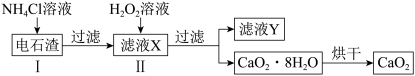
①滤液Y可循环使用,其主要溶质的质量与反应前的加入量几乎没有变化,该溶质是___________ 。解释其质量不变的原因:___________ (用化学方程式表示)。
②Ⅰ和Ⅱ的反应装置均需置于冰水浴中,解释Ⅱ中冰水浴的作用:___________ (答出一点即可)。
(4) 样品纯度测定
样品纯度测定
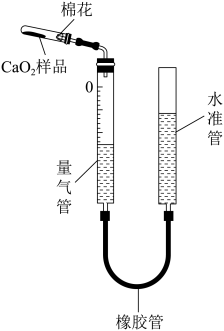
ⅰ.按上图连接装置(夹持和加热装置均略去),从水准管口加入适量水,并检查气密性;
ⅱ.准确称量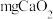 样品加入试管,并使其在试管底部均匀铺成薄层;
样品加入试管,并使其在试管底部均匀铺成薄层;
ⅲ.上下移动水准管,使水准管中液面与量气管中液面平齐;读取量气管中液面对应的刻度,记为 ;
;
ⅳ.加热发生反应: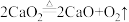 ,充分反应至不再有气体产生,停止加热,___________;再次读取量气管中液面对应的刻度,记为
,充分反应至不再有气体产生,停止加热,___________;再次读取量气管中液面对应的刻度,记为 ;
;
Ⅴ.计算样品中 的纯度。
的纯度。
①补全ⅳ中操作:___________ 。
②该实验条件下,气体摩尔体积为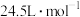 ,样品中
,样品中 的纯度为
的纯度为___________ (用质量分数表示)。
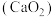 在水中能缓慢放出氧气,是一种用途广泛的供氧剂,可用于鱼塘养殖。
在水中能缓慢放出氧气,是一种用途广泛的供氧剂,可用于鱼塘养殖。(1)
 中所含化学键的类型是
中所含化学键的类型是(2)
 与水反应的化学方程式是
与水反应的化学方程式是(3)由电石渣(主要成分为氢氧化钙)制备过氧化钙可实现工业废渣的资源化,其制备流程如下:

①滤液Y可循环使用,其主要溶质的质量与反应前的加入量几乎没有变化,该溶质是
②Ⅰ和Ⅱ的反应装置均需置于冰水浴中,解释Ⅱ中冰水浴的作用:
(4)
 样品纯度测定
样品纯度测定
ⅰ.按上图连接装置(夹持和加热装置均略去),从水准管口加入适量水,并检查气密性;
ⅱ.准确称量
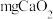 样品加入试管,并使其在试管底部均匀铺成薄层;
样品加入试管,并使其在试管底部均匀铺成薄层;ⅲ.上下移动水准管,使水准管中液面与量气管中液面平齐;读取量气管中液面对应的刻度,记为
 ;
;ⅳ.加热发生反应:
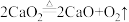 ,充分反应至不再有气体产生,停止加热,___________;再次读取量气管中液面对应的刻度,记为
,充分反应至不再有气体产生,停止加热,___________;再次读取量气管中液面对应的刻度,记为 ;
;Ⅴ.计算样品中
 的纯度。
的纯度。①补全ⅳ中操作:
②该实验条件下,气体摩尔体积为
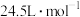 ,样品中
,样品中 的纯度为
的纯度为
您最近半年使用:0次
2021-05-18更新
|
507次组卷
|
3卷引用:北京市东城区2021届高三综合练习(二)化学试题



