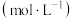名校
解题方法
1 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:
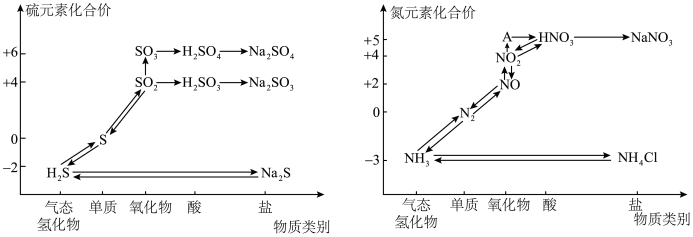
(1)根据 A 对应的化合价和物质类别,A 为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式___________ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ ,反应的离子方程式为___________ 。
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:
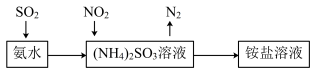
NO2 被吸收过程的离子方程式是___________ 。

(1)根据 A 对应的化合价和物质类别,A 为
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:

NO2 被吸收过程的离子方程式是
您最近半年使用:0次
名校
2 . 某铬盐厂净化含Cr(Ⅵ)废水并提取Cr2O3的一种工艺流程如图所示。
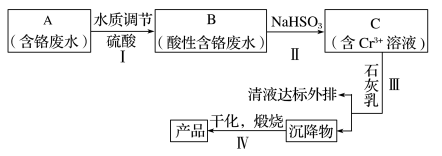
已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.8×10-39
Ksp[Fe(OH)2]=4.9×10-17
(1)步骤Ⅰ中,发生的反应为2H++2Cr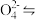 Cr2
Cr2 +H2O,B中含铬元素的离子有
+H2O,B中含铬元素的离子有_______ (填离子符号)。
(2)当清液中Cr3+的浓度≤1.5 mg·L-1时,可认为已达铬的排放标准。若测得清液的pH=5,则清液尚不符合铬的排放标准,因为此时Cr3+的浓度为_______ mg·L-1。
(3)步骤Ⅱ还可用其他物质代替NaHSO3做还原剂。
①若用FeSO4·7H2O做还原剂,反应的离子方程式为_______ ,步骤Ⅲ中参加反应的阳离子一定有_______ (填离子符号)。
②若用铁屑做还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2 )的对应关系如下表所示:
)的对应关系如下表所示:
有人认为pH=6时,c(Cr2 )变小的原因是Cr2
)变小的原因是Cr2 基本上都已转化为Cr3+。这种说法是否正确,为什么?
基本上都已转化为Cr3+。这种说法是否正确,为什么?_______ 。
③用铁屑做还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有_______ 。

已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.8×10-39
Ksp[Fe(OH)2]=4.9×10-17
(1)步骤Ⅰ中,发生的反应为2H++2Cr
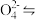 Cr2
Cr2 +H2O,B中含铬元素的离子有
+H2O,B中含铬元素的离子有(2)当清液中Cr3+的浓度≤1.5 mg·L-1时,可认为已达铬的排放标准。若测得清液的pH=5,则清液尚不符合铬的排放标准,因为此时Cr3+的浓度为
(3)步骤Ⅱ还可用其他物质代替NaHSO3做还原剂。
①若用FeSO4·7H2O做还原剂,反应的离子方程式为
②若用铁屑做还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2
 )的对应关系如下表所示:
)的对应关系如下表所示:| pH | 3 | 4 | 5 | 6 |
 | 7.02×10-21 | 7.02×10-7 | 1.25×10-3 | 2.12×10-34 |
有人认为pH=6时,c(Cr2
 )变小的原因是Cr2
)变小的原因是Cr2 基本上都已转化为Cr3+。这种说法是否正确,为什么?
基本上都已转化为Cr3+。这种说法是否正确,为什么?③用铁屑做还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有
您最近半年使用:0次
名校
解题方法
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
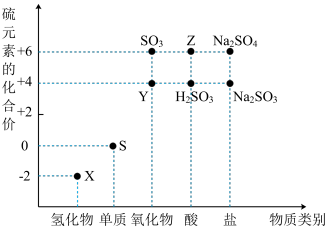
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近半年使用:0次
2021-04-25更新
|
415次组卷
|
14卷引用:湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)
湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期第一次月考化学试题沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2贵州省岑巩县第四中学2019-2020学年高一上学期期末考试化学试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)高一必修第一册第三章第2节 硫的转化 课时4 不同价态硫元素之间的转化酸雨及其防治高一必修第一册(苏教2019版)专题4 第二单元 硫及其化合物的相互转化 课时2 含硫物质之间的转化 氧化还原反应方程式的配平河北省安平中学2020-2021学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一下学期期中考试化学试题河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题江苏省盱眙中学2022-2023学年高一下学期6月阶段测试化学试题黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题
解题方法
4 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_______ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_______ 。
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:_______ 。
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2.取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:_______ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2.取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:
您最近半年使用:0次
名校
5 . 下列物质应用和所涉及的反应均正确且有对应关系的是
| 选项 | 物质应用 | 涉及反应 |
| A | 纯碱溶液浸泡锅炉水垢 |  |
| B | 硫化氢除去水中的 | 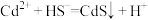 |
| C | 四氯化钛溶液制备二氧化钛水合物 | 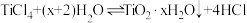 |
| D | 酸性 溶液滴定双氧水 溶液滴定双氧水 | 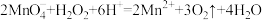 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
6 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_______ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式_______ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_______ ,反应的离子方程式为_______ 。
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:
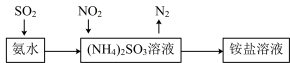
NO2被吸收过程的离子方程式是_______ 。

(1)根据A对应的化合价和物质类别,A为
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:

NO2被吸收过程的离子方程式是
您最近半年使用:0次
2021-09-07更新
|
232次组卷
|
2卷引用:湖南省长沙市长郡中学2021-2022学年高二上学期入学考试化学试题
名校
7 . 含氮化合物在工农业有着重要的用途。
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为____________ 。
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→______ (按气流方向,用小写字母表示)。
(3)请写出氨气的检验方法:____________ 。
(4)甲、乙两同学分别设计了下图装备进行喷泉实验,____________ 。
②乙同学想用乙装备在两个烧瓶同时产生喷泉,引发双喷泉的操作是:______ —______ 。
Ⅱ. 经一系列反应可以得到
经一系列反应可以得到 。
。
(5)①中, 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是____________ 。
(6)NO的检验方法是:____________ 。
Ⅲ.研究 、
、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。
(7)选择性催化还原技术(SCR)可使 与
与 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:____________ 。
(8)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应:
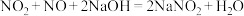 ;
; 。
。
若33.6 mL(标况下)氮氧化物(只含NO和 )与V mL0.1 mol/L NaOH溶液恰好完全反应,则
)与V mL0.1 mol/L NaOH溶液恰好完全反应,则
______ 。
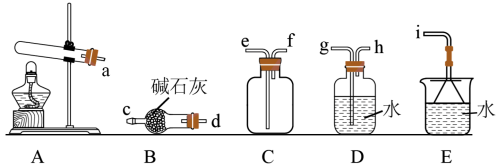
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→
(3)请写出氨气的检验方法:
(4)甲、乙两同学分别设计了下图装备进行喷泉实验,
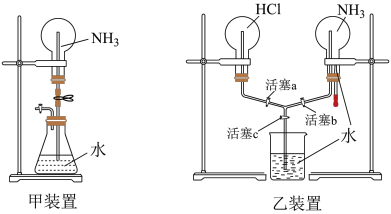
②乙同学想用乙装备在两个烧瓶同时产生喷泉,引发双喷泉的操作是:
Ⅱ.
 经一系列反应可以得到
经一系列反应可以得到 。
。
(5)①中,
 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是(6)NO的检验方法是:
Ⅲ.研究
 、
、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。(7)选择性催化还原技术(SCR)可使
 与
与 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:(8)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应:
 ;
; 。
。若33.6 mL(标况下)氮氧化物(只含NO和
 )与V mL0.1 mol/L NaOH溶液恰好完全反应,则
)与V mL0.1 mol/L NaOH溶液恰好完全反应,则
您最近半年使用:0次
名校
8 . 硫酸亚铁铵晶体又称摩尔盐,是浅蓝绿色结晶或粉末,对光敏感,在空气中逐渐风化及氧化;易溶于水,几乎不溶于乙醇。摩尔盐是一种重要的化工原料,用途十分广泛。可以作净水剂,是制取氧化铁系颜料、磁性材料、黄血盐和其他铁盐等的原料;它还可用作印染工业的媒染剂,制革工业中用于鞣革,木材工业中用作防腐剂,医药中用于治疗缺铁性贫血,农业中施用于缺铁性土壤,畜牧业中用作饲料添加剂等,还可以用于配制蓝黑墨水。以黄铁矿(主要成分为 )为原料制备摩尔盐[
)为原料制备摩尔盐[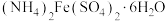 ]的工艺流程如图所示,回答下列问题:
]的工艺流程如图所示,回答下列问题:___________ 。
(2)溶液E中的溶质为___________ (填化学式)。
(3)试剂X为___________ (填化学式),写出少量该试剂在加热条件下与D的浓溶液反应的化学方程式:___________ 。
(4)由溶液E和过量X反应后,需分离溶液F和固体G,使用的玻璃仪器有烧杯、___________ 。
(5)得到摩尔盐时需在惰性气体环境下进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥,在惰性气体环境下进行该系列操作的目的是___________ 。
 )为原料制备摩尔盐[
)为原料制备摩尔盐[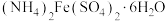 ]的工艺流程如图所示,回答下列问题:
]的工艺流程如图所示,回答下列问题:
(2)溶液E中的溶质为
(3)试剂X为
(4)由溶液E和过量X反应后,需分离溶液F和固体G,使用的玻璃仪器有烧杯、
(5)得到摩尔盐时需在惰性气体环境下进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥,在惰性气体环境下进行该系列操作的目的是
您最近半年使用:0次
名校
解题方法
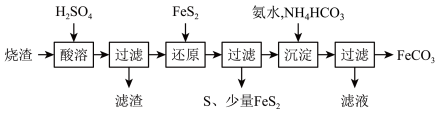
9 . 铁的化合物有广泛用途,如碳酸亚铁( )可作补血剂。利用某硫酸厂产生的烧渣(主要含
)可作补血剂。利用某硫酸厂产生的烧渣(主要含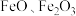 ,还有一定量的
,还有一定量的 )制备碳酸亚铁的流程如图所示:
)制备碳酸亚铁的流程如图所示:
已知:① 不溶于稀硫酸;
不溶于稀硫酸;
②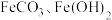 都难溶于水。
都难溶于水。
(1)加入稀硫酸溶解后得到的滤渣是_______________ (写化学式)。
(2)过滤操作需要用到的玻璃仪器有:烧杯、____________ 和____________ 。判断还原时溶液中是否含有 的试剂是
的试剂是______________ 。
(3)“还原”时,加入的 与
与 发生反应Ⅰ、Ⅱ两个氧化还原反应:
发生反应Ⅰ、Ⅱ两个氧化还原反应:
①配平反应Ⅰ的离子方程式:__________
反应Ⅰ:________ ________
________ ________
________ ________
________ ________
________ ________
________
②请写出反应Ⅱ的离子反应方程式:__________ 。
③还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
则反应Ⅰ、Ⅱ中生成 的物质的量之比为
的物质的量之比为________________ 。
(4)“沉淀”时加入的氨水不宜过量,否则生成的 中可能混有
中可能混有____________ 杂质(写出一种即可)。
 )可作补血剂。利用某硫酸厂产生的烧渣(主要含
)可作补血剂。利用某硫酸厂产生的烧渣(主要含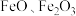 ,还有一定量的
,还有一定量的 )制备碳酸亚铁的流程如图所示:
)制备碳酸亚铁的流程如图所示:
已知:①
 不溶于稀硫酸;
不溶于稀硫酸;②
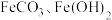 都难溶于水。
都难溶于水。(1)加入稀硫酸溶解后得到的滤渣是
(2)过滤操作需要用到的玻璃仪器有:烧杯、
 的试剂是
的试剂是(3)“还原”时,加入的
 与
与 发生反应Ⅰ、Ⅱ两个氧化还原反应:
发生反应Ⅰ、Ⅱ两个氧化还原反应:①配平反应Ⅰ的离子方程式:
反应Ⅰ:________
 ________
________ ________
________ ________
________ ________
________ ________
________②请写出反应Ⅱ的离子反应方程式:
③还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度 | |
还原前 | 还原后 | |
| 0.10 | 2.50 |
| 3.50 | 3.70 |
 的物质的量之比为
的物质的量之比为(4)“沉淀”时加入的氨水不宜过量,否则生成的
 中可能混有
中可能混有
您最近半年使用:0次
10 . 钒具有广泛用途。黏土钒矿中,钒以 、
、 、
、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及
价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、
、 。采用以下工艺流程可由黏土钒矿制备
。采用以下工艺流程可由黏土钒矿制备 。
。
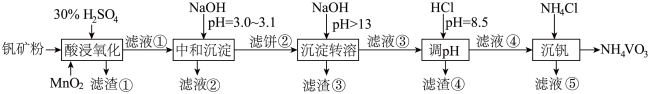
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸氧化”中, 和
和 被氧化成
被氧化成 ,同时还有
,同时还有_______ 离子被氧化。写出 转化为
转化为 反应的离子方程式
反应的离子方程式_______ 。
(2)“中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子
,随滤液②可除去金属离子 、
、 、
、 、
、_______ ,以及部分的_______ 。
(3)“沉淀转溶”中, 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是_______ 。
(4)利用上述表格数据,计算 的
的
_______ ( 完全沉淀后其浓度应小于
完全沉淀后其浓度应小于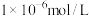 )。
)。
(5)“沉钒”中析出 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是
,其原因是_______ 。
 、
、 、
、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及
价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、
、 。采用以下工艺流程可由黏土钒矿制备
。采用以下工艺流程可由黏土钒矿制备 。
。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.0 | 9.0 | 4.7 | 10.1 |
(1)“酸浸氧化”中,
 和
和 被氧化成
被氧化成 ,同时还有
,同时还有 转化为
转化为 反应的离子方程式
反应的离子方程式(2)“中和沉淀”中,钒水解并沉淀为
 ,随滤液②可除去金属离子
,随滤液②可除去金属离子 、
、 、
、 、
、(3)“沉淀转溶”中,
 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是(4)利用上述表格数据,计算
 的
的
 完全沉淀后其浓度应小于
完全沉淀后其浓度应小于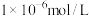 )。
)。(5)“沉钒”中析出
 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是
,其原因是
您最近半年使用:0次