解题方法
1 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_______ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_______ 。
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:_______ 。
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2.取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:_______ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2.取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_______ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式_______ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_______ ,反应的离子方程式为_______ 。
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:
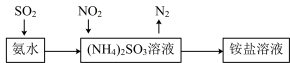
NO2被吸收过程的离子方程式是_______ 。

(1)根据A对应的化合价和物质类别,A为
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:

NO2被吸收过程的离子方程式是
您最近一年使用:0次
2021-09-07更新
|
232次组卷
|
2卷引用:湖南省长沙市长郡中学2021-2022学年高二上学期入学考试化学试题
3 . 重铬酸钠在工业生产上具有广泛用途。一种以铬铁矿(含 及少量
及少量 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下:
已知滤渣1为 下列说法错误的是
下列说法错误的是
 及少量
及少量 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下:
已知滤渣1为
 下列说法错误的是
下列说法错误的是A.“高温熔烧"发生的主要反应为 |
B.滤渣2的成分是 和 和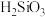 |
| C.“调pH”是向溶液中加NaOH使pH增大 |
D.流程中可循环使用的物质有 |
您最近一年使用:0次
2021-10-28更新
|
122次组卷
|
2卷引用:湖南省三湘名校教育联盟2021-2022学年高三上学期第一次大联考化学试题
名校
解题方法
4 . 高铁酸盐在污水处理,水体消杀等方面用途广泛。高铁酸钾(K2FeO4)是一种重要的高铁酸盐。某学校化学学习小组通过下列装置制备K2FeO4,回答下列问题:

已知K2FeO4的部分性质如下:
(1)仪器a的名称是_______ 。
(2)装置乙可选用下列_______ (填标号)。

(3)连接好装置乙后,需对整套装置气密性进行检查:先_______ ,再向丁中烧杯加水至没过球形干燥管,用酒精灯微热甲中圆底烧瓶,若观察到丁中产生气泡,移去酒精灯后,丁中球形干燥管中形成一段稳定水柱,则说明装置气密性良好。
(4)该装置中,以1molFeCl3为原料,完全转化为K2FeO4需要消耗KOH_______ g。
(5)从容器丙中分离得到K2FeO4粗产品,先用冷的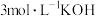 溶液洗涤,然后再用适量
溶液洗涤,然后再用适量_______ (填一常用试剂)洗涤2-3次后,最后在真空干燥箱中干燥,可得纯净的K2FeO4晶体。
(6)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,用离子方程式解释将K2FeO4投入水中达到以上净水效果的原因:_______ 。
(7)取适量K2FeO4晶体,向其中加入少量盐酸,产生大量气体,_______ (填“能”或“不能”)证明 被K2FeO4氧化了。
被K2FeO4氧化了。

已知K2FeO4的部分性质如下:
| 溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
| 稳定性 | 温度为0-5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出O2 |
(2)装置乙可选用下列

(3)连接好装置乙后,需对整套装置气密性进行检查:先
(4)该装置中,以1molFeCl3为原料,完全转化为K2FeO4需要消耗KOH
(5)从容器丙中分离得到K2FeO4粗产品,先用冷的
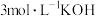 溶液洗涤,然后再用适量
溶液洗涤,然后再用适量(6)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,用离子方程式解释将K2FeO4投入水中达到以上净水效果的原因:
(7)取适量K2FeO4晶体,向其中加入少量盐酸,产生大量气体,
 被K2FeO4氧化了。
被K2FeO4氧化了。
您最近一年使用:0次
名校
解题方法
5 . 锰的重要用途是制造锰钢.一种以高铁锰矿(含MnO2、Fe2O3及少量FeO、CaO、K2O、Na2O)为原料生产金属锰的工艺流程如图:

回答下列问题:
(1)“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。
①理论上,还能被还原的成分有__ 、__ (填化学式)。
②根据表中数据,焙烧时应选择的温度为__ 。
(2)“浸出”产生“滤渣”的主要成分为___ (填化学式);该步骤中需再加入MnSO4以促进“滤渣”析出,结合化学反应原理解释其原因:___ 。
(3)“除杂”时,加入的MnO2将Fe2+氧化为Fe3+,其离子方程式为___ ;再将pH逐步调至6,Fe3+水解为Fe(OH)3,同时Fe3+与Na+、K+形成络合物沉淀。
(4)电解“净化”所得溶液(MnSO4的酸性溶液)制备Mn。
①电解时,溶液中的阳离子在阴极存在两个相互竞争的电极反应,其产物分别为Mn和__ (填化学式)。
②研究表明,加入适量的SeO2有利于Mn在电极上析出.机理为:SeO2与水反应生成的H2SeO3(二元弱酸)在阴极放电生成Se单质,该电极反应为__ ;电极上的Se对Mn2+有特殊的吸附性能,使Mn2+的电还原沉积成为主要反应。
③电解废液可在上述流程的___ 步骤中循环使用。

回答下列问题:
(1)“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。
①理论上,还能被还原的成分有
②根据表中数据,焙烧时应选择的温度为
| 还原温度/℃ | 焙烧后Mn元素在主要含锰物质中的分布/% | ||
| MnO2 | 高价锰(MnxOy) | 低价锰(MnO) | |
| 600 800 1000 1100 1200 | 40.92 10.56 5.77 痕量 痕量 | 34.76 6.63 2.70 0.46 0.30 | 24.32 82.81 91.29 98.76 97.94 |
(3)“除杂”时,加入的MnO2将Fe2+氧化为Fe3+,其离子方程式为
(4)电解“净化”所得溶液(MnSO4的酸性溶液)制备Mn。
①电解时,溶液中的阳离子在阴极存在两个相互竞争的电极反应,其产物分别为Mn和
②研究表明,加入适量的SeO2有利于Mn在电极上析出.机理为:SeO2与水反应生成的H2SeO3(二元弱酸)在阴极放电生成Se单质,该电极反应为
③电解废液可在上述流程的
您最近一年使用:0次
2021-03-19更新
|
947次组卷
|
4卷引用:湖南省长沙市第一中学2021届高三第一次模拟考试化学试题
湖南省长沙市第一中学2021届高三第一次模拟考试化学试题广东省深圳市2021届高三下学期第一次调研考试化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)第18周 周测卷-备战2022年高考化学周测与晚练(新高考专用)
6 . 草酸钴用途广泛,用于制指示剂、催化剂及有机合成中间体。利用含钴废料(主要成分为Co2O3,还含有少量的 、
、 、
、 、
、 、
、 、碳及有机物等)制取
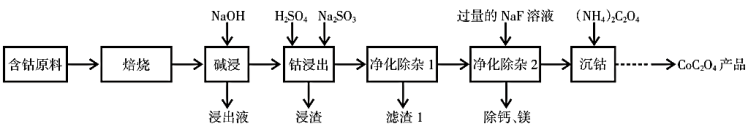
、碳及有机物等)制取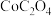 的一种工艺流程如下:
的一种工艺流程如下:
已知: 与
与 的化学性质相似。回答下列问题:
的化学性质相似。回答下列问题:
(1)“焙烧”的目的是___________ 。
(2)为提高“碱浸”效率,可采取的措施有___________ ,写出“碱浸”过程中发生的离子反应方程式___________ 。
(3)“钻浸出”过程中 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(4)“净化除杂1”过程中,先在35℃左右加入 ,其作用是
,其作用是___________ ;再升温至80℃,加入 溶液,调pH至4.7以上。
溶液,调pH至4.7以上。
(5)为测定产品的纯度,将ag产品用适当试剂转化,得到草酸铵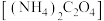 溶液。已知:
溶液。已知: 的
的 ;
; 的
的 ,
, 。
。
①常温时, 溶液pH
溶液pH___________ 7(填“大于”、“小于”或“等于”)。
②将草酸铵溶液用过量稀硫酸酸化,用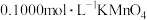 溶液滴定,测得平均消耗
溶液滴定,测得平均消耗 溶液20.00mL,则草酸钴样品的纯度为
溶液20.00mL,则草酸钴样品的纯度为___________ 。
 、
、 、
、 、
、 、
、 、碳及有机物等)制取
、碳及有机物等)制取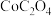 的一种工艺流程如下:
的一种工艺流程如下:
已知:
 与
与 的化学性质相似。回答下列问题:
的化学性质相似。回答下列问题:(1)“焙烧”的目的是
(2)为提高“碱浸”效率,可采取的措施有
(3)“钻浸出”过程中
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为(4)“净化除杂1”过程中,先在35℃左右加入
 ,其作用是
,其作用是 溶液,调pH至4.7以上。
溶液,调pH至4.7以上。(5)为测定产品的纯度,将ag产品用适当试剂转化,得到草酸铵
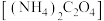 溶液。已知:
溶液。已知: 的
的 ;
; 的
的 ,
, 。
。①常温时,
 溶液pH
溶液pH②将草酸铵溶液用过量稀硫酸酸化,用
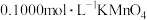 溶液滴定,测得平均消耗
溶液滴定,测得平均消耗 溶液20.00mL,则草酸钴样品的纯度为
溶液20.00mL,则草酸钴样品的纯度为
您最近一年使用:0次
名校
解题方法
7 . 硫酸肼(N2H4·H2SO4)又名硫酸联氨,在医药、染料、农业上用途广泛。回答下列问题:
已知:①Cl2与NaOH反应为放热反应,Cl2与热的NaOH溶液会生成NaClO3;
②利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl;
③硫酸肼的制备原理为N2H4·H2O+H2SO4=N2H4·H2SO4+H2O。
I.制备NaClO溶液。实验制备装置如图1所示:

(1)图1装置试管内发生主要反应的化学方程式为_______ 。
II.尿素法生产水合肼的装置如图2所示:

(2)把I制得的NaClO溶液注入到图2装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液(物质的量之比1∶2.30),仪器a的名称为_______ ,采用低温(低于20℃)反应,降温的方式可采用_______ ,温度高时水合肼会被氧化成无色无味的气体,该气体在标准状况下的密度为1.25g·L−1,其反应化学方程式为_______ 。反应结束后,急速升温至108℃开始回流5min,收集108~114℃馏分。
(3)测定馏分中水合肼的含量。称取馏分6.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L−1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①判断滴定终点的方法是_______ 。
②实验测得消耗碘标准溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为_______ 。
III.硫酸肼的制备
(4)将水合肼转移到烧杯中,滴加一定质量98%的浓硫酸,滴加时间控制在1h左右,温度60℃以下。冷藏沉降2h,得硫酸肼沉淀。抽滤,用无水乙醇洗涤,干燥,得白色硫酸肼固体。用无水乙醇而不用水洗涤的原因是_______ 。
已知:①Cl2与NaOH反应为放热反应,Cl2与热的NaOH溶液会生成NaClO3;
②利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl;
③硫酸肼的制备原理为N2H4·H2O+H2SO4=N2H4·H2SO4+H2O。
I.制备NaClO溶液。实验制备装置如图1所示:

(1)图1装置试管内发生主要反应的化学方程式为
II.尿素法生产水合肼的装置如图2所示:

(2)把I制得的NaClO溶液注入到图2装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液(物质的量之比1∶2.30),仪器a的名称为
(3)测定馏分中水合肼的含量。称取馏分6.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L−1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①判断滴定终点的方法是
②实验测得消耗碘标准溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为
III.硫酸肼的制备
(4)将水合肼转移到烧杯中,滴加一定质量98%的浓硫酸,滴加时间控制在1h左右,温度60℃以下。冷藏沉降2h,得硫酸肼沉淀。抽滤,用无水乙醇洗涤,干燥,得白色硫酸肼固体。用无水乙醇而不用水洗涤的原因是
您最近一年使用:0次
2021-05-14更新
|
158次组卷
|
4卷引用:湖南省宁乡市第一高级中学2021届高三第二次模拟考试化学试卷
湖南省宁乡市第一高级中学2021届高三第二次模拟考试化学试卷(已下线)化学-学科网2021年高三5月大联考(新课标Ⅲ卷)新疆和田地区第二中学2022-2023学年高二上学期11月期中考试化学试题云南省腾冲市第八中学2023--2024学年上学期高二第3次月考化学试卷
名校
8 . 铁、钴在元素周期表中处于相邻位置,其单质及其化合物在工业生产中有重要用途:
(1)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
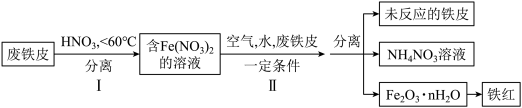
①步骤Ⅰ中的硝酸是三大强酸之一,其电离方程式为_______ ,曾出若温度过高,将导致硝酸分解,硝酸分解的化学方程式为_______ ;
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,硝酸的还原产物为硝酸铵,该反应的化学方程式为_______ ;
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
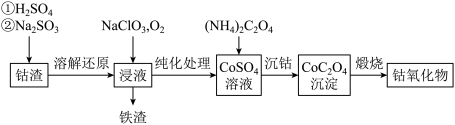
已知:Co(OH)3难溶于水,具有很强的氧化性。Co(OH)3溶解还原反应的离子方程式为_______ ,铁渣中铁元素的化合价为_______ ,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量2.41 g,CO2的体积为1.344 L(标准状况),则钴氧化物的化学式为_______ 。
(1)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤Ⅰ中的硝酸是三大强酸之一,其电离方程式为
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,硝酸的还原产物为硝酸铵,该反应的化学方程式为
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

已知:Co(OH)3难溶于水,具有很强的氧化性。Co(OH)3溶解还原反应的离子方程式为
您最近一年使用:0次
名校
9 . 碳、硅、锗、锡、铅属于同一主族元素,其单质及化合物具有重要的用途。
(1)铅蓄电池是最早使用的充电电池,其构造示意图如图所示,放电时的离子反应方程式为PbO2+Pb+4H++2 =2PbSO4+2H2O。该电池的负极为
=2PbSO4+2H2O。该电池的负极为_______ ,电池放电时正极质量将_______ 。(填“增大”、“减小”或“不变”)

(2)PbO2可发生如图所示的转化:

①写出“还原”反应的离子方程式:__________ ;
②写出“复分解”反应的化学方程式:___________ 。
(3)1400℃~1450℃时,石英、焦炭和氮气可反应生成耐高温、硬度大的化合物X,该反应的化学方程式为3SiO2+6C+2N2 X+6CO。
X+6CO。
①X的化学式为_______ 。
②下列措施不 能提高该反应速率的是_______ (填字母)。
a.将石英和焦炭充分混合 b.增大N2的浓度 c.将粉末状石英换成块状石英
(4)甲醇是常见的燃料电池原料,CO2催化氢化可合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。在2L容器中充入1molCO2和3moH2的混合气体,反应10min后,气体的总物质的量变为原来的75%。则0~10min内,H2的平均反应速率为_______ 。
(1)铅蓄电池是最早使用的充电电池,其构造示意图如图所示,放电时的离子反应方程式为PbO2+Pb+4H++2
 =2PbSO4+2H2O。该电池的负极为
=2PbSO4+2H2O。该电池的负极为
(2)PbO2可发生如图所示的转化:

①写出“还原”反应的离子方程式:
②写出“复分解”反应的化学方程式:
(3)1400℃~1450℃时,石英、焦炭和氮气可反应生成耐高温、硬度大的化合物X,该反应的化学方程式为3SiO2+6C+2N2
 X+6CO。
X+6CO。①X的化学式为
②下列措施
a.将石英和焦炭充分混合 b.增大N2的浓度 c.将粉末状石英换成块状石英
(4)甲醇是常见的燃料电池原料,CO2催化氢化可合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。在2L容器中充入1molCO2和3moH2的混合气体,反应10min后,气体的总物质的量变为原来的75%。则0~10min内,H2的平均反应速率为
您最近一年使用:0次
2021-05-03更新
|
286次组卷
|
2卷引用:湖南省岳阳临湘市2020-2021学年高一下学期期末考试化学试题



