名校
1 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
(2)我国用 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:___________ 。将该反应化学方程式改写为离子方程式:___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下降 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为___________ 。
(5)实验室用下列方法均可制取氯气
① ③
③
②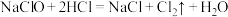 ②
②
③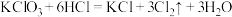 ④
④
若各反应转移的电子数相同,①②③生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下降
 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为(5)实验室用下列方法均可制取氯气
①
 ③
③②
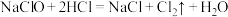 ②
②③
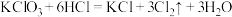 ④
④若各反应转移的电子数相同,①②③生成的氯气质量比为
您最近一年使用:0次
名校
解题方法
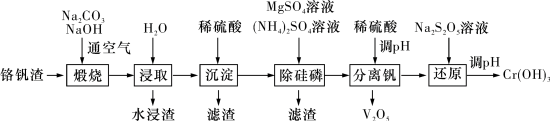
2 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示: 存在,在碱性介质中以
存在,在碱性介质中以 存在;
存在;
ii) 时,硅元素以
时,硅元素以 形式存在;
形式存在;
iii) 在
在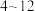 之间,铝元素以
之间,铝元素以 形式存在。
形式存在。
回答下列问题:
(1) 的基态价层电子轨道表示式为
的基态价层电子轨道表示式为_______ 。
(2)向浸取液中滴加稀硫酸过程中含铬离子转化反应的离子方程式为_______ 。
(3)水浸渣中主要物质为_______ (填化学式)。
(4)“沉淀”步骤调 到弱碱性,主要除去的杂质为
到弱碱性,主要除去的杂质为_______ (填化学式)。
(5)“除硅磷”步骤中,使硅、磷分别以 和
和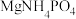 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 以达到最好的除杂效果,下列说法正确的是
以达到最好的除杂效果,下列说法正确的是_______ (填标号)。
a.若 过小,磷酸根离子会与
过小,磷酸根离子会与 反应使其浓度降低导致
反应使其浓度降低导致 无法完全沉淀
无法完全沉淀
b.若 过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若 过大,会导致镁离子生成氢氧化镁沉淀,不能形成
过大,会导致镁离子生成氢氧化镁沉淀,不能形成 沉淀,导致产品中混有杂质
沉淀,导致产品中混有杂质
d.若 过大,溶液中铵根离子浓度增大,导致
过大,溶液中铵根离子浓度增大,导致 无法完全沉淀
无法完全沉淀
(6)“分离钒”步骤中,将溶液 调到1.8左右得到
调到1.8左右得到 沉淀,
沉淀, 在
在 时,溶解为
时,溶解为 或
或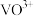 ,在碱性条件下,溶解为
,在碱性条件下,溶解为 或
或 ,上述性质说明
,上述性质说明 具有
具有_______ (填标号)。
A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。
 存在,在碱性介质中以
存在,在碱性介质中以 存在;
存在;ii)
 时,硅元素以
时,硅元素以 形式存在;
形式存在;iii)
 在
在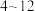 之间,铝元素以
之间,铝元素以 形式存在。
形式存在。回答下列问题:
(1)
 的基态价层电子轨道表示式为
的基态价层电子轨道表示式为(2)向浸取液中滴加稀硫酸过程中含铬离子转化反应的离子方程式为
(3)水浸渣中主要物质为
(4)“沉淀”步骤调
 到弱碱性,主要除去的杂质为
到弱碱性,主要除去的杂质为(5)“除硅磷”步骤中,使硅、磷分别以
 和
和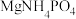 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 以达到最好的除杂效果,下列说法正确的是
以达到最好的除杂效果,下列说法正确的是a.若
 过小,磷酸根离子会与
过小,磷酸根离子会与 反应使其浓度降低导致
反应使其浓度降低导致 无法完全沉淀
无法完全沉淀b.若
 过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀c.若
 过大,会导致镁离子生成氢氧化镁沉淀,不能形成
过大,会导致镁离子生成氢氧化镁沉淀,不能形成 沉淀,导致产品中混有杂质
沉淀,导致产品中混有杂质d.若
 过大,溶液中铵根离子浓度增大,导致
过大,溶液中铵根离子浓度增大,导致 无法完全沉淀
无法完全沉淀(6)“分离钒”步骤中,将溶液
 调到1.8左右得到
调到1.8左右得到 沉淀,
沉淀, 在
在 时,溶解为
时,溶解为 或
或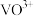 ,在碱性条件下,溶解为
,在碱性条件下,溶解为 或
或 ,上述性质说明
,上述性质说明 具有
具有A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠
 溶液,反应的离子方程式为
溶液,反应的离子方程式为
您最近一年使用:0次
名校
3 . 含氮化合物在工农业有着重要的用途。
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为____________ 。
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→______ (按气流方向,用小写字母表示)。
(3)请写出氨气的检验方法:____________ 。
(4)甲、乙两同学分别设计了下图装备进行喷泉实验,____________ 。
②乙同学想用乙装备在两个烧瓶同时产生喷泉,引发双喷泉的操作是:______ —______ 。
Ⅱ. 经一系列反应可以得到
经一系列反应可以得到 。
。
(5)①中, 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是____________ 。
(6)NO的检验方法是:____________ 。
Ⅲ.研究 、
、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。
(7)选择性催化还原技术(SCR)可使 与
与 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:____________ 。
(8)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应:
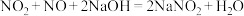 ;
; 。
。
若33.6 mL(标况下)氮氧化物(只含NO和 )与V mL0.1 mol/L NaOH溶液恰好完全反应,则
)与V mL0.1 mol/L NaOH溶液恰好完全反应,则
______ 。
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→
(3)请写出氨气的检验方法:
(4)甲、乙两同学分别设计了下图装备进行喷泉实验,
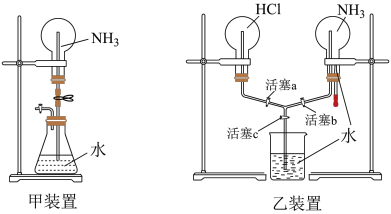
②乙同学想用乙装备在两个烧瓶同时产生喷泉,引发双喷泉的操作是:
Ⅱ.
 经一系列反应可以得到
经一系列反应可以得到 。
。
(5)①中,
 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是(6)NO的检验方法是:
Ⅲ.研究
 、
、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。(7)选择性催化还原技术(SCR)可使
 与
与 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:(8)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应:
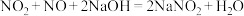 ;
; 。
。若33.6 mL(标况下)氮氧化物(只含NO和
 )与V mL0.1 mol/L NaOH溶液恰好完全反应,则
)与V mL0.1 mol/L NaOH溶液恰好完全反应,则
您最近一年使用:0次
名校
4 . 硫酸亚铁铵晶体又称摩尔盐,是浅蓝绿色结晶或粉末,对光敏感,在空气中逐渐风化及氧化;易溶于水,几乎不溶于乙醇。摩尔盐是一种重要的化工原料,用途十分广泛。可以作净水剂,是制取氧化铁系颜料、磁性材料、黄血盐和其他铁盐等的原料;它还可用作印染工业的媒染剂,制革工业中用于鞣革,木材工业中用作防腐剂,医药中用于治疗缺铁性贫血,农业中施用于缺铁性土壤,畜牧业中用作饲料添加剂等,还可以用于配制蓝黑墨水。以黄铁矿(主要成分为 )为原料制备摩尔盐[
)为原料制备摩尔盐[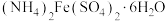 ]的工艺流程如图所示,回答下列问题:
]的工艺流程如图所示,回答下列问题:___________ 。
(2)溶液E中的溶质为___________ (填化学式)。
(3)试剂X为___________ (填化学式),写出少量该试剂在加热条件下与D的浓溶液反应的化学方程式:___________ 。
(4)由溶液E和过量X反应后,需分离溶液F和固体G,使用的玻璃仪器有烧杯、___________ 。
(5)得到摩尔盐时需在惰性气体环境下进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥,在惰性气体环境下进行该系列操作的目的是___________ 。
 )为原料制备摩尔盐[
)为原料制备摩尔盐[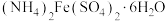 ]的工艺流程如图所示,回答下列问题:
]的工艺流程如图所示,回答下列问题:
(2)溶液E中的溶质为
(3)试剂X为
(4)由溶液E和过量X反应后,需分离溶液F和固体G,使用的玻璃仪器有烧杯、
(5)得到摩尔盐时需在惰性气体环境下进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥,在惰性气体环境下进行该系列操作的目的是
您最近一年使用:0次
名校
解题方法
5 . 铁的化合物有广泛用途,如碳酸亚铁( )可作补血剂。利用某硫酸厂产生的烧渣(主要含
)可作补血剂。利用某硫酸厂产生的烧渣(主要含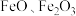 ,还有一定量的
,还有一定量的 )制备碳酸亚铁的流程如图所示:
)制备碳酸亚铁的流程如图所示:
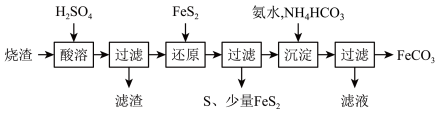
已知:① 不溶于稀硫酸;
不溶于稀硫酸;
②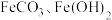 都难溶于水。
都难溶于水。
(1)加入稀硫酸溶解后得到的滤渣是_______________ (写化学式)。
(2)过滤操作需要用到的玻璃仪器有:烧杯、____________ 和____________ 。判断还原时溶液中是否含有 的试剂是
的试剂是______________ 。
(3)“还原”时,加入的 与
与 发生反应Ⅰ、Ⅱ两个氧化还原反应:
发生反应Ⅰ、Ⅱ两个氧化还原反应:
①配平反应Ⅰ的离子方程式:__________
反应Ⅰ:________ ________
________ ________
________ ________
________ ________
________ ________
________
②请写出反应Ⅱ的离子反应方程式:__________ 。
③还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
则反应Ⅰ、Ⅱ中生成 的物质的量之比为
的物质的量之比为________________ 。
(4)“沉淀”时加入的氨水不宜过量,否则生成的 中可能混有
中可能混有____________ 杂质(写出一种即可)。
 )可作补血剂。利用某硫酸厂产生的烧渣(主要含
)可作补血剂。利用某硫酸厂产生的烧渣(主要含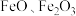 ,还有一定量的
,还有一定量的 )制备碳酸亚铁的流程如图所示:
)制备碳酸亚铁的流程如图所示:
已知:①
 不溶于稀硫酸;
不溶于稀硫酸;②
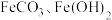 都难溶于水。
都难溶于水。(1)加入稀硫酸溶解后得到的滤渣是
(2)过滤操作需要用到的玻璃仪器有:烧杯、
 的试剂是
的试剂是(3)“还原”时,加入的
 与
与 发生反应Ⅰ、Ⅱ两个氧化还原反应:
发生反应Ⅰ、Ⅱ两个氧化还原反应:①配平反应Ⅰ的离子方程式:
反应Ⅰ:________
 ________
________ ________
________ ________
________ ________
________ ________
________②请写出反应Ⅱ的离子反应方程式:
③还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度 | |
还原前 | 还原后 | |
| 0.10 | 2.50 |
| 3.50 | 3.70 |
 的物质的量之比为
的物质的量之比为(4)“沉淀”时加入的氨水不宜过量,否则生成的
 中可能混有
中可能混有
您最近一年使用:0次
名校
解题方法
6 . 草酸是一种用途广泛的二元有机中强酸,某同学通过查阅资料设计了如图所示的装置(夹持仪器省略)制备一定量的草酸晶体(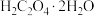 ),并验证其具有的某些性质。回答下列问题:
),并验证其具有的某些性质。回答下列问题:___________ 。
(2)装置B的作用是___________ ,若实验中使用酒精溶液代替食盐水,并且利用酸性 溶液检验有乙炔生成,则气体通过B后应先通入到盛有
溶液检验有乙炔生成,则气体通过B后应先通入到盛有___________ 的洗气瓶,最后通入到酸性 溶液中。
溶液中。
(3)草酸在装置C中生成,反应的化学方程式为___________ ,装置D的作用是___________ 。
(4)待反应结束后,从C中分离出草酸晶体,然后用 的酸性
的酸性 溶液进行滴定以测定其纯度。
溶液进行滴定以测定其纯度。
①称量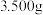 草酸晶体配制
草酸晶体配制 溶液,下列配制操作中错误的是
溶液,下列配制操作中错误的是___________ (填标号)。 溶液的体积如表所示,其中第一次实验滴定后的液面位置如图所示:
溶液的体积如表所示,其中第一次实验滴定后的液面位置如图所示:
则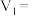
___________  ,样品中草酸晶体的质量分数为
,样品中草酸晶体的质量分数为___________  (保留一位小数)。
(保留一位小数)。
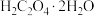 ),并验证其具有的某些性质。回答下列问题:
),并验证其具有的某些性质。回答下列问题: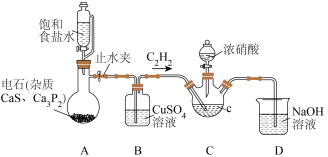
(2)装置B的作用是
 溶液检验有乙炔生成,则气体通过B后应先通入到盛有
溶液检验有乙炔生成,则气体通过B后应先通入到盛有 溶液中。
溶液中。(3)草酸在装置C中生成,反应的化学方程式为
(4)待反应结束后,从C中分离出草酸晶体,然后用
 的酸性
的酸性 溶液进行滴定以测定其纯度。
溶液进行滴定以测定其纯度。①称量
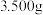 草酸晶体配制
草酸晶体配制 溶液,下列配制操作中错误的是
溶液,下列配制操作中错误的是a. b.
b. c.
c. d.
d.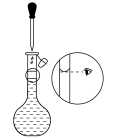
 溶液的体积如表所示,其中第一次实验滴定后的液面位置如图所示:
溶液的体积如表所示,其中第一次实验滴定后的液面位置如图所示: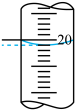
| 滴定次数 | 待测溶液体积 | 标准溶液的体积 | ||
| 滴定前刻度 | 滴定后刻度 | 溶液的体积 | ||
| 第一次 | 20.00 | 0.20 |  | |
| 第二次 | 20.00 | 2.56 | 28.40 | |
| 第三次 | 20.00 | 0.22 | 20.32 | |
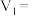
 ,样品中草酸晶体的质量分数为
,样品中草酸晶体的质量分数为 (保留一位小数)。
(保留一位小数)。
您最近一年使用:0次
名校
7 . 氧化还原反应在日常生活和工业生产中有重要应用。
I. 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: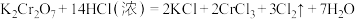 。
。
(1)该反应中被氧化的元素是_______ ,还原产物是_______ 。
(2)该反应中氧化剂与还原剂的个数比为_______ 。
(3)生成标准状况下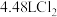 ,转移的电子个数为
,转移的电子个数为_______ (用 表示)。
表示)。
II.阅读下面一段材料并回答问题。
(4)K2FeO4中铁元素的化合价为_______ 。
(5)下列关于K2FeO4的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:_______ 。
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
I.
 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: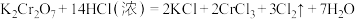 。
。(1)该反应中被氧化的元素是
(2)该反应中氧化剂与还原剂的个数比为
(3)生成标准状况下
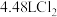 ,转移的电子个数为
,转移的电子个数为 表示)。
表示)。II.阅读下面一段材料并回答问题。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准 |
(5)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
您最近一年使用:0次
解题方法
8 . 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。

(1)实验室中常用来制备氯气的化学方程式为__________ 。
(2)工业上利用天然气(主要成分为 )与
)与 进行高温重整制备CO,已知
进行高温重整制备CO,已知 、
、 和CO的燃烧热(
和CO的燃烧热( )分别为
)分别为 、
、 、
、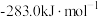 ,则生成1mol CO所需热量为
,则生成1mol CO所需热量为__________ (保留2位小数)。
(3)实验室中可用氯仿( )与双氧水直接反应制备光气,其反应的化学方程式为:
)与双氧水直接反应制备光气,其反应的化学方程式为:__________ 。
(4)右图是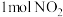 和1mol CO反应生成
和1mol CO反应生成 和NO过程中能量变化示意图,则该反应是
和NO过程中能量变化示意图,则该反应是______ (填“吸热”或“放热”)反应;若使用催化剂,则图中:
______ 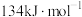 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(5)已知:
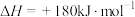

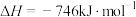
则反应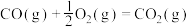 的
的
______ 
(6)已知 、
、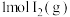 与
与 分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成
分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成 和
和 的热化学方程式为:
的热化学方程式为:______ 。

(1)实验室中常用来制备氯气的化学方程式为
(2)工业上利用天然气(主要成分为
 )与
)与 进行高温重整制备CO,已知
进行高温重整制备CO,已知 、
、 和CO的燃烧热(
和CO的燃烧热( )分别为
)分别为 、
、 、
、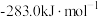 ,则生成1mol CO所需热量为
,则生成1mol CO所需热量为(3)实验室中可用氯仿(
 )与双氧水直接反应制备光气,其反应的化学方程式为:
)与双氧水直接反应制备光气,其反应的化学方程式为:(4)右图是
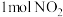 和1mol CO反应生成
和1mol CO反应生成 和NO过程中能量变化示意图,则该反应是
和NO过程中能量变化示意图,则该反应是
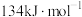 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(5)已知:

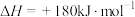

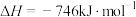
则反应
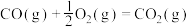 的
的

(6)已知
 、
、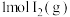 与
与 分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成
分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成 和
和 的热化学方程式为:
的热化学方程式为:
您最近一年使用:0次
名校
解题方法
9 . 钒铬还原渣是钠化提钒过程的固体废弃物,其主要成分为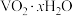 、
、 及少量的
及少量的 ,一种初步分离钒铬还原渣中的钒铬并获得
,一种初步分离钒铬还原渣中的钒铬并获得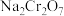 的工艺流程如图:
的工艺流程如图:
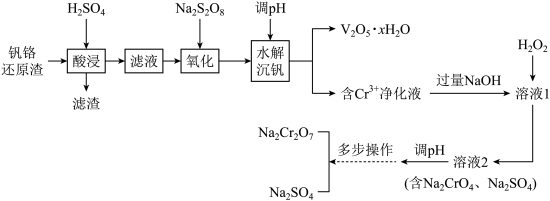
已知:①“酸浸”后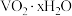 转化为
转化为 ;
;
② ;
;
③ 的
的 近似为
近似为 ;
;
④有关物质的溶解度(g/100 g )如表所示:
)如表所示:
回答下列问题:
(1)写出“滤渣”的一种用途:___________ ,“氧化”操作单元中,消耗的氧化剂与还原剂的物质的量之比为___________ 。
(2)若“含 净化液”中
净化液”中 ,则“水解沉钒”调pH的范围是2.5
,则“水解沉钒”调pH的范围是2.5___________ 。
(3)“溶液1”中含 ,加入
,加入 后发生的化学反应方程式为
后发生的化学反应方程式为___________ 。
(4)“溶液2”调pH所发生反应的离子方程式为___________ 。
(5)“多步操作”包括蒸发结晶、趁热过滤、所得滤液冷却结晶、过滤、洗涤等步骤,其中蒸发结晶时,过度蒸发将导致___________ 。
(6)研究温度对 与
与 的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用
的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用 、
、 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是___________ 、___________ 。
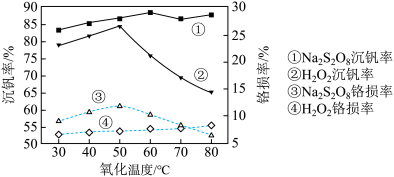
 、
、 及少量的
及少量的 ,一种初步分离钒铬还原渣中的钒铬并获得
,一种初步分离钒铬还原渣中的钒铬并获得 的工艺流程如图:
的工艺流程如图:
已知:①“酸浸”后
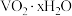 转化为
转化为 ;
;②
 ;
;③
 的
的 近似为
近似为 ;
;④有关物质的溶解度(g/100 g
 )如表所示:
)如表所示:| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
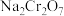 | 183.6 | 215.1 | 269.2 | 376.4 | 415.0 |
 | 19.5 | 48.8 | 45.3 | 43.7 | 42.5 |
(1)写出“滤渣”的一种用途:
(2)若“含
 净化液”中
净化液”中 ,则“水解沉钒”调pH的范围是2.5
,则“水解沉钒”调pH的范围是2.5(3)“溶液1”中含
 ,加入
,加入 后发生的化学反应方程式为
后发生的化学反应方程式为(4)“溶液2”调pH所发生反应的离子方程式为
(5)“多步操作”包括蒸发结晶、趁热过滤、所得滤液冷却结晶、过滤、洗涤等步骤,其中蒸发结晶时,过度蒸发将导致
(6)研究温度对
 与
与 的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用
的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用 、
、 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是
您最近一年使用:0次
名校
解题方法
10 . 二水合磷酸二氢锰具有广泛用途,被用作防锈剂。某化工厂拟用软锰矿(含MnO2及少量FeO、Al2O3和SiO2)为原料生产Mn(H2PO4)22H2O,其工艺流程如下所示:
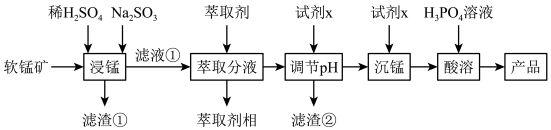
回答下列问题:
(1)滤渣①的主要成分是_______ ,适量的Na2SO3固体的作用是_______ ;
(2)浸锰时,FeO生成Fe3+的离子方程式为_________ ;
(3)可用_______ (填试剂名称)溶液检验滤液①中是否含有Fe2+;
(4)试剂X为钠的正盐,从环保、经济角度,X最好为_______ (写化学式);
(5)“沉锰”后需要过滤、洗涤沉淀,检验该沉淀洗涤干净的方法是______ ;
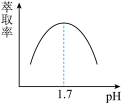
(6)“萃取分液”时,Fe3+的萃取率与pH的关系如图,如pH>1.7后,随pH增大,Fe3+萃取率下降的原因是_______ 。

回答下列问题:
(1)滤渣①的主要成分是
(2)浸锰时,FeO生成Fe3+的离子方程式为
(3)可用
(4)试剂X为钠的正盐,从环保、经济角度,X最好为
(5)“沉锰”后需要过滤、洗涤沉淀,检验该沉淀洗涤干净的方法是
(6)“萃取分液”时,Fe3+的萃取率与pH的关系如图,如pH>1.7后,随pH增大,Fe3+萃取率下降的原因是

您最近一年使用:0次