真题
名校
1 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________ 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________ 。该反应需要在加压下进行,原因是________________________ 。
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: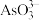 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
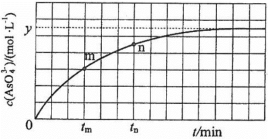
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是__________ (填标号)。
a.溶液的pH不再变化
b.v(I−)=2v(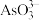 )
)
c.c( )/c(
)/c(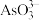 )不再变化
)不再变化
d.c(I−)=y mol·L−1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________ 。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________ 。
(1)画出砷的原子结构示意图
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(3)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:
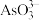 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化
b.v(I−)=2v(
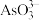 )
)c.c(
 )/c(
)/c(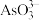 )不再变化
)不再变化d.c(I−)=y mol·L−1
②tm时,v正
③tm时v逆
④若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次
2017-08-08更新
|
8533次组卷
|
16卷引用:2020届湖南省湘潭市高三教学质量监测卷化学试题
2020届湖南省湘潭市高三教学质量监测卷化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)内蒙古集宁一中2018届高三上学期第三次月考化学试题(已下线)黄金30题系列 高三化学 大题易丢分西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题(已下线)《考前20天终极攻略》-5月29日 化学反应原理综合(已下线)解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密(已下线)解密20 原理综合题(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】(已下线)广东省深圳中学2020届高三2月份网络教学质量监测理综化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广西北流市实验中学2019-2020学年高二下学期期中考试理科综合化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练广东省湛江市第二十一中学2021-2022学年高二上学期期中考试化学试题云南省昌宁县第一中学2021-2022学年高三下学期3月月考化学试题云南省玉溪市民族中学2021-2022学年高三1月份考试理综化学试题



