1 . 含硼化合物硼酸( )、硼氢化钠(
)、硼氢化钠( )、硼酸甲酯
)、硼酸甲酯 在工业上有重要用途。回答下列问题:
在工业上有重要用途。回答下列问题:
(1) 在水溶液中会发生如下反应:
在水溶液中会发生如下反应: (反应实质为水电离出的
(反应实质为水电离出的 被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因
被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因_______ 。
(2)利用硼砂(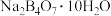 )制备硼酸(
)制备硼酸( )的流程如下图所示:
)的流程如下图所示:
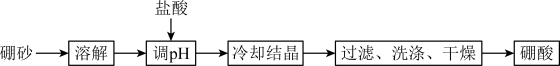
①“调 ”时需要控制溶液
”时需要控制溶液 ,写出用
,写出用 试纸检测溶液
试纸检测溶液 的操作方法:
的操作方法:_______ 。
②“调 ”后溶液中有硼酸生成,写出反应的离子方程式:
”后溶液中有硼酸生成,写出反应的离子方程式:_______ 。
③ 在水中电离方程式为:
在水中电离方程式为: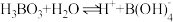 ,
,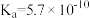 ,据此可判断
,据此可判断 属于
属于_______ 元弱酸,常温下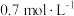 的硼酸溶液中
的硼酸溶液中 的浓度约为
的浓度约为_______ (计算结果保留小数点后一位)。
(3)利用硼酸和甲醇制备硼酸甲酯,发生的反应为: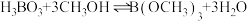 ,不同温度下,硼酸的转化率(
,不同温度下,硼酸的转化率( )随时间变化如图所示:
)随时间变化如图所示:

①该反应的
_______ (填“<”“=”或“>”)0。
②达到平衡时,升高温度,_______ [填“ ”或“
”或“ ”]增大的程度更大。
”]增大的程度更大。
 )、硼氢化钠(
)、硼氢化钠( )、硼酸甲酯
)、硼酸甲酯 在工业上有重要用途。回答下列问题:
在工业上有重要用途。回答下列问题:(1)
 在水溶液中会发生如下反应:
在水溶液中会发生如下反应: (反应实质为水电离出的
(反应实质为水电离出的 被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因
被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因(2)利用硼砂(
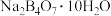 )制备硼酸(
)制备硼酸( )的流程如下图所示:
)的流程如下图所示:
①“调
 ”时需要控制溶液
”时需要控制溶液 ,写出用
,写出用 试纸检测溶液
试纸检测溶液 的操作方法:
的操作方法:②“调
 ”后溶液中有硼酸生成,写出反应的离子方程式:
”后溶液中有硼酸生成,写出反应的离子方程式:③
 在水中电离方程式为:
在水中电离方程式为: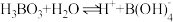 ,
,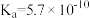 ,据此可判断
,据此可判断 属于
属于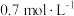 的硼酸溶液中
的硼酸溶液中 的浓度约为
的浓度约为(3)利用硼酸和甲醇制备硼酸甲酯,发生的反应为:
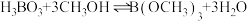 ,不同温度下,硼酸的转化率(
,不同温度下,硼酸的转化率( )随时间变化如图所示:
)随时间变化如图所示:
①该反应的

②达到平衡时,升高温度,
 ”或“
”或“ ”]增大的程度更大。
”]增大的程度更大。
您最近半年使用:0次
2023-02-20更新
|
55次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2022-2023学年高二上学期期末考试化学试题
名校
解题方法
2 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的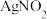 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: _______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: _______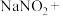 _______
_______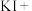 _______
_______ _______
_______ _______
_______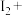 _______
_______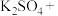 _______
_______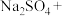 _______
_______
(1)请完成该化学方程式并配平。_______
(2) 中N的化合价为
中N的化合价为_______ ,由N的化合价推测 具有
具有_______ (填“氧化性”、“还原性”或“氧化性、还原性”)。
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是_______ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的_______ (填“氧化性”或“还原性”)应该比 更
更_______ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和
和 的是_______(填序号)。
的是_______(填序号)。
(5) 与
与 反应:
反应: ,若有0.5mol氧化剂被还原,则被氧化的还原剂的物质的量是
,若有0.5mol氧化剂被还原,则被氧化的还原剂的物质的量是_______ mol。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式_______ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的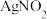 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: _______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: _______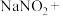 _______
_______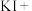 _______
_______ _______
_______ _______
_______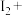 _______
_______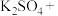 _______
_______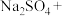 _______
_______
(1)请完成该化学方程式并配平。
(2)
 中N的化合价为
中N的化合价为 具有
具有(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的 更
更(4)下列方法不能用来区分固体
 和
和 的是_______(填序号)。
的是_______(填序号)。| A.分别溶于水并滴加酚酞试液 | B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
 与
与 反应:
反应: ,若有0.5mol氧化剂被还原,则被氧化的还原剂的物质的量是
,若有0.5mol氧化剂被还原,则被氧化的还原剂的物质的量是(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式
您最近半年使用:0次
名校
解题方法
3 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
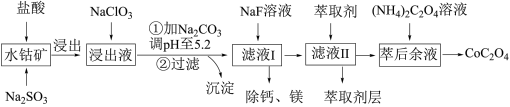
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将_____________ 还原(填离子符号)以便固体溶解。该步反应的离子方程式为____________________ (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为____________________ 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是____________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是________ ;使用萃取剂适宜的pH=____ (填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=
您最近半年使用:0次
2016-12-09更新
|
196次组卷
|
5卷引用:青海省西宁市第四高级中学、第五中学、第十四中学三校2017届高三4月联考化学试题



