名校
解题方法
1 . (I)硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
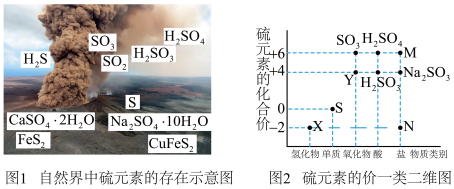
(1)图1中与图2中M、N对应的物质分别是____________ 、_____________ 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为__________ 。
(3)Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的基本操作是___________ 。
(4)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸反应的化学方程式是______________ 。该反应体现了浓硫酸的____________ 性。
②这两种方案,你认为哪一种方案更合理?_______ 。理由是_________________ 。
(II)氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
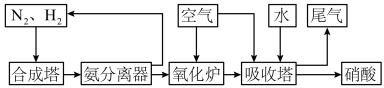
(1)合成塔中发生反应的化学方程式为__________ 。
(2)氨分离器中压强约为15MPa,温度约为-20°C,分离氨应用了氨的________ 性质。
(3)氧化炉中,NH3转化为NO的化学方程式为_________ 。标准状况下,5.6LNH3被氧化为NO时转移电子的物质的量为________ 。
(4)①吸收塔中主要的反应的化学方程式为_______
②吸收塔中出来的尾气可用Na2CO3溶液吸收,主要反应为:
a.2NO2 + Na2CO3 = NaNO3 +NaNO2 +CO2
b.NO+NO2 + Na2CO3 = 2NaNO2+CO2
根据反应b,每产生22.4L(标准状况下)CO2,吸收液质量将增加______ g。
(5)写出铜分别于稀HNO3、浓HNO3反应的化学方程式__________

(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的基本操作是
(4)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸反应的化学方程式是
②这两种方案,你认为哪一种方案更合理?
(II)氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:

(1)合成塔中发生反应的化学方程式为
(2)氨分离器中压强约为15MPa,温度约为-20°C,分离氨应用了氨的
(3)氧化炉中,NH3转化为NO的化学方程式为
(4)①吸收塔中主要的反应的化学方程式为
②吸收塔中出来的尾气可用Na2CO3溶液吸收,主要反应为:
a.2NO2 + Na2CO3 = NaNO3 +NaNO2 +CO2
b.NO+NO2 + Na2CO3 = 2NaNO2+CO2
根据反应b,每产生22.4L(标准状况下)CO2,吸收液质量将增加
(5)写出铜分别于稀HNO3、浓HNO3反应的化学方程式
您最近半年使用:0次
名校
2 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。

(1)A、B、C三种物质中,属于电解质的是_______ (填化学式)。
(2)写出 的电离方程式
的电离方程式_______ 。
(3)C可与HCl反应生成A,写出该反应的化学方程式_______ 。
(4)已知D可用于实验室制 ,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式
,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式_______ 。

(1)A、B、C三种物质中,属于电解质的是
(2)写出
 的电离方程式
的电离方程式(3)C可与HCl反应生成A,写出该反应的化学方程式
(4)已知D可用于实验室制
 ,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式
,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式
您最近半年使用:0次
名校
解题方法
3 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:
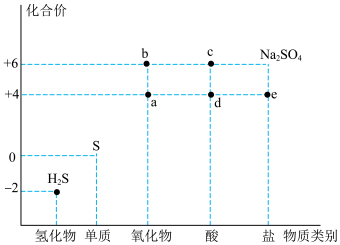
(1)质量相同的a和b,物质的量之比为_______ 。
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为_______ 。
(3)将足量的a通入 溶液中,下列说法正确的是
溶液中,下列说法正确的是_______ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(4)根据“价类二维图”,下列能与a反应且使a表现还原性的物质是_______ (填序号)。
①NaOH溶液 ② 溶液 ③
溶液 ③ 溶液 ④酸性
溶液 ④酸性 溶液
溶液
(5)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是: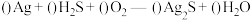 。配平该反应方程式并用单线桥法表示该反应电子转移情况
。配平该反应方程式并用单线桥法表示该反应电子转移情况_______ 。
(6)已知e为正盐,且能被酸性 氧化为
氧化为 ,
, 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:_______ 。

(1)质量相同的a和b,物质的量之比为
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为
(3)将足量的a通入
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀(4)根据“价类二维图”,下列能与a反应且使a表现还原性的物质是
①NaOH溶液 ②
 溶液 ③
溶液 ③ 溶液 ④酸性
溶液 ④酸性 溶液
溶液(5)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是:
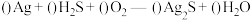 。配平该反应方程式并用单线桥法表示该反应电子转移情况
。配平该反应方程式并用单线桥法表示该反应电子转移情况(6)已知e为正盐,且能被酸性
 氧化为
氧化为 ,
, 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:
您最近半年使用:0次
4 . 利用物质类别及核心元素的化合价推测物质的性质是研究化学的重要手段。硫元素的常见化合价与部分物质类别的对应关系如图。回答下列问题:
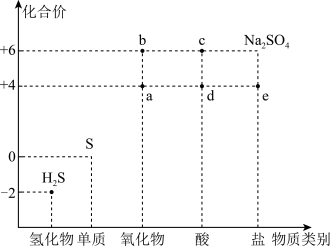
(1)将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为_______ 。
(2)c的浓溶液能与H2S反应产生一种气体和淡黄色沉淀,写出此反应的化学方程式:_______ 。
(3)将a排入大气中会引起_______ 。
(4)硫元素还有一种常见的价态为-1价,如硫铁矿(主要成分为FeS2)中的硫元素。FeS2可以与Fe2(SO4)3溶液发生反应:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8H2SO4。该反应中的氧化剂是_______ (填化学式)。向反应后的溶液中通入空气能使Fe2(SO4)3溶液再生,写出再生反应的离子方程式:_______ 。
(5)常温下,c的浓溶液可用铁罐车或铝槽车运输,其原因是铁和铝在常温下遇到c的浓溶液会发生_______ 。
(6)若要验证木炭与c的浓溶液反应的产物中同时含有气体a和CO2,可选择以下试剂进行实验:
①NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液
选择合适试剂,并安排合理的顺序_______ (填序号)。

(1)将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为
(2)c的浓溶液能与H2S反应产生一种气体和淡黄色沉淀,写出此反应的化学方程式:
(3)将a排入大气中会引起
(4)硫元素还有一种常见的价态为-1价,如硫铁矿(主要成分为FeS2)中的硫元素。FeS2可以与Fe2(SO4)3溶液发生反应:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8H2SO4。该反应中的氧化剂是
(5)常温下,c的浓溶液可用铁罐车或铝槽车运输,其原因是铁和铝在常温下遇到c的浓溶液会发生
(6)若要验证木炭与c的浓溶液反应的产物中同时含有气体a和CO2,可选择以下试剂进行实验:
①NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液
选择合适试剂,并安排合理的顺序
您最近半年使用:0次
名校
解题方法
5 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_______ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式_______ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_______ ,反应的离子方程式为_______ 。
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:
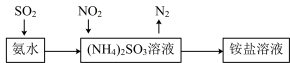
NO2被吸收过程的离子方程式是_______ 。

(1)根据A对应的化合价和物质类别,A为
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:

NO2被吸收过程的离子方程式是
您最近半年使用:0次
2021-09-07更新
|
232次组卷
|
2卷引用:广东省顶级名校2021-2022学年高二上学期入学考试化学试题
6 . 铁的单质及其化合物用途广泛,下列相关的离子方程式书写正确的是
A.用KSCN溶液检验 : : |
B.硫酸亚铁溶液中滴加双氧水: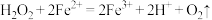 |
C.NaClO碱性条件下制备绿色消毒剂 : : |
D.用 溶液刻蚀Cu电路板: 溶液刻蚀Cu电路板: |
您最近半年使用:0次
解题方法
7 . 亚硝酸钠(NaNO2)用途很广泛:可制药,作食品防腐剂、显色剂,作印染工业的媒染剂、漂白剂、缓蚀剂等,某兴趣小组欲制备亚硝酸钠并进行一定的实验探究,查阅资料可知:①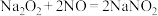 ;②
;②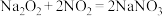 ;③
;③ 可被酸性
可被酸性 氧化成
氧化成 ,现用下图所示装置制备
,现用下图所示装置制备 :
:
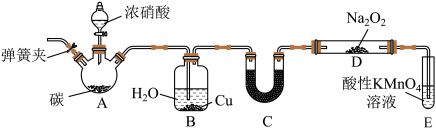
(1)连接仪器之后,加入药品之前需要进行的操作是_____ ;过氧化钠的电子式是_____ 。
(2)仪器B中Cu的作用是_____ 。(用离子方程式表示)
(3)U形管C中的试剂可以是_____ 。
(4)试管E中反应的离子方程式为_____ 。
(5)以上装置有设计缺陷,会使产品NaNO2中杂质增多,改进方法是_____ 。
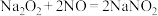 ;②
;②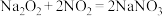 ;③
;③ 可被酸性
可被酸性 氧化成
氧化成 ,现用下图所示装置制备
,现用下图所示装置制备 :
:
(1)连接仪器之后,加入药品之前需要进行的操作是
(2)仪器B中Cu的作用是
(3)U形管C中的试剂可以是
(4)试管E中反应的离子方程式为
(5)以上装置有设计缺陷,会使产品NaNO2中杂质增多,改进方法是
您最近半年使用:0次
23-24高二上·广东深圳·期末
名校
解题方法
8 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、Al2O3、SiO2和FeO)为原料,采用酸溶法制取 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
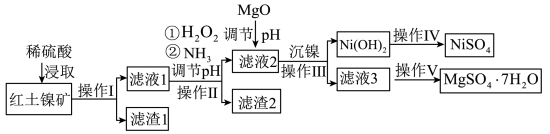
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入H2O2的作用是___________ (用离子反应方程式表示)。
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是___________ 。
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________ mol/L。
(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为___________ 。
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为___________ ;
②样品中镍元素的质量分数为___________ %(保留3位有效数字);
③以下操作,会使测定结果偏低的有___________ 。
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
| 沉淀完全(c<10-5mol/L)时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入H2O2的作用是
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为
②样品中镍元素的质量分数为
③以下操作,会使测定结果偏低的有
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
您最近半年使用:0次
解题方法
9 .  可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
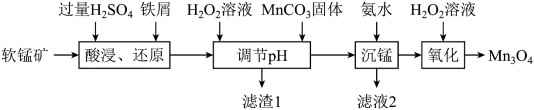
25℃时,相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“酸浸、还原”时,软锰矿的成分中___________ (填物质名称)没有发生反应。
(2)“酸浸、还原”后,溶液中含有的金属阳离子有 、
、___________ (填离子符号),铁屑、 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(3)“调节pH”时,加入 溶液的目的是
溶液的目的是___________ (用离子方程式表示)。
(4)“沉锰”时发生反应的离子方程式为___________ 。滤液2的用途是___________ 。
 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
25℃时,相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.3 | 3.4 | 8.1 |
| 沉淀完全的pH | 2.8 | 8.3 | 4.7 | 10.1 |
(1)“酸浸、还原”时,软锰矿的成分中
(2)“酸浸、还原”后,溶液中含有的金属阳离子有
 、
、 与
与 反应的离子方程式为
反应的离子方程式为(3)“调节pH”时,加入
 溶液的目的是
溶液的目的是(4)“沉锰”时发生反应的离子方程式为
您最近半年使用:0次
10 . 部分元素的单质及其化合物(或其溶液)的转化关系如图。已知A是生活中使用广泛的金属单质,常温下B是无色无味的液体,E是胃酸的主要成分。
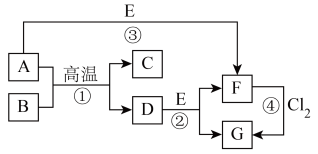
请回答下列问题。
(1)写出下列物质的化学式:E_______ ;G_______ 。
(2)反应①的化学方程式为_______ ;写出C在生产、生活中的一种用途:_______ 。
(3)反应②的离子方程式为_______ 。
(4)F溶液常温下呈浅绿色,该溶液中金属阳离子为_______ (填离子符号),下列实验操作及现象能证明溶液中含有该金属阳离子的是_______ (填标号),反应④中氧化剂和还原剂的物质的量之比为_______ 。
a.取样,加入铜粉,无明显现象
b.取样,滴加 溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色
溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色

请回答下列问题。
(1)写出下列物质的化学式:E
(2)反应①的化学方程式为
(3)反应②的离子方程式为
(4)F溶液常温下呈浅绿色,该溶液中金属阳离子为
a.取样,加入铜粉,无明显现象
b.取样,滴加
 溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色
溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色
您最近半年使用:0次



