名校
1 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,以下是氯元素的“价类二维图”的部分信息。请回答下列问题:

(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。
(2)已知高氯酸( )是强酸,写出高氯酸与铁反应的离子方程式
)是强酸,写出高氯酸与铁反应的离子方程式_______ 。
(3)氯气既有氧化性又有还原性,结合上图说明理由_______ 
(4)实验室可用二氧化锰与浓盐酸在加热条件下制得氯气。写出该反应的化学方程式_______ ,该反应中盐酸表现_______ (填字母)。
A.酸性 B.氧化性 C.还原性 D. 挥发性
(5)84消毒液使用说明中特别提醒不可与洁厕灵混合使用,否则会产生氯气,有关反应方程式为 ,下列有关该反应说法
,下列有关该反应说法不正确 的是_______。
(6)某游泳池常用 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的化学方程式
,写出相应的化学方程式_______ 。

(1)根据图中信息写出Y、Z的化学式
(2)已知高氯酸(
 )是强酸,写出高氯酸与铁反应的离子方程式
)是强酸,写出高氯酸与铁反应的离子方程式(3)氯气既有氧化性又有还原性,结合上图说明理由

(4)实验室可用二氧化锰与浓盐酸在加热条件下制得氯气。写出该反应的化学方程式
A.酸性 B.氧化性 C.还原性 D. 挥发性
(5)84消毒液使用说明中特别提醒不可与洁厕灵混合使用,否则会产生氯气,有关反应方程式为
 ,下列有关该反应说法
,下列有关该反应说法| A.n(氧化剂):n(还原剂)=1:1 | B.n(氧化剂):n(还原剂)=1:2 |
C.氧化性: | D. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的化学方程式
,写出相应的化学方程式
您最近一年使用:0次
2022-03-20更新
|
1086次组卷
|
3卷引用:广东省江门市第二中学2022-2023学年高一上学期期中考试化学试题
广东省江门市第二中学2022-2023学年高一上学期期中考试化学试题河北省三河市第二中学2021-2022学年高一上学期期末考试化学试题(已下线)第二章《 海水中的重要元素----钠和氯》基础过关单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
2 . 钯(Pd)是一种不活泼金属,性质与铂相似。含钯催化剂不仅在科研和工业生产中用途广泛,而且用量大,因此从废催化剂中回收钯具有巨大的经济效益。已知某废催化剂的主要成分是钯和活性炭,还含有少量铁、镁、铝、硅、铜等杂质元素,提取海绵钯的工艺流程如下:
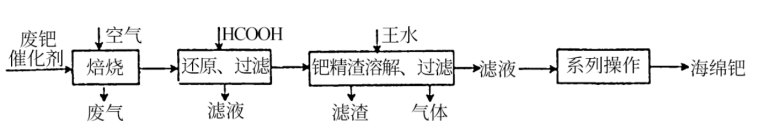
(1)Pd的价电子排布式为4d10,指出它在元素周期表中的位置_______ 。
(2)“焙烧”步骤中,通入的空气一定要足量,理由是_______ 。
(3)写出甲酸还原过程发生反应的化学方程式_______ 。
(4)钯在王水中溶解生成化合物X(由3种元素组成)、种无色有毒的气体Y和水。
①如何配置王水_______ 。
②写出钯与王水反应的化学方程式_______ 。
(5)金属钯具有显著的吸氢性能,其密度为12.0g·cm-3。
①在标准状况下,海绵钯吸收氢气的体积约为其体积的840倍,求海绵钯的吸附容量R=_______ (mL·g-1)、氢气的浓度r=_______ (1molPd吸收氢气的物质的量)。
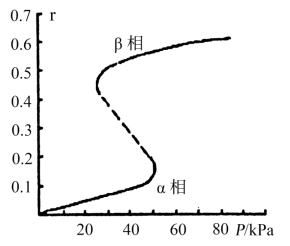
②金属钯中,氢气的r与压强之间的变化关系如图所示,试解释该图的变化趋势_______ 。
(相对原子质量:Pd106.4,理想气体常数R=8.314J·mol-l·K-1)

(1)Pd的价电子排布式为4d10,指出它在元素周期表中的位置
(2)“焙烧”步骤中,通入的空气一定要足量,理由是
(3)写出甲酸还原过程发生反应的化学方程式
(4)钯在王水中溶解生成化合物X(由3种元素组成)、种无色有毒的气体Y和水。
①如何配置王水
②写出钯与王水反应的化学方程式
(5)金属钯具有显著的吸氢性能,其密度为12.0g·cm-3。
①在标准状况下,海绵钯吸收氢气的体积约为其体积的840倍,求海绵钯的吸附容量R=
②金属钯中,氢气的r与压强之间的变化关系如图所示,试解释该图的变化趋势

(相对原子质量:Pd106.4,理想气体常数R=8.314J·mol-l·K-1)
您最近一年使用:0次
名校
解题方法
3 . 锰的重要用途是制造锰钢.一种以高铁锰矿(含MnO2、Fe2O3及少量FeO、CaO、K2O、Na2O)为原料生产金属锰的工艺流程如图:

回答下列问题:
(1)“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。
①理论上,还能被还原的成分有__ 、__ (填化学式)。
②根据表中数据,焙烧时应选择的温度为__ 。
(2)“浸出”产生“滤渣”的主要成分为___ (填化学式);该步骤中需再加入MnSO4以促进“滤渣”析出,结合化学反应原理解释其原因:___ 。
(3)“除杂”时,加入的MnO2将Fe2+氧化为Fe3+,其离子方程式为___ ;再将pH逐步调至6,Fe3+水解为Fe(OH)3,同时Fe3+与Na+、K+形成络合物沉淀。
(4)电解“净化”所得溶液(MnSO4的酸性溶液)制备Mn。
①电解时,溶液中的阳离子在阴极存在两个相互竞争的电极反应,其产物分别为Mn和__ (填化学式)。
②研究表明,加入适量的SeO2有利于Mn在电极上析出.机理为:SeO2与水反应生成的H2SeO3(二元弱酸)在阴极放电生成Se单质,该电极反应为__ ;电极上的Se对Mn2+有特殊的吸附性能,使Mn2+的电还原沉积成为主要反应。
③电解废液可在上述流程的___ 步骤中循环使用。

回答下列问题:
(1)“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。
①理论上,还能被还原的成分有
②根据表中数据,焙烧时应选择的温度为
| 还原温度/℃ | 焙烧后Mn元素在主要含锰物质中的分布/% | ||
| MnO2 | 高价锰(MnxOy) | 低价锰(MnO) | |
| 600 800 1000 1100 1200 | 40.92 10.56 5.77 痕量 痕量 | 34.76 6.63 2.70 0.46 0.30 | 24.32 82.81 91.29 98.76 97.94 |
(3)“除杂”时,加入的MnO2将Fe2+氧化为Fe3+,其离子方程式为
(4)电解“净化”所得溶液(MnSO4的酸性溶液)制备Mn。
①电解时,溶液中的阳离子在阴极存在两个相互竞争的电极反应,其产物分别为Mn和
②研究表明,加入适量的SeO2有利于Mn在电极上析出.机理为:SeO2与水反应生成的H2SeO3(二元弱酸)在阴极放电生成Se单质,该电极反应为
③电解废液可在上述流程的
您最近一年使用:0次
2021-03-19更新
|
946次组卷
|
4卷引用:广东省深圳市2021届高三下学期第一次调研考试化学试题
广东省深圳市2021届高三下学期第一次调研考试化学试题湖南省长沙市第一中学2021届高三第一次模拟考试化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)第18周 周测卷-备战2022年高考化学周测与晚练(新高考专用)
4 . 在炼钢残渣中, 和FeO结合成
和FeO结合成 。经如图所示工艺流程可提取出工业级
。经如图所示工艺流程可提取出工业级 ,继而可以制取钒单质及其化合物。
,继而可以制取钒单质及其化合物。
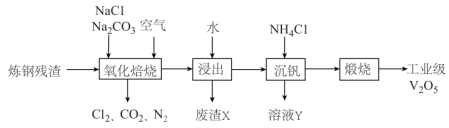
回答下列问题:
(1)钒是第四周期第ⅤB族元素,原子的最外层电子数是2,则钒的原子结构示意图为___________ 。
(2)“氧化焙烧”过程中,钒元素转化为 ,涉及到的主要反应有三个,分别为
,涉及到的主要反应有三个,分别为 、
、 和
和___________ 。
(3)废渣X的主要成分的用途是___________ (任写一点)。溶液Y中的主要溶质是___________ (填化学式)。
(4)以工业级 为原料,可用铝热法冶炼钒单质,反应的化学方程式为
为原料,可用铝热法冶炼钒单质,反应的化学方程式为___________ 。
(5)全钒液流电池的工作原理如图所示。电解槽中使用的离子交换膜仅允许 通过。已知:充电时,右侧区域
通过。已知:充电时,右侧区域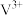 转化为
转化为 。
。

①充电时,b为电源的___________ (填“正极”或“负极”)。
②放电时,正极的电极反应式为___________ 。
 和FeO结合成
和FeO结合成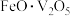 。经如图所示工艺流程可提取出工业级
。经如图所示工艺流程可提取出工业级 ,继而可以制取钒单质及其化合物。
,继而可以制取钒单质及其化合物。
回答下列问题:
(1)钒是第四周期第ⅤB族元素,原子的最外层电子数是2,则钒的原子结构示意图为
(2)“氧化焙烧”过程中,钒元素转化为
 ,涉及到的主要反应有三个,分别为
,涉及到的主要反应有三个,分别为 、
、 和
和(3)废渣X的主要成分的用途是
(4)以工业级
 为原料,可用铝热法冶炼钒单质,反应的化学方程式为
为原料,可用铝热法冶炼钒单质,反应的化学方程式为(5)全钒液流电池的工作原理如图所示。电解槽中使用的离子交换膜仅允许
 通过。已知:充电时,右侧区域
通过。已知:充电时,右侧区域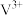 转化为
转化为 。
。
①充电时,b为电源的
②放电时,正极的电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 铋是一种稀有金属,铋及其化合物在工业生产中用途广泛,如氯氧化铋常用于电子设备、汽车装饰材料、塑料助剂及生产干电池阴极。以下是一种用铋精矿(主要成分是Bi2S3还含有FeS2、 Cu2S、PbO2及不溶性杂质)制备 BiOCl的一种方法,其流程如图:

已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
(1)铋精矿在浸取时会先进行粉碎,目的是___________ 。
(2)加压氧化氨浸过程中,已知 CuS2发生如下反应: ,
, 生成
生成 ,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式
,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式___________ 。
(3)操作Ⅰ为:___________ 。
(4)根据流程分析,盐酸羟胺在反应中起到什么作用:___________ 。
(5)流程中生成 BiOCl 的离子方程式:___________ 。
(6)滤液 3 中含有的金属阳离子有:___________ 。

已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
(1)铋精矿在浸取时会先进行粉碎,目的是
(2)加压氧化氨浸过程中,已知 CuS2发生如下反应:
 ,
, 生成
生成 ,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式
,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式(3)操作Ⅰ为:
(4)根据流程分析,盐酸羟胺在反应中起到什么作用:
(5)流程中生成 BiOCl 的离子方程式:
(6)滤液 3 中含有的金属阳离子有:
您最近一年使用:0次
2021-03-03更新
|
642次组卷
|
4卷引用:广东省珠海市2021届高三第一次学业质量监测化学试题
广东省珠海市2021届高三第一次学业质量监测化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)2022届重庆市缙云教育联盟高三第〇次诊断性检测化学试题河南省范县第一中学2021-2022学年高二上学期期中检测化学试题
名校
解题方法
6 . I.摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
(1)Si在元素周期表中的位置是_______ 。
(2)根据用途推测SiO2在水中的溶解性:_______ (填“易溶”或“难溶”)。
(3)制备SiO2的方法如图:
Na2SiO3溶液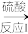 H2SiO3沉淀
H2SiO3沉淀 SiO2
SiO2
①写出反应I的离子方程式_______ 。
②比较酸性强弱:H2SO4_______ H2SiO3(填“>”或“<”)。
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。

下列说法正确的是_______ (填序号)。
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
II.阅读下面一段材料并回答问题。
高铁酸钾使用说明书
(1)K2FeO4中铁元素的化合价为_______ 。
(2)制备K2FeO4需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于K2FeO4的说法中,不正确 的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整: 4K2FeO4 + H2O = Fe(OH)3(胶体)+_____ + KOH
______
(5)消毒净化500 m3水,至少需要K2FeO4的质量为_______ kg。
(1)Si在元素周期表中的位置是
(2)根据用途推测SiO2在水中的溶解性:
(3)制备SiO2的方法如图:
Na2SiO3溶液
 H2SiO3沉淀
H2SiO3沉淀 SiO2
SiO2①写出反应I的离子方程式
②比较酸性强弱:H2SO4
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。

下列说法正确的是
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
II.阅读下面一段材料并回答问题。
高铁酸钾使用说明书
| 【化学式】K2FeO4 【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1 L水投放5 mg K2FeO4即可达到卫生标准 |
(2)制备K2FeO4需要在
(3)下列关于K2FeO4的说法中,
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整: 4K2FeO4 + H2O = Fe(OH)3(胶体)+_____ + KOH
(5)消毒净化500 m3水,至少需要K2FeO4的质量为
您最近一年使用:0次
名校
解题方法
7 . 氯及其化合物在生产、生活中有着广泛的用途
(1)次氯酸钠是最普通的家庭洗涤中的“氯”漂白剂和消毒剂。已知“84消毒液”的主要成分是次氯酸钠,在清洗卫生间时,若将“洁厕灵”与“84消毒液”混合使用会发生氯气中毒事件。请从氧化还原反应的角度分析原因:_______________________ 。
(2)漂白粉的有效成分是:______________ (填化学式),老师新买的漂白粉没有保存说明书,请你为漂白粉设计一份保存注意事项(不超过20个字):_____________ ,漂白粉久置后其成分除CaCl2外还含有______________ (填化学式),请你设计实验方案证明该固体粉末含Cl-离子:____________________________ 。
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下述离子方程式Fe(OH)3+ClO-+OH-→ +□:
+□:_____________________________ 。
(4)ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O
①请用双线桥表示反应中电子转移的方向和数目: 2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O:______________________ 。
②上述反应中,当生成1 mol ClO2分子时,转移电子的物质的量为:___________ mol。
③Cl2和ClO2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-,则ClO2和Cl2相同质量时,ClO2的消毒能力是Cl2的___________ 倍。
(5)ClO2在工业上的一种生产工艺如图所示:
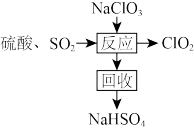
请写出“反应”步骤中生成CO2的化学方程式:________________ 。
(1)次氯酸钠是最普通的家庭洗涤中的“氯”漂白剂和消毒剂。已知“84消毒液”的主要成分是次氯酸钠,在清洗卫生间时,若将“洁厕灵”与“84消毒液”混合使用会发生氯气中毒事件。请从氧化还原反应的角度分析原因:
(2)漂白粉的有效成分是:
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下述离子方程式Fe(OH)3+ClO-+OH-→
 +□:
+□:(4)ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O
①请用双线桥表示反应中电子转移的方向和数目: 2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O:
②上述反应中,当生成1 mol ClO2分子时,转移电子的物质的量为:
③Cl2和ClO2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-,则ClO2和Cl2相同质量时,ClO2的消毒能力是Cl2的
(5)ClO2在工业上的一种生产工艺如图所示:

请写出“反应”步骤中生成CO2的化学方程式:
您最近一年使用:0次
2020-11-29更新
|
258次组卷
|
2卷引用:广东省广州市育才中学2020-2021学年高一上学期期中考试化学试题
8 . 镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______ ,“焙烧”时矿渣中部分FeO反应生成Fe2(SO4)3的化学方程式为_____ 。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为_________ ,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______ (填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的___ 倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为_________ 。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) =_______ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是______ 。


已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) =
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是

您最近一年使用:0次
名校
9 . 明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如图:
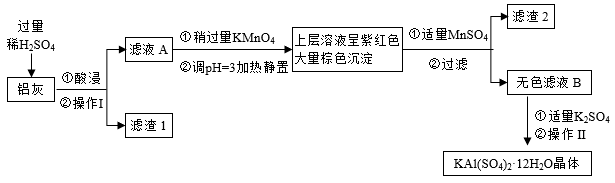
回答下列问题:
(1)明矾净水的原理是____________ (用离子方程式表示)。
(2)操作Ⅰ是________ ,操作Ⅱ是蒸发浓缩、__________ 、过滤、__________ 、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是________ (只用一种试剂)。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO 转化为Mn2+):
转化为Mn2+):______ 。
(5)已知:在pH=3、加热条件下,MnO 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________ 。滤渣2含有的物质是_______ 。

回答下列问题:
(1)明矾净水的原理是
(2)操作Ⅰ是
(3)检验滤液A中是否存在Fe2+的试剂是
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO
 转化为Mn2+):
转化为Mn2+):(5)已知:在pH=3、加热条件下,MnO
 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
您最近一年使用:0次
2020-09-15更新
|
177次组卷
|
2卷引用:广东省云浮市郁南县蔡朝焜纪念中学2021届高三9月月考化学试题
解题方法
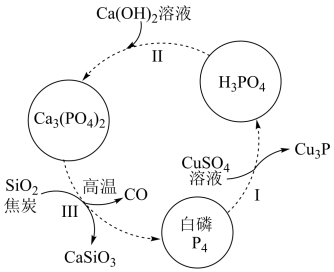
10 . 磷及其化合物在工农业生产中具有重要用途。请回答下列问题:
(1)如图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为__________ ,过程Ⅲ的化学方程式为_________ 。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如下图所示:

①复合材料中加入碳单质的作用是_________ ;
②A的主要成分为V2(C2O4)3,该步反应的化学方程式为_________ ;
③已知常温下,Li2CO3微溶于水, LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,_________ ,得到 LiHCO3溶液,控温加热使LiHCO3分解形成Li2CO3沉淀,过滤,洗涤,干燥得到Li2CO3纯品。
④锂离子电池是一种二次电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3=Li3V2(PO4)3+C6,则电池充电时阴极的电极反应式为_________ 。
(1)如图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如下图所示:

①复合材料中加入碳单质的作用是
②A的主要成分为V2(C2O4)3,该步反应的化学方程式为
③已知常温下,Li2CO3微溶于水, LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,
④锂离子电池是一种二次电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3=Li3V2(PO4)3+C6,则电池充电时阴极的电极反应式为
您最近一年使用:0次



