名校
解题方法
1 . 如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:_____ ,体现了c的_____ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是_____ (填化学式)。
(3)将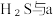 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为_____ 。
(4)配平下列反应:_____ 。
_____
(5)为防止多余的a气体污染环境,应将尾气通入_____ 溶液中;
(6)将足量的 溶液中,下列说法正确的是
溶液中,下列说法正确的是_____ (填字母)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀

(7)将 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为_____ 。 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:_____ 。
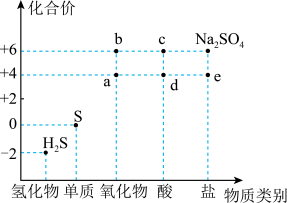
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是
(3)将
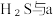 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应:
_____

(5)为防止多余的a气体污染环境,应将尾气通入
(6)将足量的
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(7)将
 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为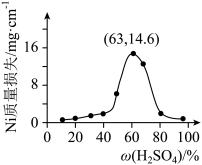
 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近半年使用:0次
2 . 回答下列问题
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:

(1)图2中的N对应图1中物质的化学式为_______ 。
(2)X与Z反应中氧化剂与还原剂的物质的量之比为_______ 。
(3) 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为_______ 。
(4)铜和M的浓溶液反应生成Z的化学方程式为_______ ;若要证明该反应产物有 ,需要采取的操作是
,需要采取的操作是_______ 。
(Ⅱ)氮氧化物( )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。
方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式_______ 。
方案2:
在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
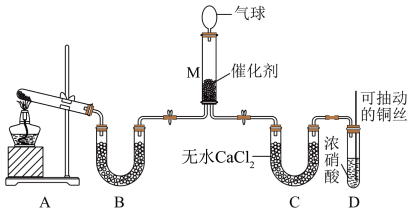
(6)用装置A制备 ,反应的化学方程式为
,反应的化学方程式为_______ ;装置B内的试剂是_______ 。
(7)装置D中发生反应的离子方程式是_______ ;可抽动铜丝的优点是_______ 。
(8)在装置M中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中 和
和 的物质的量之比为
的物质的量之比为_______ 。
方案3:
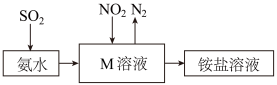
(9)工业生产中利用氨水吸收少量 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是_______ 。
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:

(1)图2中的N对应图1中物质的化学式为
(2)X与Z反应中氧化剂与还原剂的物质的量之比为
(3)
 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为(4)铜和M的浓溶液反应生成Z的化学方程式为
 ,需要采取的操作是
,需要采取的操作是(Ⅱ)氮氧化物(
 )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式
方案2:
在一定条件下
 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
(6)用装置A制备
 ,反应的化学方程式为
,反应的化学方程式为(7)装置D中发生反应的离子方程式是
(8)在装置M中
 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中 和
和 的物质的量之比为
的物质的量之比为方案3:
(9)工业生产中利用氨水吸收少量
 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是
您最近半年使用:0次
3 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
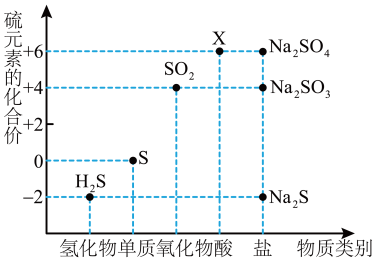
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的___________ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(3)将 与
与 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)配平下列反应_________________ 。
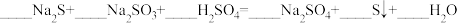
(5)一定条件下,在 密闭容器中发生反应:
密闭容器中发生反应: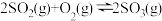 ,开始时加入
,开始时加入 、
、 、
、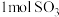 ,在
,在 末测得
末测得 的物质的量是
的物质的量是 ,用
,用 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为___________ ,在 末
末 的浓度为
的浓度为___________ 。若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”)
①升高温度,化学反应速率___________ ;
②再充入 ,化学反应速率
,化学反应速率___________ ;
③将容器体积变为 ,化学反应速率
,化学反应速率___________ 。

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将
 与
与 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应
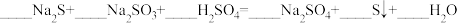
(5)一定条件下,在
 密闭容器中发生反应:
密闭容器中发生反应: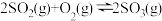 ,开始时加入
,开始时加入 、
、 、
、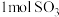 ,在
,在 末测得
末测得 的物质的量是
的物质的量是 ,用
,用 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为 末
末 的浓度为
的浓度为①升高温度,化学反应速率
②再充入
 ,化学反应速率
,化学反应速率③将容器体积变为
 ,化学反应速率
,化学反应速率
您最近半年使用:0次
名校
4 . I.某同学通过查阅资料得知,常温下 和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取
和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取 并探究其有关性质:
并探究其有关性质:

(1)装置A中存在一处错误,改正这处错误:_______ 。有同学认为,上述装置还有另外一处的缺陷,并给出了改进措施。该改进措施是_______ 。
(2)配平装置A中发生反应的化学方程式: _______
_______ _______
_______ _______
_______ _______
_______
_______ 。
(3)为除去氯气中的氯化氢,需要在装置A、B之间添加装置E,其中加入_______ (填试剂名称),为了探究有色布条褪色的原理,需再添加装置E,其中加入浓硫酸,在整套装置中的添加位置为_______ (填序号)。
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
II.利用“价—类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。回答下列问题:
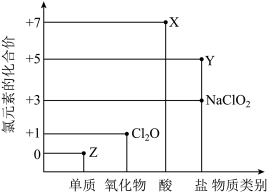
(4)X的电离方程式为_______ 。
(5)Y可用于实验室制 ,其焰色试验为紫色,则Y含有的化学键类型为
,其焰色试验为紫色,则Y含有的化学键类型为_______ ;Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,生成的两种盐的化学式分别为_______ 。
 和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取
和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取 并探究其有关性质:
并探究其有关性质:
(1)装置A中存在一处错误,改正这处错误:
(2)配平装置A中发生反应的化学方程式:
 _______
_______ _______
_______ _______
_______ _______
_______
(3)为除去氯气中的氯化氢,需要在装置A、B之间添加装置E,其中加入
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
II.利用“价—类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。回答下列问题:

(4)X的电离方程式为
(5)Y可用于实验室制
 ,其焰色试验为紫色,则Y含有的化学键类型为
,其焰色试验为紫色,则Y含有的化学键类型为
您最近半年使用:0次
2023-03-28更新
|
282次组卷
|
3卷引用:天津市新华中学2022-2023学年高一上学期期末考试化学试题
天津市新华中学2022-2023学年高一上学期期末考试化学试题(已下线)专题05 氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)天津市第五十四中学2023-2024学年高一上学期期末化学试卷
名校
5 . Ⅰ.如图是氮元素的各种价态与物质类别的对应关系:
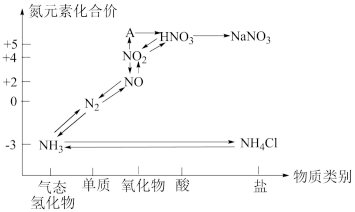
(1)根据A对应的化合价和物质类别,A为___________ (写分子式,下同),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ 。
(2)浓、稀HNO3的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ ,反应的离子方程式:___________ 。
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:___________ 。
Ⅱ.为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。(固定装置已略去)
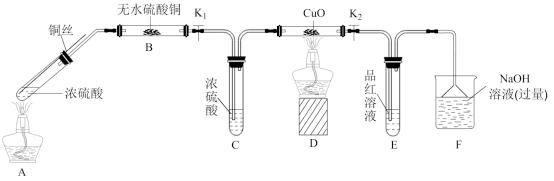
(1)B装置中的现象是___________ 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是___________ 。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是___________ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀HNO3的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
Ⅱ.为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。(固定装置已略去)

(1)B装置中的现象是
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
您最近半年使用:0次
6 . 门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。回答下列问题:
Ⅰ. “类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
(1)铝是一种活泼金属,工业上采用电解熔融Al2O3制备金属Al。电解反应方程式为2Al2O3 4Al+3O2↑,加入冰晶石的目的是
4Al+3O2↑,加入冰晶石的目的是_______ 。Al可以与NaOH溶液反应生成Na[Al(OH)4]与H2,该反应的离子方程式为_______ 。
(2)镓与铝同主族,且位于铝的下一周期,则镓的原子结构示意图为_______ 。
(3)废弃的含GaAs的材料可以用浓硝酸溶解,放出红棕色气体,同时生成H3AsO4和Ga(NO3)3,该反应的化学方程式为_______ 。
Ⅱ.门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
(4)硅是应用最为广泛的半导体材料,写出高纯硅的两种用途:_______ 、_______ 。
(5)写出SiCl4的电子式:_______
(6)硅和锗单质分别与H2反应时,反应较难进行的是_______ (填“硅”或“锗”)。
Ⅰ. “类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
(1)铝是一种活泼金属,工业上采用电解熔融Al2O3制备金属Al。电解反应方程式为2Al2O3
 4Al+3O2↑,加入冰晶石的目的是
4Al+3O2↑,加入冰晶石的目的是(2)镓与铝同主族,且位于铝的下一周期,则镓的原子结构示意图为
(3)废弃的含GaAs的材料可以用浓硝酸溶解,放出红棕色气体,同时生成H3AsO4和Ga(NO3)3,该反应的化学方程式为
Ⅱ.门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
(4)硅是应用最为广泛的半导体材料,写出高纯硅的两种用途:
(5)写出SiCl4的电子式:
(6)硅和锗单质分别与H2反应时,反应较难进行的是
您最近半年使用:0次
名校
解题方法
7 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示:
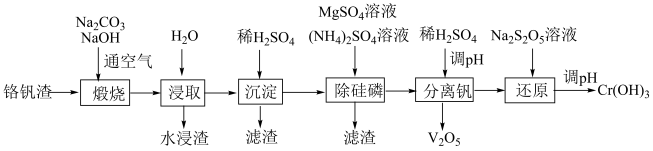
已知:i)最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在;
存在;
ii)pH<7时,硅元素以H2SiO3形式存在;
iii)pH在4-12之间,铝元素以Al(OH)3形式存在。
回答下列问题:
(1)Cr元素的价电子轨道表示式_________ 。
(2)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为______ (填化学式)。
(3)水浸渣中主要物质为______ (填化学式)。
(4)“沉淀”步骤调pH到弱碱性,主要除去的杂质为_______ (填化学式)。
(5)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH以达到最好的除杂效果,下列说法中,正确的是______ 。
a.若pH过小,磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀
b.若pH过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若pH过大,会导致镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质
d.若pH过大,溶液中铵根离子浓度增大,降低导致MgNH4PO4无法完全沉淀
(6)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有______ (填标号)。
A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为________ 。

已知:i)最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在;
存在;ii)pH<7时,硅元素以H2SiO3形式存在;
iii)pH在4-12之间,铝元素以Al(OH)3形式存在。
回答下列问题:
(1)Cr元素的价电子轨道表示式
(2)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(3)水浸渣中主要物质为
(4)“沉淀”步骤调pH到弱碱性,主要除去的杂质为
(5)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH以达到最好的除杂效果,下列说法中,正确的是
a.若pH过小,磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀
b.若pH过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若pH过大,会导致镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质
d.若pH过大,溶液中铵根离子浓度增大,降低导致MgNH4PO4无法完全沉淀
(6)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近半年使用:0次
2023-10-27更新
|
359次组卷
|
2卷引用:天津市南开中学2023-2024学年高三上学期第一次月考化学试题
名校
解题方法
8 . 中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如图所示。
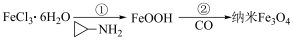
下列有关说法正确的是
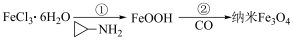
下列有关说法正确的是
| A.可用稀硫酸和K3[Fe(CN)6]鉴别Fe3O4和FeO |
B.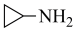 在反应①中的作用是促进氯化铁水解 在反应①中的作用是促进氯化铁水解 |
| C.将制得的纳米Fe3O4均匀分散在水中不会产生丁达尔效应 |
D.反应②发生的化学方程式为6FeOOH+3CO 2Fe3O4+3H2O+3CO2 2Fe3O4+3H2O+3CO2 |
您最近半年使用:0次
2023-09-24更新
|
73次组卷
|
2卷引用:天津市2023-2024学年天津一中高三年级第二次月考化学
解题方法
9 . Cr、Fe、Co、Ni、Zn等金属元素的合金及其相关化合物用途非常广泛。
(1)Cr元素在周期表中的位置______ ;其原子核外未成对电子数为______ 。
(2)FeSO4可用作污水处理的混凝剂,硫元素的原子核外有______ 种不同能量的电子, 的空间构型为
的空间构型为______ 。
(3)Co、Ni两种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为______ 。(用化学式表示)
(4) 是铬(Ⅲ)的一种配合物,1mol
是铬(Ⅲ)的一种配合物,1mol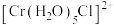 中含有
中含有 键的数目为
键的数目为______ 。
(5)+6价铬的化合物毒性较大,常用 将酸性废液中的
将酸性废液中的 还原成
还原成 ,该反应的离子方程式为
,该反应的离子方程式为______ 。
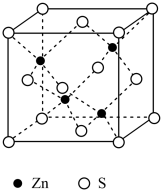
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有______ 个。晶胞棱长为a pm,密度为______  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)Cr元素在周期表中的位置
(2)FeSO4可用作污水处理的混凝剂,硫元素的原子核外有
 的空间构型为
的空间构型为(3)Co、Ni两种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为
(4)
 是铬(Ⅲ)的一种配合物,1mol
是铬(Ⅲ)的一种配合物,1mol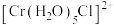 中含有
中含有 键的数目为
键的数目为(5)+6价铬的化合物毒性较大,常用
 将酸性废液中的
将酸性废液中的 还原成
还原成 ,该反应的离子方程式为
,该反应的离子方程式为(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有
 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近半年使用:0次
名校
10 . 含氮化合物在工农业有着重要的用途。
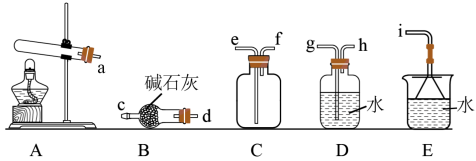
Ⅰ.氨气的制备:
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为___________ 。
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→___________ 按气流方向,用小写字母表示)。
(3)请写出氨气的检验方法:___________ 。
Ⅱ. 经一系列反应可以得到
经一系列反应可以得到 。
。
(4)①中, 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是___________ 。
(5)NO的检验方法是:___________ 。
Ⅲ.研究 、
、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。
(6)选择性催化还原技术(SCR)可使NOx与 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:___________ 。
(7)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应: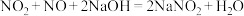 ;
; 。若33.6mL(标况下)氮氧化物(只含NO和
。若33.6mL(标况下)氮氧化物(只含NO和 )与VmL
)与VmL NaOH溶液恰好完全反应,则V=
NaOH溶液恰好完全反应,则V=___________ 。

Ⅰ.氨气的制备:
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→
(3)请写出氨气的检验方法:
Ⅱ.
 经一系列反应可以得到
经一系列反应可以得到 。
。
(4)①中,
 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是(5)NO的检验方法是:
Ⅲ.研究
 、
、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。(6)选择性催化还原技术(SCR)可使NOx与
 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:(7)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应:
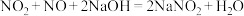 ;
; 。若33.6mL(标况下)氮氧化物(只含NO和
。若33.6mL(标况下)氮氧化物(只含NO和 )与VmL
)与VmL NaOH溶液恰好完全反应,则V=
NaOH溶液恰好完全反应,则V=
您最近半年使用:0次
2023-03-17更新
|
478次组卷
|
2卷引用:天津市第一中学2022-2023学年高一下学期3月月考化学试题



