名校
1 . 氧化还原反应是一类重要的化学反应,在工农业生产、日常生活中都有广泛的用途。回答以下问题:
Ⅰ、高铁酸钠 是水处理过程中的一种新型的绿色多功能净水剂。其净水过程中所发生的化学反应主要为
是水处理过程中的一种新型的绿色多功能净水剂。其净水过程中所发生的化学反应主要为 。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
(1)高铁酸钠 属于
属于___________ (“酸”、“碱”、“盐”或“氧化物”),其中铁的化合价为___________ 价。
(2)将上述反应的化学方程式改写成离子方程式:___________ 。
(3)①实验室制得的氢氧化铁胶体中,氢氧化铁胶体粒子直径大小的范围是___________ 。
②某同学按要求制备了 胶体,但是他又向
胶体,但是他又向 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化。
溶液,结果出现了一系列变化。
现象1:先出现沉淀,原因是___________ 。
现象2:随后沉淀溶解,此反应的离子方程式是___________ 。
II、亚硝酸钠( )像食盐一样有咸味,但有很强的毒性,误食
)像食盐一样有咸味,但有很强的毒性,误食 会使人中毒。已知亚硝酸钠能发生如下反应:
会使人中毒。已知亚硝酸钠能发生如下反应: (未配平)。
(未配平)。
(4) 表现的性质是___________(填字母)
表现的性质是___________(填字母)
(5)利用氧化还原反应化合价升降总数相等配平该方程式:___________ 。
___________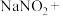 ___________
___________ ___________
___________ ___________
___________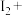 ___________
___________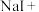 ___________
___________
Ⅰ、高铁酸钠
 是水处理过程中的一种新型的绿色多功能净水剂。其净水过程中所发生的化学反应主要为
是水处理过程中的一种新型的绿色多功能净水剂。其净水过程中所发生的化学反应主要为 。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:(1)高铁酸钠
 属于
属于(2)将上述反应的化学方程式改写成离子方程式:
(3)①实验室制得的氢氧化铁胶体中,氢氧化铁胶体粒子直径大小的范围是
②某同学按要求制备了
 胶体,但是他又向
胶体,但是他又向 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化。
溶液,结果出现了一系列变化。现象1:先出现沉淀,原因是
现象2:随后沉淀溶解,此反应的离子方程式是
II、亚硝酸钠(
 )像食盐一样有咸味,但有很强的毒性,误食
)像食盐一样有咸味,但有很强的毒性,误食 会使人中毒。已知亚硝酸钠能发生如下反应:
会使人中毒。已知亚硝酸钠能发生如下反应: (未配平)。
(未配平)。(4)
 表现的性质是___________(填字母)
表现的性质是___________(填字母)| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
___________
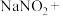 ___________
___________ ___________
___________ ___________
___________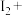 ___________
___________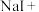 ___________
___________
您最近一年使用:0次
名校
解题方法
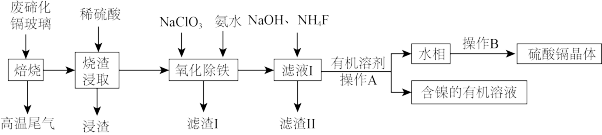
2 . 碲化镉玻璃中主要含有CdTe(其中含有少量Fe、Ni、Mg、Si、O等元素组成的化合物),工业上利用废弃碲化镉(CdTe)玻璃回收其中金属的工艺流程如下。
已知:①常温时,有关物质的 如下表。
如下表。
②当溶液中离子浓度小于 时,可认为沉淀完全。
时,可认为沉淀完全。
回答下列问题:
(1)在“焙烧”时为提高效率可采用的措施有_______ (答出一条即可)。写出“浸渣”的工业用途:_______ 。
(2)实验室中,“操作A”需要的玻璃仪器有_______ 。“高温尾气”中的 在水溶液中可用
在水溶液中可用 将其还原为Te单质,写出该反应的化学方程式:
将其还原为Te单质,写出该反应的化学方程式:_______ 。
(3)“氧化除铁”步骤中可以先调节pH为5,然后再加入 ,则此时
,则此时 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(4)测得“滤液I”中 浓度为
浓度为 ,取1L滤液,则至少加入
,取1L滤液,则至少加入_______ g 固体才能使
固体才能使 沉淀完全。
沉淀完全。
(5)取1吨含碲化镉80%的废弃玻璃,最终回收得到0.64吨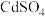 ,则硫酸镉的回收率为
,则硫酸镉的回收率为_______ (保留三位有效数字)。

已知:①常温时,有关物质的
 如下表。
如下表。 |  |  |  |  |
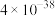 | 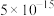 | 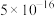 |  | 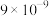 |
 时,可认为沉淀完全。
时,可认为沉淀完全。回答下列问题:
(1)在“焙烧”时为提高效率可采用的措施有
(2)实验室中,“操作A”需要的玻璃仪器有
 在水溶液中可用
在水溶液中可用 将其还原为Te单质,写出该反应的化学方程式:
将其还原为Te单质,写出该反应的化学方程式:(3)“氧化除铁”步骤中可以先调节pH为5,然后再加入
 ,则此时
,则此时 被氧化的离子方程式为
被氧化的离子方程式为(4)测得“滤液I”中
 浓度为
浓度为 ,取1L滤液,则至少加入
,取1L滤液,则至少加入 固体才能使
固体才能使 沉淀完全。
沉淀完全。(5)取1吨含碲化镉80%的废弃玻璃,最终回收得到0.64吨
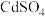 ,则硫酸镉的回收率为
,则硫酸镉的回收率为
您最近一年使用:0次
2022-11-04更新
|
1356次组卷
|
4卷引用:广东省2023届高三一轮复习联考(二)广东卷化学试题
广东省2023届高三一轮复习联考(二)广东卷化学试题广东省部分学校2022-2023学年高三上学期一轮复习联考(二)化学试题(已下线)热点情景汇编-专题十 工艺流程中的新工艺福建省惠安第一中学2022-2023学年高三上学期第三次月考化学试题
名校
解题方法
3 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的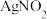 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______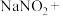 _______KI+_______=_______
_______KI+_______=_______ _______
_______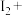 _______
_______ _______
_______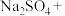 _______
_______
(1)请完成该化学方程式并配平_______ 。
(2)上述反应的还原剂为_______ ,氧化产物与还原产物的个数比为_______ 。
(3)写出 与
与 反应的离子方程式:
反应的离子方程式:_______ 。
(4)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列_______(填字母)反应中
表现出的性质与下列_______(填字母)反应中 表现出的性质相同。
表现出的性质相同。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:_______ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的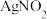 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______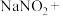 _______KI+_______=_______
_______KI+_______=_______ _______
_______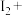 _______
_______ _______
_______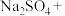 _______
_______
(1)请完成该化学方程式并配平
(2)上述反应的还原剂为
(3)写出
 与
与 反应的离子方程式:
反应的离子方程式:(4)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列_______(填字母)反应中
表现出的性质与下列_______(填字母)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C.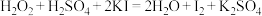 |
D.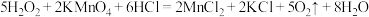 |
您最近一年使用:0次
2022-11-16更新
|
203次组卷
|
2卷引用:广东省深圳市罗湖区翠园中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
4 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
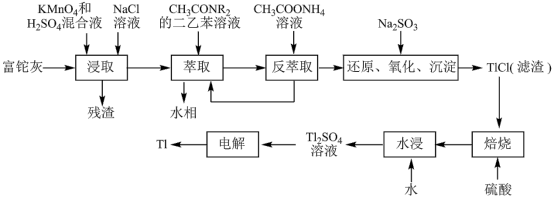
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
2022-04-10更新
|
761次组卷
|
2卷引用:广东实验中学2022届高三下学期三模考前练笔化学试题
名校
5 . 认识氧化物的性质,能帮助我们更好地认识自然和保护环境。
(1)摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
①Si在元素周期表中的位置是____ 。
②根据用途推测SiO2在水中的溶解性:____ (填“易溶”或“难溶”)。
③比较酸性强弱:H2SO4____ (填“>”或“<”)H2SiO3。
(2)SO2和NO2的任意排放均会污染环境。
①从物质分类角度看,SO2属于酸性氧化物,能与NaOH溶液反应生成亚硫酸盐。写出SO2与过量的NaOH溶液反应的离子方程式:____ 。
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。则反应SO2+Br2+2H2O=H2SO4+2HBr中体现了SO2的____ (填“氧化性”或“还原性”)。
③NO2是一种____ 色的有毒气体,易溶于水,与水反应有无色气体生成,写出NO2与水反应的化学方程式:____ ,反应中每生成标准状况下的气体2.24L,则转移电子的物质的量为____ mol。
(1)摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
①Si在元素周期表中的位置是
②根据用途推测SiO2在水中的溶解性:
③比较酸性强弱:H2SO4
(2)SO2和NO2的任意排放均会污染环境。
①从物质分类角度看,SO2属于酸性氧化物,能与NaOH溶液反应生成亚硫酸盐。写出SO2与过量的NaOH溶液反应的离子方程式:
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。则反应SO2+Br2+2H2O=H2SO4+2HBr中体现了SO2的
③NO2是一种
您最近一年使用:0次
2022-03-23更新
|
410次组卷
|
4卷引用:广东省名校联盟2021-2022学年高一下学期4月大联考化学试题
名校
解题方法
6 . 砷(As)是第VA族元素,它在自然界中的含量不高,但人类认识它的历史很长,砷的某些化合物具有独特的性质与用途,如 在医药、电子等领域有重要应用,我国科学家研究发现砒霜(
在医药、电子等领域有重要应用,我国科学家研究发现砒霜( )可用来治疗早期幼粒白血病。
)可用来治疗早期幼粒白血病。
(1) 中砷的化合价为
中砷的化合价为___________ ,从物质化学性质角度看, 不可能是
不可能是___________ (填“酸”“碱”或“两”)性氧化物。
(2)某化工厂利用含硫化砷(As2S3)的废料制取 (微溶于水)的流程如下。
(微溶于水)的流程如下。
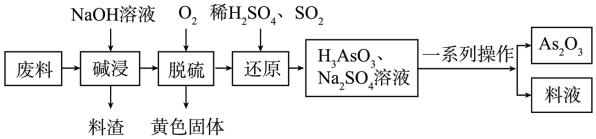
①写出两种能提高“碱浸”速率的方法:___________ 。
②碱浸液中溶质主要为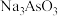 、
、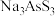 ,脱硫后以
,脱硫后以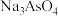 的形式存在,写出
的形式存在,写出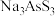 与
与 反应的化学方程式:
反应的化学方程式:___________ 。还原后砷以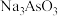 形式存在,则通入
形式存在,则通入 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为___________ 。
③还原后加热溶液, 分解为
分解为 ,结晶得到粗
,结晶得到粗 。
。 在不同温度和不同浓度硫酸中的溶解度度(S)曲线如下图所示。
在不同温度和不同浓度硫酸中的溶解度度(S)曲线如下图所示。
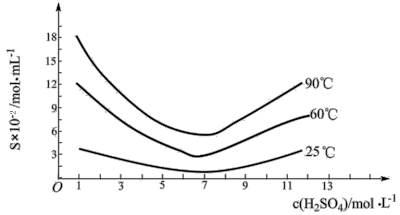
为了提高粗 的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为___________ 。
④在工业生产中,最后一步所得滤液可循环使用,其目的是___________ 。
(3)砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。砷的常见氧化物有 和
和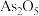 ,其中
,其中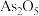 热稳定性差。根据下图写出
热稳定性差。根据下图写出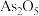 分解为
分解为 的热化学方程式
的热化学方程式___________ 。

 在医药、电子等领域有重要应用,我国科学家研究发现砒霜(
在医药、电子等领域有重要应用,我国科学家研究发现砒霜( )可用来治疗早期幼粒白血病。
)可用来治疗早期幼粒白血病。(1)
 中砷的化合价为
中砷的化合价为 不可能是
不可能是(2)某化工厂利用含硫化砷(As2S3)的废料制取
 (微溶于水)的流程如下。
(微溶于水)的流程如下。
①写出两种能提高“碱浸”速率的方法:
②碱浸液中溶质主要为
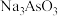 、
、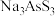 ,脱硫后以
,脱硫后以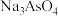 的形式存在,写出
的形式存在,写出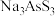 与
与 反应的化学方程式:
反应的化学方程式: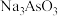 形式存在,则通入
形式存在,则通入 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为③还原后加热溶液,
 分解为
分解为 ,结晶得到粗
,结晶得到粗 。
。 在不同温度和不同浓度硫酸中的溶解度度(S)曲线如下图所示。
在不同温度和不同浓度硫酸中的溶解度度(S)曲线如下图所示。
为了提高粗
 的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为④在工业生产中,最后一步所得滤液可循环使用,其目的是
(3)砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。砷的常见氧化物有
 和
和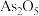 ,其中
,其中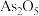 热稳定性差。根据下图写出
热稳定性差。根据下图写出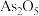 分解为
分解为 的热化学方程式
的热化学方程式
您最近一年使用:0次
2022-09-19更新
|
291次组卷
|
2卷引用:广东省普宁二中实验学校2022-2023学年高二上学期第一次月考化学试题
7 . 废旧锂离子电池经处理得到的正极活性粉体中含有Li2O、NiO、Co2O3、MnO2、Fe、C、Al等。从废旧锂离子电池中制备正极材料的前驱体(NiCO3·CoCO3·MnCO3)的工艺流程如图:

(1)“酸浸”温度为85℃,活性粉体中的钴(以Co2O3表示)还原浸出的化学方程式为____ ,该反应的还原剂是____ 。可用盐酸代替H2SO4和H2O2的混合液,但缺点是____ 。
(2)“除铁”时生成的黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,则x:y:m:n=1:3:2:____ 。
(3)“除铝”时反应的离子方程式为____ 。
(4)从滤液中可提取____ (任写一种),其用途是____ 。

(1)“酸浸”温度为85℃,活性粉体中的钴(以Co2O3表示)还原浸出的化学方程式为
(2)“除铁”时生成的黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,则x:y:m:n=1:3:2:
(3)“除铝”时反应的离子方程式为
(4)从滤液中可提取
您最近一年使用:0次
2022-01-23更新
|
241次组卷
|
2卷引用:广东省广州市海珠区2021-2022学年高一上学期期末考试化学试题
名校
8 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,以下是氯元素的“价类二维图”的部分信息。请回答下列问题:

(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。
(2)已知高氯酸(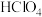 )是强酸,写出高氯酸与铁反应的离子方程式
)是强酸,写出高氯酸与铁反应的离子方程式_______ 。
(3)氯气既有氧化性又有还原性,结合上图说明理由_______ 
(4)实验室可用二氧化锰与浓盐酸在加热条件下制得氯气。写出该反应的化学方程式_______ ,该反应中盐酸表现_______ (填字母)。
A.酸性 B.氧化性 C.还原性 D. 挥发性
(5)84消毒液使用说明中特别提醒不可与洁厕灵混合使用,否则会产生氯气,有关反应方程式为 ,下列有关该反应说法
,下列有关该反应说法不正确 的是_______。
(6)某游泳池常用 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的化学方程式
,写出相应的化学方程式_______ 。

(1)根据图中信息写出Y、Z的化学式
(2)已知高氯酸(
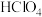 )是强酸,写出高氯酸与铁反应的离子方程式
)是强酸,写出高氯酸与铁反应的离子方程式(3)氯气既有氧化性又有还原性,结合上图说明理由

(4)实验室可用二氧化锰与浓盐酸在加热条件下制得氯气。写出该反应的化学方程式
A.酸性 B.氧化性 C.还原性 D. 挥发性
(5)84消毒液使用说明中特别提醒不可与洁厕灵混合使用,否则会产生氯气,有关反应方程式为
 ,下列有关该反应说法
,下列有关该反应说法| A.n(氧化剂):n(还原剂)=1:1 | B.n(氧化剂):n(还原剂)=1:2 |
C.氧化性: | D. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的化学方程式
,写出相应的化学方程式
您最近一年使用:0次
2022-03-20更新
|
1086次组卷
|
3卷引用:广东省江门市第二中学2022-2023学年高一上学期期中考试化学试题
广东省江门市第二中学2022-2023学年高一上学期期中考试化学试题河北省三河市第二中学2021-2022学年高一上学期期末考试化学试题(已下线)第二章《 海水中的重要元素----钠和氯》基础过关单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
9 . 碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H+、Cl-)制备,其制备过程如下:

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
回答下列问题:
(1)NaClO3中氯元素的化合价为_______ 。
(2)完成反应A的离子方程式:ClO3-+Fe2++_______ =Cl-+ Fe3+ + _______(将离子方程式补完整后整道写于答题卡)_______ 。
(3)滤渣的成分是_______ ,调节pH的范围是_______ ,选用的试剂较好的是_______ (填以下字母编号)。
A.硫酸 B.氨水 C.氧化铜 D.氢氧化钠
(4)滤液中回收的副产物主要是NaCl,常用于氯碱工业,电解饱和食盐水的原理示意图如下所示,溶液A的溶质是_______ ,电解时用盐酸控制阳极区pH在2~3,用平衡移动原理解释盐酸的作用_______ 。


Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物 质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(1)NaClO3中氯元素的化合价为
(2)完成反应A的离子方程式:ClO3-+Fe2++_______ =Cl-+ Fe3+ + _______(将离子方程式补完整后整道写于答题卡)
(3)滤渣的成分是
A.硫酸 B.氨水 C.氧化铜 D.氢氧化钠
(4)滤液中回收的副产物主要是NaCl,常用于氯碱工业,电解饱和食盐水的原理示意图如下所示,溶液A的溶质是

您最近一年使用:0次
10 . I.回答下列问题
(1)配平下列方程式:___________
___________KMnO4+___________HCl=___________KCl+___________MnCl2+___________Cl2↑+___________H2O
Ⅱ.氯气用途广泛,实验室常用MnO2和浓盐酸加热制备氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)用双线桥在方程式上表示电子转移的情况___________
(3)若上述反应生成了7.1gCl2,则发生氧化还原反应HCl的质量为___________ g
(4)常温下,将Cl2通入NaOH溶液中可得到漂白液,离子方程式为:___________
(5)科学家经研究发现,将Cl2通入填充有固体NaClO2的反应柱内,二者反应可制得用于自来水消毒的ClO2,该反应的还原产物为___________ (写化学式)
(1)配平下列方程式:
___________KMnO4+___________HCl=___________KCl+___________MnCl2+___________Cl2↑+___________H2O
Ⅱ.氯气用途广泛,实验室常用MnO2和浓盐酸加热制备氯气:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(2)用双线桥在方程式上表示电子转移的情况
(3)若上述反应生成了7.1gCl2,则发生氧化还原反应HCl的质量为
(4)常温下,将Cl2通入NaOH溶液中可得到漂白液,离子方程式为:
(5)科学家经研究发现,将Cl2通入填充有固体NaClO2的反应柱内,二者反应可制得用于自来水消毒的ClO2,该反应的还原产物为
您最近一年使用:0次



