名校
1 . 氧化还原反应在日常生活和工业生产中有重要应用。
I. 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: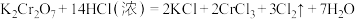 。
。
(1)该反应中被氧化的元素是_______ ,还原产物是_______ 。
(2)该反应中氧化剂与还原剂的个数比为_______ 。
(3)生成标准状况下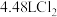 ,转移的电子个数为
,转移的电子个数为_______ (用 表示)。
表示)。
II.阅读下面一段材料并回答问题。
(4)K2FeO4中铁元素的化合价为_______ 。
(5)下列关于K2FeO4的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:_______ 。
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
I.
 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: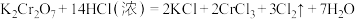 。
。(1)该反应中被氧化的元素是
(2)该反应中氧化剂与还原剂的个数比为
(3)生成标准状况下
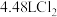 ,转移的电子个数为
,转移的电子个数为 表示)。
表示)。II.阅读下面一段材料并回答问题。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准 |
(5)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
您最近一年使用:0次
名校
解题方法
2 . 二水合磷酸二氢锰具有广泛用途,被用作防锈剂。某化工厂拟用软锰矿(含MnO2及少量FeO、Al2O3和SiO2)为原料生产Mn(H2PO4)22H2O,其工艺流程如下所示:
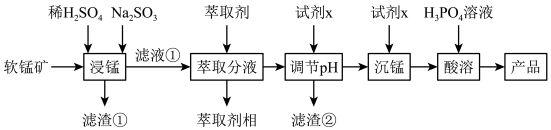
回答下列问题:
(1)滤渣①的主要成分是_______ ,适量的Na2SO3固体的作用是_______ ;
(2)浸锰时,FeO生成Fe3+的离子方程式为_________ ;
(3)可用_______ (填试剂名称)溶液检验滤液①中是否含有Fe2+;
(4)试剂X为钠的正盐,从环保、经济角度,X最好为_______ (写化学式);
(5)“沉锰”后需要过滤、洗涤沉淀,检验该沉淀洗涤干净的方法是______ ;
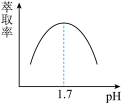
(6)“萃取分液”时,Fe3+的萃取率与pH的关系如图,如pH>1.7后,随pH增大,Fe3+萃取率下降的原因是_______ 。

回答下列问题:
(1)滤渣①的主要成分是
(2)浸锰时,FeO生成Fe3+的离子方程式为
(3)可用
(4)试剂X为钠的正盐,从环保、经济角度,X最好为
(5)“沉锰”后需要过滤、洗涤沉淀,检验该沉淀洗涤干净的方法是
(6)“萃取分液”时,Fe3+的萃取率与pH的关系如图,如pH>1.7后,随pH增大,Fe3+萃取率下降的原因是

您最近一年使用:0次
名校
3 . 钴的化合物种类较多,其中三氯化六氨合(III){[Co(NH3)6]C13}(M=267.5g/mol),在工业上用途广泛。实验室以活性炭作为催化剂,以H2O2作氧化剂氧化CoC12的方法制备三氯化六氨合钴。
已知:①钴单质在300℃以上易被氧气氧化,CoC12易潮解。②Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
I.CoC12的制备。

(1)B装置中盛放浓盐酸的仪器名称是_______ 。
(2)按照气体流向从左到右连接仪器的顺序为_______ →_______ →_______ 。
(3)B装置的烧瓶中发生反应的离子方程式为_______ 。
(4)实验时,要先加入浓盐酸,使B装置中开始生成氯气,待_______ (填现象)时,再加热A装置,目的是_______ 。
II.三氯化六氨合钴(III)的制备。

①先向三颈烧瓶中加入活性炭、CoCl2和NH4Cl溶液,然后滴加稍过量的浓氨水;
②冷水浴冷却至10℃以下,缓慢滴加H2O2溶液并不断搅拌;
③转移至60℃水浴中,恒温加热同时缓慢搅拌;
④冷却结晶,过滤洗涤可得三氯化六氨合钴(III){[Co(NH3)6]Cl3)粗产品。
(5)D装置中制备三氯化六氨合钴(III)的总反应化学方程式为_______ 。
III.纯度测定。
(6)称取mg粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→_______ (按顺序填序号),纯度为_______ (写出表达式)。
a.向锥形瓶中加入稍过量的KI溶液(Co3+被还原后的产物为Co2+),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为VmL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定(产物为 )
)
已知:①钴单质在300℃以上易被氧气氧化,CoC12易潮解。②Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
I.CoC12的制备。

(1)B装置中盛放浓盐酸的仪器名称是
(2)按照气体流向从左到右连接仪器的顺序为
(3)B装置的烧瓶中发生反应的离子方程式为
(4)实验时,要先加入浓盐酸,使B装置中开始生成氯气,待
II.三氯化六氨合钴(III)的制备。

①先向三颈烧瓶中加入活性炭、CoCl2和NH4Cl溶液,然后滴加稍过量的浓氨水;
②冷水浴冷却至10℃以下,缓慢滴加H2O2溶液并不断搅拌;
③转移至60℃水浴中,恒温加热同时缓慢搅拌;
④冷却结晶,过滤洗涤可得三氯化六氨合钴(III){[Co(NH3)6]Cl3)粗产品。
(5)D装置中制备三氯化六氨合钴(III)的总反应化学方程式为
III.纯度测定。
(6)称取mg粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→
a.向锥形瓶中加入稍过量的KI溶液(Co3+被还原后的产物为Co2+),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为VmL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定(产物为
 )
)
您最近一年使用:0次
2022-06-02更新
|
985次组卷
|
4卷引用:湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题
名校
解题方法
4 . 氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,但生产成本较高。不溶于酸(氢氟酸除外)。高温下氧气及水蒸气能明显腐蚀氮化硅。一种用工业硅(含少量铁、铜的单质及氧化物)和 (含少量
(含少量 )合成氮化硅的工艺流程如下:
)合成氮化硅的工艺流程如下: 净化时,铜屑的作用是
净化时,铜屑的作用是_______ ;硅胶的作用是_______ 。
(2) 可能是
可能是_______ (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(3)如何说明氮化硅产品已用水洗干净?_______ 。
(4)推测氮化硅可能有哪些用途:_______ (填字母)。
a. 制作切削刀具 b. 制作坩埚 c. 制作耐高温轴承
(5)工业上还可以采用化学气相沉积法,在 的环境中,使
的环境中,使 与
与 在高温下反应生成
在高温下反应生成 沉积在石墨表面,该反应的化学方程式为
沉积在石墨表面,该反应的化学方程式为_______ 。
 (含少量
(含少量 )合成氮化硅的工艺流程如下:
)合成氮化硅的工艺流程如下:
 净化时,铜屑的作用是
净化时,铜屑的作用是(2)
 可能是
可能是(3)如何说明氮化硅产品已用水洗干净?
(4)推测氮化硅可能有哪些用途:
a. 制作切削刀具 b. 制作坩埚 c. 制作耐高温轴承
(5)工业上还可以采用化学气相沉积法,在
 的环境中,使
的环境中,使 与
与 在高温下反应生成
在高温下反应生成 沉积在石墨表面,该反应的化学方程式为
沉积在石墨表面,该反应的化学方程式为
您最近一年使用:0次
2022-03-18更新
|
296次组卷
|
3卷引用:湖南省常德市石门县第一中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
5 . 铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)为原料生产Cr2O3的流程如下:
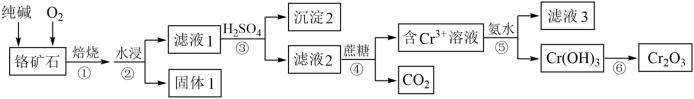
(1)为了提高焙烧速率,可采取的措施有_______ (写出2种方法)。Cr2O3在焙烧时生成Na2CrO4,写出第①步发生的所有方程式_____________ 。
(2)沉淀2的化学式为______ 。
(3)步骤③中CrO 转化成Cr2O
转化成Cr2O ,能否将硫酸换成盐酸,并说明其理由
,能否将硫酸换成盐酸,并说明其理由_______ 。
(4)步骤⑤的分离方法为______ 。滤液3中主要溶质的化学式为________ 。
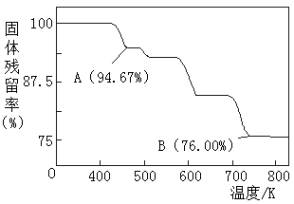
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时铬的氧化物化学式为_____________ 。

(1)为了提高焙烧速率,可采取的措施有
(2)沉淀2的化学式为
(3)步骤③中CrO
 转化成Cr2O
转化成Cr2O ,能否将硫酸换成盐酸,并说明其理由
,能否将硫酸换成盐酸,并说明其理由(4)步骤⑤的分离方法为
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时铬的氧化物化学式为

您最近一年使用:0次
名校
解题方法
6 . 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是___ (填写字母代号)
A.煤的形成
B.卫星上的太阳能电池工作
C.简单机械织布
D.我国古代烧制陶器
(2)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为___ ,并阐明H2O2被称为绿色氧化剂的理由是___ 。
(3)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
___ CuO+___ NH4Cl___ Cu+___ CuCl2+___ N2↑+___ H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是___ (填元素名称),氧化剂是___ (填化学式)。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
A.煤的形成

B.卫星上的太阳能电池工作

C.简单机械织布

D.我国古代烧制陶器

(2)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为
(3)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是
您最近一年使用:0次
7 . 硼及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠NaBH4是硼的重要化合物。
①NaBH4中B元素的化合价为______ 。
 工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为
工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______ 。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为______ 。
(2)工业上以铁硼矿 主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
主要成分为Mg2B2O5·H2O和Fe3O4,还有少量 、FeO、CaO、
、FeO、CaO、 和
和 等
等 为原料制备单质B的工艺流程如图所示:
为原料制备单质B的工艺流程如图所示:

已知:
 “浸出”时,将铁硼矿石粉碎的目的为
“浸出”时,将铁硼矿石粉碎的目的为______ 。
 滤渣1的主要成分为
滤渣1的主要成分为______ 。
 “净化除杂”时需先加H2O2溶液,其目的为
“净化除杂”时需先加H2O2溶液,其目的为______ ,然后再调节溶液的pH≈5.0的目的是______ 。
 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将 粗硼制成的BI3完全分解,生成的
粗硼制成的BI3完全分解,生成的 用0.30mol·L-1Na2S2O3溶液滴定
用0.30mol·L-1Na2S2O3溶液滴定 至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用
至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______  填“酸式”或“碱式”
填“酸式”或“碱式” 滴定管,该粗硼样品的纯度为
滴定管,该粗硼样品的纯度为______ 。
(1)硼氢化钠NaBH4是硼的重要化合物。
①NaBH4中B元素的化合价为
 工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为
工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为
(2)工业上以铁硼矿
 主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
主要成分为Mg2B2O5·H2O和Fe3O4,还有少量 、FeO、CaO、
、FeO、CaO、 和
和 等
等 为原料制备单质B的工艺流程如图所示:
为原料制备单质B的工艺流程如图所示:
已知:
| 金属离子 | Fe3+ | Al3+ |
| 开始沉淀的pH | 2.7 | 3.1 |
| 沉淀完全的pH | 3.7 | 4.9 |
 “浸出”时,将铁硼矿石粉碎的目的为
“浸出”时,将铁硼矿石粉碎的目的为 滤渣1的主要成分为
滤渣1的主要成分为 “净化除杂”时需先加H2O2溶液,其目的为
“净化除杂”时需先加H2O2溶液,其目的为 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将 粗硼制成的BI3完全分解,生成的
粗硼制成的BI3完全分解,生成的 用0.30mol·L-1Na2S2O3溶液滴定
用0.30mol·L-1Na2S2O3溶液滴定 至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用
至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用 填“酸式”或“碱式”
填“酸式”或“碱式” 滴定管,该粗硼样品的纯度为
滴定管,该粗硼样品的纯度为
您最近一年使用:0次
2020-01-04更新
|
127次组卷
|
2卷引用:湖南省常德市2020届高三上学期期末协作考试化学试题



