名校
1 . 钴的化合物种类较多,其中三氯化六氨合(III){[Co(NH3)6]C13}(M=267.5g/mol),在工业上用途广泛。实验室以活性炭作为催化剂,以H2O2作氧化剂氧化CoC12的方法制备三氯化六氨合钴。
已知:①钴单质在300℃以上易被氧气氧化,CoC12易潮解。②Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
I.CoC12的制备。

(1)B装置中盛放浓盐酸的仪器名称是_______ 。
(2)按照气体流向从左到右连接仪器的顺序为_______ →_______ →_______ 。
(3)B装置的烧瓶中发生反应的离子方程式为_______ 。
(4)实验时,要先加入浓盐酸,使B装置中开始生成氯气,待_______ (填现象)时,再加热A装置,目的是_______ 。
II.三氯化六氨合钴(III)的制备。

①先向三颈烧瓶中加入活性炭、CoCl2和NH4Cl溶液,然后滴加稍过量的浓氨水;
②冷水浴冷却至10℃以下,缓慢滴加H2O2溶液并不断搅拌;
③转移至60℃水浴中,恒温加热同时缓慢搅拌;
④冷却结晶,过滤洗涤可得三氯化六氨合钴(III){[Co(NH3)6]Cl3)粗产品。
(5)D装置中制备三氯化六氨合钴(III)的总反应化学方程式为_______ 。
III.纯度测定。
(6)称取mg粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→_______ (按顺序填序号),纯度为_______ (写出表达式)。
a.向锥形瓶中加入稍过量的KI溶液(Co3+被还原后的产物为Co2+),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为VmL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定(产物为 )
)
已知:①钴单质在300℃以上易被氧气氧化,CoC12易潮解。②Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
I.CoC12的制备。

(1)B装置中盛放浓盐酸的仪器名称是
(2)按照气体流向从左到右连接仪器的顺序为
(3)B装置的烧瓶中发生反应的离子方程式为
(4)实验时,要先加入浓盐酸,使B装置中开始生成氯气,待
II.三氯化六氨合钴(III)的制备。

①先向三颈烧瓶中加入活性炭、CoCl2和NH4Cl溶液,然后滴加稍过量的浓氨水;
②冷水浴冷却至10℃以下,缓慢滴加H2O2溶液并不断搅拌;
③转移至60℃水浴中,恒温加热同时缓慢搅拌;
④冷却结晶,过滤洗涤可得三氯化六氨合钴(III){[Co(NH3)6]Cl3)粗产品。
(5)D装置中制备三氯化六氨合钴(III)的总反应化学方程式为
III.纯度测定。
(6)称取mg粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→
a.向锥形瓶中加入稍过量的KI溶液(Co3+被还原后的产物为Co2+),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为VmL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定(产物为
 )
)
您最近一年使用:0次
2022-06-02更新
|
985次组卷
|
4卷引用:湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题
名校
2 . 二氧化氯(ClO2)是广泛应用的高效安全消毒剂。
(1)ClO2性质活泼,气体及水溶液均不能稳定存在,使用时需现场制备或用稳定剂吸收、转化。用 和
和 将ClO2转化为
将ClO2转化为 ,的反应装置如图1,已知反应放出大量的热,且温度高于60℃时
,的反应装置如图1,已知反应放出大量的热,且温度高于60℃时 分解生成
分解生成 和
和 。
。
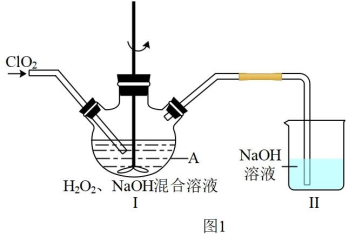
①仪器A的名称为_______ ,写出A中发生反应的化学方程式_______ 。
②实验时吸收液中 和
和 的物料比小于反应的化学计量数之比,原因可能是
的物料比小于反应的化学计量数之比,原因可能是_______ ;为提高 吸收率,在不改变吸收液的物料比的条件下,可以改进的措施是
吸收率,在不改变吸收液的物料比的条件下,可以改进的措施是_______ (写出一点即可)。
(2)用 处理过的饮用水常含有一定量的
处理过的饮用水常含有一定量的 ,饮用水中
,饮用水中 的含量可用连续碘量法进行测定。
的含量可用连续碘量法进行测定。 被
被 还原为
还原为 或
或 的转化率与溶液的
的转化率与溶液的 关系如图2所示。反应生成的
关系如图2所示。反应生成的 用标准
用标准 溶液滴定:
溶液滴定: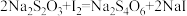 。
。
滴定过程为:准确量取VmL水样加入到碘量瓶中,调节水样的 为
为 ,加入足量的
,加入足量的 晶体,充分反应后,用
晶体,充分反应后,用 溶液滴定至淡黄色,加入淀粉溶液,滴定至第一次终点,消耗
溶液滴定至淡黄色,加入淀粉溶液,滴定至第一次终点,消耗 溶液
溶液 ;调节溶液的pH≤2.0,继续用
;调节溶液的pH≤2.0,继续用 溶液滴定至第二次终点,消耗
溶液滴定至第二次终点,消耗 溶液
溶液 。
。
①写出当pH≤2.0时, 与
与 反应的离子方程式
反应的离子方程式_______ 。
②两次滴定终点的现象_______ (填“相同”或“不相同”),根据上述数据,测得该水样中的 浓度为
浓度为_______  (用含字母的代数式表示)。
(用含字母的代数式表示)。
③滴定所用碘量瓶(如图3,瓶口为喇叭形,磨口玻璃塞与瓶口间可形成一圈水槽),加入水样和KI晶体后,盖上磨口塞并加蒸馏水液封,滴定前打开瓶塞,让水流下,并用少量水冲洗瓶塞和内壁,该操作的目的是_______ 。

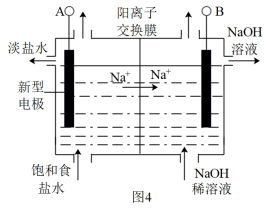
(3)图4为新型电极材料电解食盐水制取ClO2和烧碱的装置示意图。则A极为_______ 极,B极的电极反应式为_______ 。
(1)ClO2性质活泼,气体及水溶液均不能稳定存在,使用时需现场制备或用稳定剂吸收、转化。用
 和
和 将ClO2转化为
将ClO2转化为 ,的反应装置如图1,已知反应放出大量的热,且温度高于60℃时
,的反应装置如图1,已知反应放出大量的热,且温度高于60℃时 分解生成
分解生成 和
和 。
。
①仪器A的名称为
②实验时吸收液中
 和
和 的物料比小于反应的化学计量数之比,原因可能是
的物料比小于反应的化学计量数之比,原因可能是 吸收率,在不改变吸收液的物料比的条件下,可以改进的措施是
吸收率,在不改变吸收液的物料比的条件下,可以改进的措施是(2)用
 处理过的饮用水常含有一定量的
处理过的饮用水常含有一定量的 ,饮用水中
,饮用水中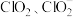 的含量可用连续碘量法进行测定。
的含量可用连续碘量法进行测定。 被
被 还原为
还原为 或
或 的转化率与溶液的
的转化率与溶液的 关系如图2所示。反应生成的
关系如图2所示。反应生成的 用标准
用标准 溶液滴定:
溶液滴定: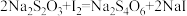 。
。
滴定过程为:准确量取VmL水样加入到碘量瓶中,调节水样的
 为
为 ,加入足量的
,加入足量的 晶体,充分反应后,用
晶体,充分反应后,用 溶液滴定至淡黄色,加入淀粉溶液,滴定至第一次终点,消耗
溶液滴定至淡黄色,加入淀粉溶液,滴定至第一次终点,消耗 溶液
溶液 ;调节溶液的pH≤2.0,继续用
;调节溶液的pH≤2.0,继续用 溶液滴定至第二次终点,消耗
溶液滴定至第二次终点,消耗 溶液
溶液 。
。①写出当pH≤2.0时,
 与
与 反应的离子方程式
反应的离子方程式②两次滴定终点的现象
 浓度为
浓度为 (用含字母的代数式表示)。
(用含字母的代数式表示)。③滴定所用碘量瓶(如图3,瓶口为喇叭形,磨口玻璃塞与瓶口间可形成一圈水槽),加入水样和KI晶体后,盖上磨口塞并加蒸馏水液封,滴定前打开瓶塞,让水流下,并用少量水冲洗瓶塞和内壁,该操作的目的是

(3)图4为新型电极材料电解食盐水制取ClO2和烧碱的装置示意图。则A极为

您最近一年使用:0次
2022-04-14更新
|
1079次组卷
|
7卷引用:湖南省常德市澧县一中2021-2022学年高三下学期期中考试化学试题
湖南省常德市澧县一中2021-2022学年高三下学期期中考试化学试题湖南省常德市澧县第一中学2021-2022学年高三下学期期中考试化学试题安徽省宣城市2022届高三第二次调研理综测试试题(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)(已下线)微专题20 新型含氯化合物的制备与性质探究(ClO2、NOCl等)-备战2023年高考化学一轮复习考点微专题湖南省攸县第一中学2022-2023学年高三第六次月考化学试题湖南省涟源市第一中学2023届高三第五次月考化学试题
名校
解题方法
3 . 用氧化焙烧-软锰矿浆吸收工艺处理砷华废渣,吸收液经净化除杂、浓缩结晶等工序可制备工业产品硫酸锰。

已知:a.砷华废渣中硫主要以FeS、FeS2、FeAsS、单质硫、硫酸盐等形态存在;铁主要以Fe2O3、FeAsS、FeS形态存在;砷主要以FeAsS、Fe3(AsO4)2等形态存在。
b.软锰矿吸收的过程中,除锰浸出外,还伴随着杂质Fe、Al、Ca、Pb和Si等的同时浸出。
c.SDD为二乙胺硫代甲酸钠。
d.溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)砷华废渣预先粉碎的目的是___ ;写出焙烧时FeAsS被氧气氧化成+3价金属氧化物和SO2的方程式:___ 。
(2)砷华废渣焙烧温度与Mn的浸出率的关系图如图:
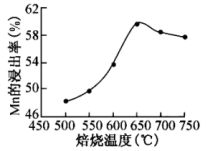
①焙烧的适宜温度为___ 。
②Mn的浸出率随着焙烧的温度升高而升高,温度高于650℃后,Mn的浸出率降低的可能原因是___ 。
(3)软锰矿浆(MnO2)吸收焙烧放出的SO2的化学方程式为___ 。
(4)加入MnO2粉末的目的是氧化Fe2+,其发生反应的离子方程式为___ 。
(5)根据实验目的调节pH的范围是___ 。
(6)称量产品MnSO4·H2O17.21g,溶于水,滴加足量的BaCl2溶液,生成的沉淀,经过过滤、洗涤、干燥后得固体,称量固体的质量为23.30g,则产品中MnSO4·H2O的质量分数为___ %(保留1位小数)。

已知:a.砷华废渣中硫主要以FeS、FeS2、FeAsS、单质硫、硫酸盐等形态存在;铁主要以Fe2O3、FeAsS、FeS形态存在;砷主要以FeAsS、Fe3(AsO4)2等形态存在。
b.软锰矿吸收的过程中,除锰浸出外,还伴随着杂质Fe、Al、Ca、Pb和Si等的同时浸出。
c.SDD为二乙胺硫代甲酸钠。
d.溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Pb2+ | Mn2+ |
| 开始沉淀时pH | 7.0 | 1.9 | 3.7 | 7.1 | 8.1 |
| 完全沉淀时pH | 9.0 | 3.2 | 4.7 | 9.1 | 10.1 |
(1)砷华废渣预先粉碎的目的是
(2)砷华废渣焙烧温度与Mn的浸出率的关系图如图:

①焙烧的适宜温度为
②Mn的浸出率随着焙烧的温度升高而升高,温度高于650℃后,Mn的浸出率降低的可能原因是
(3)软锰矿浆(MnO2)吸收焙烧放出的SO2的化学方程式为
(4)加入MnO2粉末的目的是氧化Fe2+,其发生反应的离子方程式为
(5)根据实验目的调节pH的范围是
(6)称量产品MnSO4·H2O17.21g,溶于水,滴加足量的BaCl2溶液,生成的沉淀,经过过滤、洗涤、干燥后得固体,称量固体的质量为23.30g,则产品中MnSO4·H2O的质量分数为
您最近一年使用:0次
2021-09-10更新
|
252次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三下学期开学化学试题
名校
解题方法
4 . 某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。(已知:C+2H2SO4(浓) CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)
(1)有同学认为制得的SO2中可能混有杂质,其化学式为___________ 。
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。___________ ;装置C中品红溶液的作用是___________ 。
②装置H的作用为___________ 。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。___________ ;
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是___________ (填Ⅰ、Ⅱ或Ⅲ);试管b中发生反应的离子方程式为___________ 。
 CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)(1)有同学认为制得的SO2中可能混有杂质,其化学式为
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。

②装置H的作用为
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。

②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是
您最近一年使用:0次
2024-02-28更新
|
658次组卷
|
7卷引用:湖南省常德市第一中学2023-2024学年高一下学期第一次月考化学试题
湖南省常德市第一中学2023-2024学年高一下学期第一次月考化学试题江西省丰城中学2023-2024学年高一下学期开学化学试题(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题河北省石家庄市河北正定中学2023-2024学年高一下学期第一次月考(3月)化学试题辽宁省长海县高级中学2023-2024下学期第一次月考高一化学试卷天津市武清区黄花店中学2023-2024学年高一下学期第一次月考化学试题(理科)
5 . NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
下列判断不正确的是
| 装置图 | 试剂X | 实验现象 | |
 | ① | 0.2mol•L-1盐酸 | 产生黄绿色气体 |
| ② | 0.2mol•L-1KI-淀粉溶液 | 溶液变蓝 | |
| ③ | 0.2mol•L-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
| ④ | 0.2mol•L-1AlCl3溶液 | 产生白色沉淀 | |
| A.实验①中发生的主要反应是ClO-+Cl-+2H+=Cl2↑+H2O |
| B.实验②中发生的主要反应是ClO-+2I-+2H+=Cl-+I2+H2O |
| C.实验③中该条件下氧化性强弱ClO-<Fe3+ |
| D.实验④中ClO-与Al3+相互促进水解 |
您最近一年使用:0次
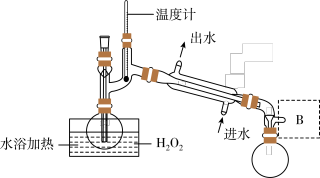
6 . ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图所示。

已知:
2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃
请回答:
(1)仪器A的作用是_______ ;冰水浴冷却的目的是_______ ,_______ (写两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因_______ 。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①_______ (用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过如图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是_______ ,馏出物是_______ 。

已知:
2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃
请回答:
(1)仪器A的作用是
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①
(4)H2O2浓度对反应速率有影响。通过如图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是

您最近一年使用:0次
名校
解题方法
7 . 连二亚硫酸钠 是一种漂白剂,由于它对衣物的损伤和氧化剂相比要小得多,可用于各种纤维的纺织品而不至于造成伤害,所以也叫做保险粉。某化学小组用如图所示装置制取
是一种漂白剂,由于它对衣物的损伤和氧化剂相比要小得多,可用于各种纤维的纺织品而不至于造成伤害,所以也叫做保险粉。某化学小组用如图所示装置制取 。
。

已知:连二亚硫酸钠不溶于甲醇,遇水会分解,在碱性介质中较稳定。
(1)装置 的名称是
的名称是___________ 。
(2)单向阀的作用是防止倒吸,下列装置不能代替单向阀的是___________ (填字母)。

(3)制备前应先打开装置___________ (填“a”或“c”)的活塞;在C、D之间应添加一个装置,该装置的作用是___________
(4) 中
中 元素的化合价为
元素的化合价为___________ 价。已知亚硫酸的结构式为 ,则连二亚硫酸根
,则连二亚硫酸根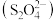 的结构式为
的结构式为___________ 。
(5)制备时打开B装置的活塞,向三颈烧瓶中滴加___________ (填“少量”或“过量”)的 溶液;写出生成
溶液;写出生成 的化学方程式(已知:甲酸被氧化为
的化学方程式(已知:甲酸被氧化为 ):
):___________ 。
(6)制备结束后,过滤,用___________ 洗涤,干燥,制得 。
。
 是一种漂白剂,由于它对衣物的损伤和氧化剂相比要小得多,可用于各种纤维的纺织品而不至于造成伤害,所以也叫做保险粉。某化学小组用如图所示装置制取
是一种漂白剂,由于它对衣物的损伤和氧化剂相比要小得多,可用于各种纤维的纺织品而不至于造成伤害,所以也叫做保险粉。某化学小组用如图所示装置制取 。
。
已知:连二亚硫酸钠不溶于甲醇,遇水会分解,在碱性介质中较稳定。
(1)装置
 的名称是
的名称是(2)单向阀的作用是防止倒吸,下列装置不能代替单向阀的是

(3)制备前应先打开装置
(4)
 中
中 元素的化合价为
元素的化合价为 ,则连二亚硫酸根
,则连二亚硫酸根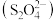 的结构式为
的结构式为(5)制备时打开B装置的活塞,向三颈烧瓶中滴加
 溶液;写出生成
溶液;写出生成 的化学方程式(已知:甲酸被氧化为
的化学方程式(已知:甲酸被氧化为 ):
):(6)制备结束后,过滤,用
 。
。
您最近一年使用:0次
2023-09-12更新
|
272次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
8 . 铋(Bi)的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含FeS2、CuO、SiO2等杂质)制备NaBiO3的工艺流程如下:
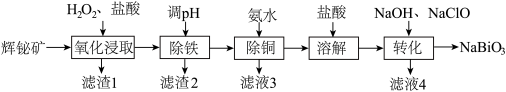
已知: i. Bi3+易水解。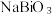 难溶于冷水。
难溶于冷水。
ⅱii.“氧化浸取”时,铋元素转化为Bi3+,硫元素转化为硫单质。
回答下列问题:
(1)为提高“浸取”速率,采取的措施有:升高温度、___________ (写出一条)。辉铋矿浸取率随温度的变化曲线如图,高于40℃时浸取率快速下降,其可能的原因是___________ 。(答两条原因)

(2)“氧化浸取”时,H2O2和FeS2发生反应的物质的量之比为___________ 。
(3)“除铜”时发生反应: 。当NH3分子与Cu2+形成配离子后,N-H键之间的夹角将
。当NH3分子与Cu2+形成配离子后,N-H键之间的夹角将___________ (填“变大”、“变小”或“不变”)。
(4)“转化”时,生成NaBiO3的离子方程式为___________ 。
(5)已知酸性环境下,NaBiO3可以将Mn2+氧化成 (
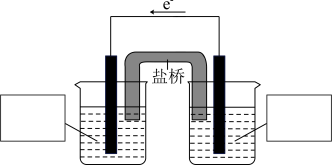
(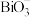 被还原成Bi3+)。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式,并写出正极的电极反应式:
被还原成Bi3+)。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式,并写出正极的电极反应式:___________ 。(左侧烧杯中已经加入了硫酸)

已知: i. Bi3+易水解。
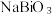 难溶于冷水。
难溶于冷水。ⅱii.“氧化浸取”时,铋元素转化为Bi3+,硫元素转化为硫单质。
回答下列问题:
(1)为提高“浸取”速率,采取的措施有:升高温度、

(2)“氧化浸取”时,H2O2和FeS2发生反应的物质的量之比为
(3)“除铜”时发生反应:
 。当NH3分子与Cu2+形成配离子后,N-H键之间的夹角将
。当NH3分子与Cu2+形成配离子后,N-H键之间的夹角将(4)“转化”时,生成NaBiO3的离子方程式为
(5)已知酸性环境下,NaBiO3可以将Mn2+氧化成
 (
(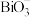 被还原成Bi3+)。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式,并写出正极的电极反应式:
被还原成Bi3+)。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式,并写出正极的电极反应式:
您最近一年使用:0次
名校
解题方法
9 . 化学小组实验探究 与
与 溶液的反应。
溶液的反应。
实验一:用如图装置制备 ,并将足量
,并将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(1)制备的 中会混有少量的
中会混有少量的 ,原因可能为浓硫酸或硫酸铜受热分解产生
,原因可能为浓硫酸或硫酸铜受热分解产生 ,为了排除
,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为___________ 。
a.浓硫酸 b.足量 溶液 c.足量NaHS溶液 d.足量饱和
溶液 c.足量NaHS溶液 d.足量饱和 溶液
溶液
请写出试剂a所有不能选择的试剂的理由(用相应的离子方程式回答):___________ 。
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为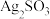 、
、 或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
相关反应为:① ,
,
② 。
。
流程如下: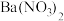 是否已经过量,请简述实验方法
是否已经过量,请简述实验方法___________ 。
(3)沉淀D加入过量盐酸后,只有少量沉淀剩余,则表明大部外沉淀为 。向滤液E中加入
。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是___________ ,可进一步证实B中含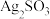 。
。
实验三:探究 的产生途径。
的产生途径。
猜想1:实验一中, 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。
猜想2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:___________ 。
(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有 生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率
生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率___________ (填“快”或“慢”)。
(6)实验探究可知, 在
在___________ (选填“酸性”“中性”“碱性”)溶液中更易被氧化为 。
。
 与
与 溶液的反应。
溶液的反应。实验一:用如图装置制备
 ,并将足量
,并将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(1)制备的
 中会混有少量的
中会混有少量的 ,原因可能为浓硫酸或硫酸铜受热分解产生
,原因可能为浓硫酸或硫酸铜受热分解产生 ,为了排除
,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为a.浓硫酸 b.足量
 溶液 c.足量NaHS溶液 d.足量饱和
溶液 c.足量NaHS溶液 d.足量饱和 溶液
溶液请写出试剂a所有不能选择的试剂的理由(用相应的离子方程式回答):
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为
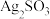 、
、 或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
或两者混合物。滴加氨水可释出其阴离子,便于后续检验。相关反应为:①
 ,
,②
 。
。流程如下:

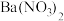 是否已经过量,请简述实验方法
是否已经过量,请简述实验方法(3)沉淀D加入过量盐酸后,只有少量沉淀剩余,则表明大部外沉淀为
 。向滤液E中加入
。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是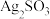 。
。实验三:探究
 的产生途径。
的产生途径。猜想1:实验一中,
 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。猜想2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加
 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有
 生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率
生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率(6)实验探究可知,
 在
在 。
。
您最近一年使用:0次
2024-05-05更新
|
344次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
10 . 铋酸钠(NaBiO3)是分析化学中的重要试剂,某实验小组在实验室用Cl2氧化Bi(OH)3制备NaBiO3,并探究其氧化性。
Ⅰ.查阅资料:
①NaBiO3固体不溶于冷水,加沸水会分解,遇酸则迅速分解,在酸性条件下能将Mn2+氧化为MnO 。
。
②Bi(OH)3为白色难溶于水的固体。
Ⅱ.制备NaBiO3 (夹持等装置略)
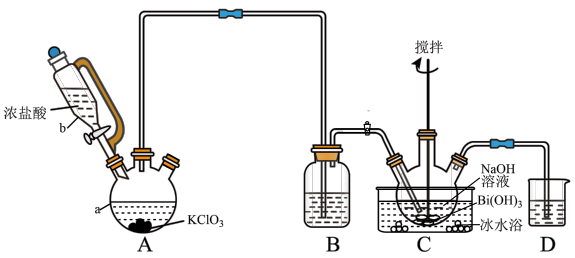
(1)装置A中,仪器b的名称___________ ,写出装置A中反应的离子方程式___________ 。
(2)若没有B装置,可能产生的影响是___________ 。
(3)装置C中Cl2发生的主要反应化学方程式为___________ ,另外还有Cl2+2NaOH = NaCl+NaClO+H2O。
(4)反应结束后,装置C中的浊液经过滤、___________ 、干燥得NaBiO3粗产品。
Ⅲ.测定NaBiO3产品纯度
取上述NaBiO3粗产品wg,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用c mol/L的H2C2O4标准溶液滴定生成的MnO ,平均消耗V mL标准溶液。
,平均消耗V mL标准溶液。
(5)该产品的纯度为___________ %(用含w、c、V的代数式表示)。
Ⅳ.探究NaBiO3的氧化性
(6)取少量装置 C中反应后的悬浊液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2.该实验___________ (填“能”或“不能”)证明一定是NaBiO3氧化了Cl-,理由是___________ 。
Ⅰ.查阅资料:
①NaBiO3固体不溶于冷水,加沸水会分解,遇酸则迅速分解,在酸性条件下能将Mn2+氧化为MnO
 。
。②Bi(OH)3为白色难溶于水的固体。
Ⅱ.制备NaBiO3 (夹持等装置略)

(1)装置A中,仪器b的名称
(2)若没有B装置,可能产生的影响是
(3)装置C中Cl2发生的主要反应化学方程式为
(4)反应结束后,装置C中的浊液经过滤、
Ⅲ.测定NaBiO3产品纯度
取上述NaBiO3粗产品wg,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用c mol/L的H2C2O4标准溶液滴定生成的MnO
 ,平均消耗V mL标准溶液。
,平均消耗V mL标准溶液。(5)该产品的纯度为
Ⅳ.探究NaBiO3的氧化性
(6)取少量装置 C中反应后的悬浊液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2.该实验
您最近一年使用:0次



