1 . 连二亚硫酸钠( )也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取
)也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取 。
。
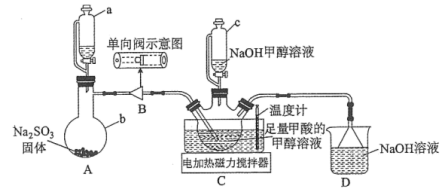
回答下列问题:
(1)仪器a的名称是___________ ,用装置A制备 时所选用的酸,你认为下列最适宜选用的是
时所选用的酸,你认为下列最适宜选用的是___________ (填字母)。
A.浓盐酸 B.质量分数为70%的
C.稀硝酸 D.质量分数为10%的稀硫酸
(2)单向阀的作用是___________ ,制备保险粉前先打开仪器a的活塞的目的是___________ 。
(3)已知三颈烧瓶中的甲酸转化为 ,写出生成
,写出生成 的化学方程式:
的化学方程式:___________ 。
(4) 是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:
是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:___________ 。
(5) 固体隔绝空气加热使之完全分解得到固体产物
固体隔绝空气加热使之完全分解得到固体产物 、
、 和
和 气体,设计实验方案检验产物中含有的
气体,设计实验方案检验产物中含有的 :
:___________ (写出实验操作、现象及结论)。
(6)称取粗产品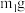 加水溶解,用NaOH溶液碱化后,加入一定量的
加水溶解,用NaOH溶液碱化后,加入一定量的 溶液恰好完全反应(
溶液恰好完全反应( ),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到
),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到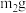 银,则粗产品中连二亚硫酸钠的纯度为
银,则粗产品中连二亚硫酸钠的纯度为___________ (含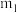 、
、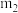 的表达式)。
的表达式)。
 )也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取
)也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取 。
。
回答下列问题:
(1)仪器a的名称是
 时所选用的酸,你认为下列最适宜选用的是
时所选用的酸,你认为下列最适宜选用的是A.浓盐酸 B.质量分数为70%的

C.稀硝酸 D.质量分数为10%的稀硫酸
(2)单向阀的作用是
(3)已知三颈烧瓶中的甲酸转化为
 ,写出生成
,写出生成 的化学方程式:
的化学方程式:(4)
 是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:
是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:(5)
 固体隔绝空气加热使之完全分解得到固体产物
固体隔绝空气加热使之完全分解得到固体产物 、
、 和
和 气体,设计实验方案检验产物中含有的
气体,设计实验方案检验产物中含有的 :
:(6)称取粗产品
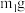 加水溶解,用NaOH溶液碱化后,加入一定量的
加水溶解,用NaOH溶液碱化后,加入一定量的 溶液恰好完全反应(
溶液恰好完全反应( ),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到
),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到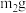 银,则粗产品中连二亚硫酸钠的纯度为
银,则粗产品中连二亚硫酸钠的纯度为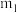 、
、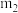 的表达式)。
的表达式)。
您最近半年使用:0次
名校
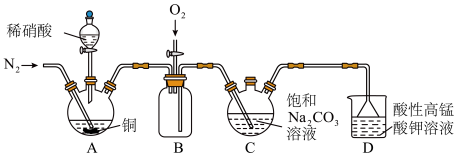
2 . 亚硝酸钠( )主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用
)主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用 表示)制备亚硝酸钠,简易流程如图。
表示)制备亚硝酸钠,简易流程如图。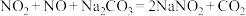 ,
,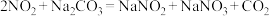
 溶液和饱和
溶液和饱和 溶液在加热条件下反应可制得
溶液在加热条件下反应可制得 ,该反应的化学方程式为
,该反应的化学方程式为_______ ;实验时装置B中应间断性通入适量的 ,其目的是
,其目的是_______ 。
(2)装置C中盛装饱和 溶液的仪器的名称是
溶液的仪器的名称是_______ ;NO不能单独被纯碱溶液吸收,为了使 完全被纯碱溶液吸收且产品纯度最高,
完全被纯碱溶液吸收且产品纯度最高,
_______ 。
(3)装置D的作用是_______ ,采用“倒置漏斗”措施的目的是_______ 。
(4)设计实验探究 的性质。制备
的性质。制备 实验完毕后,从装置C中分离出
实验完毕后,从装置C中分离出 固体粗产品(不含
固体粗产品(不含 杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
上述实验_______ (填标号)的结论不可靠。经实验测得实验丙反应后的溶液中氮元素仅以 的形式存在,酸性
的形式存在,酸性 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为_______ 。
 )主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用
)主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用 表示)制备亚硝酸钠,简易流程如图。
表示)制备亚硝酸钠,简易流程如图。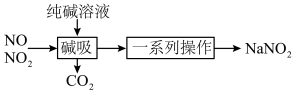
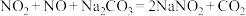 ,
,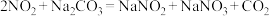
 溶液和饱和
溶液和饱和 溶液在加热条件下反应可制得
溶液在加热条件下反应可制得 ,该反应的化学方程式为
,该反应的化学方程式为 ,其目的是
,其目的是(2)装置C中盛装饱和
 溶液的仪器的名称是
溶液的仪器的名称是 完全被纯碱溶液吸收且产品纯度最高,
完全被纯碱溶液吸收且产品纯度最高,
(3)装置D的作用是
(4)设计实验探究
 的性质。制备
的性质。制备 实验完毕后,从装置C中分离出
实验完毕后,从装置C中分离出 固体粗产品(不含
固体粗产品(不含 杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。| 实验 | 实验操作及现象 | 结论 |
| 甲 | 滴入无色酚酞溶液中,无色酚酞溶液变红 |  是弱酸 是弱酸 |
| 乙 | 滴入少量酸性KI-淀粉溶液中,振荡,酸性KI-淀粉溶液变蓝 | 酸性条件下 具有氧化性 具有氧化性 |
| 丙 | 滴入少量酸性 溶液中,振荡,酸性 溶液中,振荡,酸性 溶液褪色 溶液褪色 | 酸性条件 具有还原性 具有还原性 |
 的形式存在,酸性
的形式存在,酸性 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为
您最近半年使用:0次
解题方法
3 . 某同学利用下图装置制备并收集干燥纯净的 ,并探究
,并探究 与碱的反应。回答下列问题:
与碱的反应。回答下列问题:
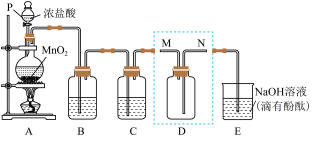
(1)装置A中发生反应的化学方程式为___________ 。
(2)实验室用下列两种方法制氯气:①用含HCl 146g的浓盐酸与足量的 反应;②用
反应;②用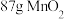 与足量浓盐酸反应。所得的氯气质量①
与足量浓盐酸反应。所得的氯气质量①___________ ②(填“>”“<”“=”)。
(3)装置B的作用是___________ 。
(4)装置D用来收集纯净且干燥的氯气,进气口为___________ (填“M”或“N”)。
(5)36.5%的浓盐酸(密度为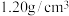 )的物质的量浓度
)的物质的量浓度___________
(6)探究 的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
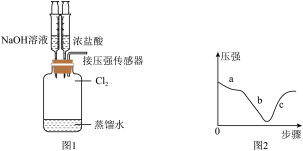
实验步骤如下:
a.向D中加入适量的蒸馏水,振荡。
b.用注射器向装置中加入NaOH溶液。
c.用注射器向装置中加入浓盐酸。
①步骤a,压强减小的原因___________ 。
②步骤b, 与NaOH溶液反应而导致压强减小
与NaOH溶液反应而导致压强减小
③步骤c,装置D中的现象___________ 。
(7)小组同学观察到E中红色褪去,并对褪色原因提出假设:
假设1:___________ ;
假设2:ClO-破坏了酚酞的结构。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许D中褪色后的溶液放入试管中,___________ (填“操作”),若___________ (填“现象”)。则假设1成立。
(8)二氧化氯( )现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。
)现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。 对酸性污水中的
对酸性污水中的 也有明显的去除效果。配平以下方程式
也有明显的去除效果。配平以下方程式________
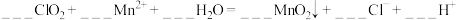
 ,并探究
,并探究 与碱的反应。回答下列问题:
与碱的反应。回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)实验室用下列两种方法制氯气:①用含HCl 146g的浓盐酸与足量的
 反应;②用
反应;②用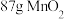 与足量浓盐酸反应。所得的氯气质量①
与足量浓盐酸反应。所得的氯气质量①(3)装置B的作用是
(4)装置D用来收集纯净且干燥的氯气,进气口为
(5)36.5%的浓盐酸(密度为
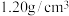 )的物质的量浓度
)的物质的量浓度(6)探究
 的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
实验步骤如下:
a.向D中加入适量的蒸馏水,振荡。
b.用注射器向装置中加入NaOH溶液。
c.用注射器向装置中加入浓盐酸。
①步骤a,压强减小的原因
②步骤b,
 与NaOH溶液反应而导致压强减小
与NaOH溶液反应而导致压强减小③步骤c,装置D中的现象
(7)小组同学观察到E中红色褪去,并对褪色原因提出假设:
假设1:
假设2:ClO-破坏了酚酞的结构。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许D中褪色后的溶液放入试管中,
(8)二氧化氯(
 )现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。
)现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。 对酸性污水中的
对酸性污水中的 也有明显的去除效果。配平以下方程式
也有明显的去除效果。配平以下方程式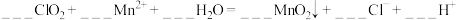
您最近半年使用:0次
4 . 亚硝酸钠(NaNO2)主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用NOx制备亚硝酸钠,简易流程如图。
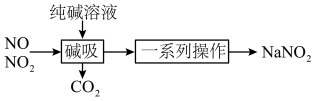
已知:NO2 + NO+ Na2CO3=2NaNO2 + CO2,2NO2 + Na2CO3= NaNO2 + NaNO3 +CO2。

(1)N2的结构式为___________ ;利用饱和NH4Cl溶液和饱和NaNO2溶液在加热条件下反应可制得N2,该反应的化学方程式为___________ 。
(2)装置C中盛装饱和Na2CO3溶液的仪器的名称是___________ ;NO不能单独被纯碱溶液吸收,为了使NOx完全被碱液吸收且产品纯度高,x=___________ 。
(3)装置D的作用是___________ ,采用“倒置漏斗”措施的目的是___________ 。
(4)实验完毕后,从装置C中分离出NaNO2固体产品(不含Na2CO3杂质)。设计实验探究NaNO2的性质。取少量NaNO2固体产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如表。
上述实验___________ (填标号 )的结论不可靠,理由是___________ 。以上经实验测得实验丙反应后的溶液中氮元素仅以 的形式存在,酸性KMnO4溶液与
的形式存在,酸性KMnO4溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
(5)吸光光度法是借助分光光度计测定溶液的吸光度,根据朗伯一比耳定律确定物质溶液的浓度。亚硝酸钠标准曲线数据如表所示。(已知:稀溶液的吸光度与浓度成正比)
取0.001gNaNO2样品溶于蒸馏水配成1000mL稀溶液,取4.00mL该稀溶液测得吸光度为2.7000,对比标准曲线数据可知,该亚硝酸钠产品纯度为___________ (结果保留三位有效数字,已知1 μg=10-6 g)。

已知:NO2 + NO+ Na2CO3=2NaNO2 + CO2,2NO2 + Na2CO3= NaNO2 + NaNO3 +CO2。

(1)N2的结构式为
(2)装置C中盛装饱和Na2CO3溶液的仪器的名称是
(3)装置D的作用是
(4)实验完毕后,从装置C中分离出NaNO2固体产品(不含Na2CO3杂质)。设计实验探究NaNO2的性质。取少量NaNO2固体产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如表。
| 实验 | 实验操作及现象 | 结论 |
| 甲 | 滴入无色酚酞溶液中,无色酚酞溶液变红 | HNO2是弱酸 |
| 乙 | 滴入少量酸性KI-淀粉溶液中,振荡,酸性KI-淀粉溶液变蓝 | 酸性条件下,  具有氧化性 具有氧化性 |
| 丙 | 滴入少量酸性KMnO4溶液中,振荡,酸性KMnO4溶液褪色 | 酸性条件下 ,  具有还原性 具有还原性 |
 的形式存在,酸性KMnO4溶液与
的形式存在,酸性KMnO4溶液与 反应的离子方程式为
反应的离子方程式为(5)吸光光度法是借助分光光度计测定溶液的吸光度,根据朗伯一比耳定律确定物质溶液的浓度。亚硝酸钠标准曲线数据如表所示。(已知:稀溶液的吸光度与浓度成正比)
| 标准使用液浓度/(μg·mL−1) | 取标准液体积/mL | 相当于亚硝酸钠的质量/μg | 吸光度A |
| 1 | 4 | 4 | 2.7045 |
您最近半年使用:0次
5 . CuCl是一种难溶于水和乙醇的白色固体,可溶于浓盐酸或者浓氨水(形成络合物),易被氧化为高价绿色铜盐,见光受热易分解。在催化领域广泛应用,纺织工业中常作脱色剂,可利用如图装置(夹持装置略去)将SO2通入新制氢氧化铜悬浊液中制备CuCl。
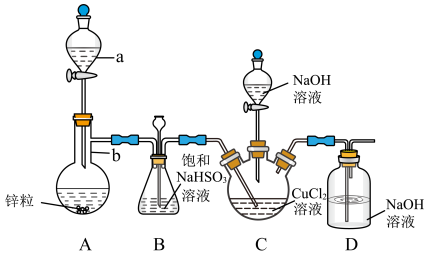
实验步骤及现象:
①向C中先加入10.00mL0.5mol•L-1CuCl2溶液,再加入30mL0.6mol•L-1NaOH溶液;
②取下A中分液漏斗上的玻璃塞,然后打开分液漏斗的活塞,产生SO2气体至过量,直至C中出现较多的白色沉淀,上层是淡绿色的溶液;
③将C中混合物过滤,依次用水和乙醇洗涤低温晾干,精确称量所得固体质量为0.398g。
回答下列问题:
(1)试剂a为浓硫酸,反应过程中表现的是浓硫酸的_______ 性和_______ 性。
(2)装置B中长颈漏斗的作用是_______ 。
(3)将SO2通入C中,与新制氢氧化铜悬浊液反应,产生白色固体的离子方程式为_______ 。
(4)装置C的规格最好选用_______ (填字母)。
(5)针对步骤2中的现象查阅资料得知:
i.白色沉淀为CuCl;
ii.上层淡绿色溶液中的主要溶质为NaCl和少量Cu(HSO3)2。
结论:本实验中较多量的新制氢氧化铜与二氧化硫发生了氧化还原反应,少量与之发生了复分解反应,二者为竞争关系。检验淡绿色溶液中含有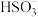 的操作方法是
的操作方法是_______ 。
(6)产品需要避光保存在阴凉的环境中,其原因是_______ 。
(7)计算该实验中CuCl的产率为_______ %。
(8)已知:Cu2O+2H+=Cu+Cu2++H2O,CuCl+HCl=HCuCl2,HCuCl2 CuCl↓+HCl。若所得CuCl固体中混有少量Cu2O,请补充完整除去Cu2O的实验方案:
CuCl↓+HCl。若所得CuCl固体中混有少量Cu2O,请补充完整除去Cu2O的实验方案:
①向产物中滴加试剂_______ ,使固体充分溶解,再过滤出杂质;.
②向滤液中加水稀释至不再产生沉淀为止;
③过滤、洗涤、干燥,可得到除去Cu2O后的CuCl固体。

实验步骤及现象:
①向C中先加入10.00mL0.5mol•L-1CuCl2溶液,再加入30mL0.6mol•L-1NaOH溶液;
②取下A中分液漏斗上的玻璃塞,然后打开分液漏斗的活塞,产生SO2气体至过量,直至C中出现较多的白色沉淀,上层是淡绿色的溶液;
③将C中混合物过滤,依次用水和乙醇洗涤低温晾干,精确称量所得固体质量为0.398g。
回答下列问题:
(1)试剂a为浓硫酸,反应过程中表现的是浓硫酸的
(2)装置B中长颈漏斗的作用是
(3)将SO2通入C中,与新制氢氧化铜悬浊液反应,产生白色固体的离子方程式为
(4)装置C的规格最好选用
| A.50mL | B.100mL | C.150mL | D.200mL |
i.白色沉淀为CuCl;
ii.上层淡绿色溶液中的主要溶质为NaCl和少量Cu(HSO3)2。
结论:本实验中较多量的新制氢氧化铜与二氧化硫发生了氧化还原反应,少量与之发生了复分解反应,二者为竞争关系。检验淡绿色溶液中含有
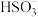 的操作方法是
的操作方法是(6)产品需要避光保存在阴凉的环境中,其原因是
(7)计算该实验中CuCl的产率为
(8)已知:Cu2O+2H+=Cu+Cu2++H2O,CuCl+HCl=HCuCl2,HCuCl2
 CuCl↓+HCl。若所得CuCl固体中混有少量Cu2O,请补充完整除去Cu2O的实验方案:
CuCl↓+HCl。若所得CuCl固体中混有少量Cu2O,请补充完整除去Cu2O的实验方案:①向产物中滴加试剂
②向滤液中加水稀释至不再产生沉淀为止;
③过滤、洗涤、干燥,可得到除去Cu2O后的CuCl固体。
您最近半年使用:0次
名校
解题方法
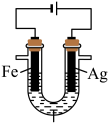
6 . 某校化学兴趣小组探究 与
与 溶液的反应,装置如图所示。
溶液的反应,装置如图所示。
(1)①A装置中制备 的化学方程式为
的化学方程式为_______ ;②装置B的作用_______ 。
(2)该小组同学预测 与
与 溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:
溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:_______ (用离子方程式表示)。
(3)该小组探究实验的具体步骤如下:
根据步骤Ⅰ、Ⅱ、Ⅲ的现象,该小组学查阅资料获知:
ⅰ.生成红棕色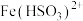 离子的反应为:
离子的反应为:
ⅱ.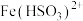 离子可以将
离子可以将 还原为
还原为
③溶液中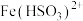 与
与 反应的离子方程式为
反应的离子方程式为_______
④由上述实验可知 与
与 溶液反应生成
溶液反应生成 所需时间较长,缩短该反应所用时间可以采取的措施
所需时间较长,缩短该反应所用时间可以采取的措施_______ (任写两条)
 与
与 溶液的反应,装置如图所示。
溶液的反应,装置如图所示。
(1)①A装置中制备
 的化学方程式为
的化学方程式为(2)该小组同学预测
 与
与 溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:
溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:(3)该小组探究实验的具体步骤如下:
| 步骤 | 现象 | 结论 |
Ⅰ。取   溶液于装置C中,并连接好装置,通入 溶液于装置C中,并连接好装置,通入 至饱和。 至饱和。 | 溶液很快由黄色变为红棕色。 | |
| Ⅱ.用激光笔照射步骤Ⅰ中的红棕色溶液。 | 溶液中无明显光路。 | ①红棕色溶液不是 |
| Ⅲ.将步骤Ⅰ中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色。 | ②溶液中有 |
ⅰ.生成红棕色
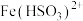 离子的反应为:
离子的反应为:
ⅱ.
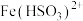 离子可以将
离子可以将 还原为
还原为
③溶液中
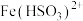 与
与 反应的离子方程式为
反应的离子方程式为④由上述实验可知
 与
与 溶液反应生成
溶液反应生成 所需时间较长,缩短该反应所用时间可以采取的措施
所需时间较长,缩短该反应所用时间可以采取的措施
您最近半年使用:0次
2022-04-04更新
|
582次组卷
|
4卷引用:陕西省咸阳市武功县普集高级中学2021-2022学年高三上学期期末考试化学试题
陕西省咸阳市武功县普集高级中学2021-2022学年高三上学期期末考试化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)辽宁省渤海大学附属高级中学2021-2022学年高一下学期第二次阶段性考试化学试题
名校
7 . 氯酸钾在工业上具有广泛的应用,是焰火、照明弹等的主要成分。某研究性学习小组利用如图所示的实验装置制备氯酸钾。回答下列问题:
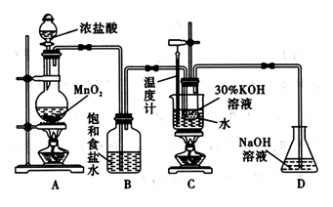
(1)写出装置A中发生反应的离子方程式:________________________________ ;写出装置C中发生反应的离子方程式:________________________________________ 。
(2)若无B装置,则装置C中氯酸钾的产率将________ (填“提高” “降低”或“无影响”)。
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究体系中硫酸浓度对反应产物的影响,实验的记录表如下表(实验在室温下进行):
①实验设计表中V1=____________ ; V3 =_______________ 。
②设计1号试管实验的作用是_________________________ 。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色。假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_____________________________ 。
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂ClO2,该反应的化学方程式为_________________________________ 。

(1)写出装置A中发生反应的离子方程式:
(2)若无B装置,则装置C中氯酸钾的产率将
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究体系中硫酸浓度对反应产物的影响,实验的记录表如下表(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0. 20mol • L-1KI/mL | V1 | 1.0 | 1.0 | 1.0 |
| KC1O3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol • L-1H2SO4/mL | 0 | 3.0 | V2 | 9.0 |
| 蒸馏水 | 9.0 | V3 | 3.0 | 0 |
| 实验现象 |
②设计1号试管实验的作用是
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色。假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂ClO2,该反应的化学方程式为
您最近半年使用:0次
解题方法
8 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制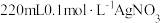 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: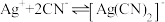 ,
,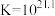 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是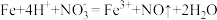 和
和___________ (用离子方程式表示,已知氧化性: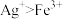 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中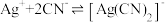 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为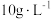 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为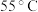 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由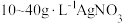 溶液和
溶液和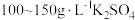 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: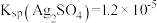 。
。
I.实验准备。
(1)用
 固体配制
固体配制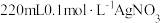 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B.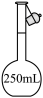 C.
C. D.
D.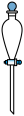 E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
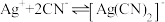 ,
,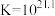 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的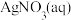 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
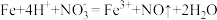 和
和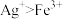 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
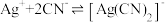 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(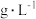 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为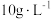 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
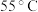 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
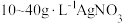 溶液和
溶液和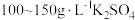 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
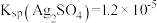 。
。
您最近半年使用:0次
7日内更新
|
121次组卷
|
3卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
解题方法
9 . 某小组同学探究 与新制
与新制 悬浊液的反应。
悬浊液的反应。
资料: 为白色固体,难溶于水,能溶于浓盐酸;能与氨水反应生成
为白色固体,难溶于水,能溶于浓盐酸;能与氨水反应生成 ,该物质在空气中会立即被氧化成
,该物质在空气中会立即被氧化成 而使溶液显蓝色。
而使溶液显蓝色。
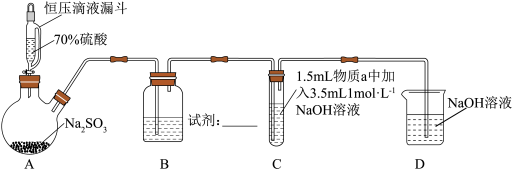
(1)装置B的作用是控制 气体的流速,则B中试剂是
气体的流速,则B中试剂是_____ 。
(2)通入 前,实验Ⅰ、Ⅱ中产生蓝色絮状沉淀的离子方程式为
前,实验Ⅰ、Ⅱ中产生蓝色絮状沉淀的离子方程式为_____ 。
(3)实验Ⅰ通入 后产生砖红色沉淀
后产生砖红色沉淀 ,该反应的化学方程式为
,该反应的化学方程式为_____ 。分析实验Ⅰ一段时间后砖红色沉淀消失的可能原因_____ 。
(4)同学们对实验Ⅱ中白色沉淀的成分继续探究。
①甲同学取少量白色沉淀,洗净后加入氨水,得到蓝色溶液,此过程中反应的离子方程式为: 、
、_____ 。
②乙同学用另一种方法证明了该白色沉淀为 ,实验方案如下:
,实验方案如下:
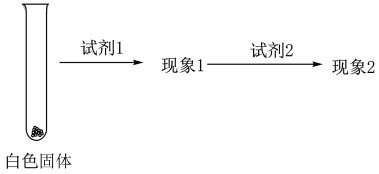
填写下表空格:
(5)实验Ⅰ和实验Ⅱ中 与新制
与新制 悬浊液均发生了
悬浊液均发生了_____ 反应,反应现象的不同与_____ 有关。
 与新制
与新制 悬浊液的反应。
悬浊液的反应。资料:
 为白色固体,难溶于水,能溶于浓盐酸;能与氨水反应生成
为白色固体,难溶于水,能溶于浓盐酸;能与氨水反应生成 ,该物质在空气中会立即被氧化成
,该物质在空气中会立即被氧化成 而使溶液显蓝色。
而使溶液显蓝色。
| 序号 | 物质a | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| Ⅰ |   溶液 溶液 | 产生蓝色絮状沉淀 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| Ⅱ |   溶液 溶液 | 产生蓝色絮状沉淀 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(1)装置B的作用是控制
 气体的流速,则B中试剂是
气体的流速,则B中试剂是(2)通入
 前,实验Ⅰ、Ⅱ中产生蓝色絮状沉淀的离子方程式为
前,实验Ⅰ、Ⅱ中产生蓝色絮状沉淀的离子方程式为(3)实验Ⅰ通入
 后产生砖红色沉淀
后产生砖红色沉淀 ,该反应的化学方程式为
,该反应的化学方程式为(4)同学们对实验Ⅱ中白色沉淀的成分继续探究。
①甲同学取少量白色沉淀,洗净后加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:
 、
、②乙同学用另一种方法证明了该白色沉淀为
 ,实验方案如下:
,实验方案如下:
填写下表空格:
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
(5)实验Ⅰ和实验Ⅱ中
 与新制
与新制 悬浊液均发生了
悬浊液均发生了
您最近半年使用:0次
名校
解题方法
10 . 回答下列问题。
(1)实验室常用如图所示装置来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。
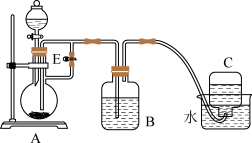
实验时在A中加入铁屑和稀硫酸,B中加入一定量的NaOH溶液,则A中发生的反应的离子方程式是_______ 。实验开始时先将活塞E_______ (填“打开”或“关闭”),C中收集到气体的主要成分是_______ 。实验结束后拔去装置B中橡皮塞,使空气进入,装置B中发生的现象为_______ 。
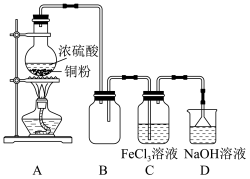
(2)从制造印刷电路板的腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜,并重新获得FeCl3溶液,处理流程如图所示:
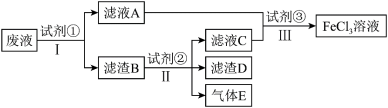
已知试剂①为铁,试剂②为稀盐酸,则滤渣的成分为_______ ,检验废液中Fe3+存在的最佳试剂是_______ (填标号),检验时实验现象为_______ 。
A.氢氧化钠溶液 B.酸性KMnO4溶液
C.氯水 D.KSCN溶液
检验Fe2+可用酸性KMnO4溶液,请写出离子方程式_______
(1)实验室常用如图所示装置来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。

实验时在A中加入铁屑和稀硫酸,B中加入一定量的NaOH溶液,则A中发生的反应的离子方程式是
(2)从制造印刷电路板的腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜,并重新获得FeCl3溶液,处理流程如图所示:

已知试剂①为铁,试剂②为稀盐酸,则滤渣的成分为
A.氢氧化钠溶液 B.酸性KMnO4溶液
C.氯水 D.KSCN溶液
检验Fe2+可用酸性KMnO4溶液,请写出离子方程式
您最近半年使用:0次
2022-12-25更新
|
206次组卷
|
2卷引用:陕西省榆林中学2022-2023学年高一上学期期末考试化学试题