名校
解题方法
1 . 工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: 难溶于水;
难溶于水;
②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1) 中Cu的化合价为
中Cu的化合价为___________ ,酸浸过程中, 反应的离子方程式
反应的离子方程式___________ 。
(2)检验“酸浸”液中是否含 ,可选择
,可选择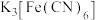 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是___________ 。
(3)氧化后,从反应体系中分离出 粗产品的操作名称是
粗产品的操作名称是___________ 。
(4)上述流程中,基态原子未成对电子数最多的金属元素名称是___________ 。
(5)向 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式___________ 。
(6)已知常温下, ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: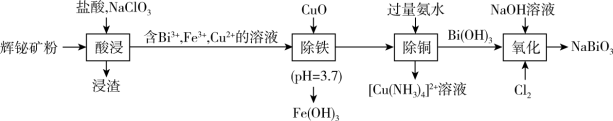
 难溶于水;
难溶于水;②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1)
 中Cu的化合价为
中Cu的化合价为 反应的离子方程式
反应的离子方程式(2)检验“酸浸”液中是否含
 ,可选择
,可选择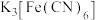 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是(3)氧化后,从反应体系中分离出
 粗产品的操作名称是
粗产品的操作名称是(4)上述流程中,基态原子未成对电子数最多的金属元素名称是
(5)向
 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式(6)已知常温下,
 ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=
您最近半年使用:0次
名校
解题方法
2 . 某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的花肥的主要成分及性质。首先对该花肥的主要成分进行了如下假设:
a.只含有 b.含有
b.含有 和
和 c.只含有
c.只含有
将花肥固体粉末溶于水中得到溶液 ,然后进行如下实验:
,然后进行如下实验:
(1)提出假设 的依据是
的依据是___________ (用离子方程式表示)。
(2)实验Ⅰ的预期现象是先产生白色沉淀,然后变成灰绿色,最后变成红褐色沉淀,产生该预期现象的依据是___________ (用化学方程式和离子方程式表示)。
(3)实验Ⅱ中所加试剂的名称是___________ ,由此得出的结论是___________ 。
(4)为进一步验证假设,该小组同学进行了如下实验:
实验Ⅳ中新制氯水参加反应的离子方程式是___________ 。
(5)通过以上实验,可得到的结论是___________ 。还可以通过实验___________ 证明 的存在(填具体的操作及现象)。
的存在(填具体的操作及现象)。
a.只含有
 b.含有
b.含有 和
和 c.只含有
c.只含有
将花肥固体粉末溶于水中得到溶液
 ,然后进行如下实验:
,然后进行如下实验:| 实验序号 | 操作 | 现象 |
| Ⅰ | 取 溶液 溶液 ,加入 ,加入 的 的 溶液 溶液 | 产生红褐色沉淀 |
| Ⅱ | 取 溶液 溶液 ,加入1滴___________溶液 ,加入1滴___________溶液 | 溶液显红色 |
 的依据是
的依据是(2)实验Ⅰ的预期现象是先产生白色沉淀,然后变成灰绿色,最后变成红褐色沉淀,产生该预期现象的依据是
(3)实验Ⅱ中所加试剂的名称是
(4)为进一步验证假设,该小组同学进行了如下实验:
| 实验序号 | 操作 | 现象 |
| Ⅲ | 取 溶液 溶液 ,加入1滴 ,加入1滴 溶液,再加入 溶液,再加入 水 水 | 溶液显红色 |
| Ⅳ | 取 溶液 溶液 ,加入1滴 ,加入1滴 溶液,再加入 溶液,再加入 新制氯水 新制氯水 | 溶液显红色,且颜色比实验而的深 |
(5)通过以上实验,可得到的结论是
 的存在(填具体的操作及现象)。
的存在(填具体的操作及现象)。
您最近半年使用:0次
3 .  (钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1%
(钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1% 、19.5%Fe和3.4%
、19.5%Fe和3.4% )为原料制备钒酸铋,并回收
)为原料制备钒酸铋,并回收 制备食品抗氧化剂
制备食品抗氧化剂 的流程如下:
的流程如下: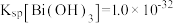 ,
,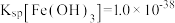 ;当金属离子浓度
;当金属离子浓度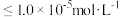 时,认为该离子已沉淀完全。请回答下列问题:
时,认为该离子已沉淀完全。请回答下列问题:
(1)“焙烧”中采用高压空气的目的是_______ , 转化成
转化成 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)浸渣的主要成分是_______ (填化学式)。
(3)“酸浸”得到的浸液中 ,则“除铁”调节pH的范围为
,则“除铁”调节pH的范围为_______ 。
(4)“合成”过程中将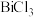 溶液和
溶液和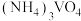 溶液混合容易形成
溶液混合容易形成 胶体,导致过滤困难。为防止生成胶体可采用的措施为
胶体,导致过滤困难。为防止生成胶体可采用的措施为_______ (答一条)。
(5)向饱和碳酸钠溶液中通入过量 可制得
可制得 ,发生反应的化学方程式为
,发生反应的化学方程式为_______ 。 易变质生成
易变质生成 ,设计简单实验证明产品是否变质:
,设计简单实验证明产品是否变质:_______ 。(已知: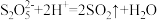 )
)
(6)某工厂用20吨该辉铋矿,最终得到18.468吨 ,则该过程中Bi的损耗率为
,则该过程中Bi的损耗率为______ %。
 (钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1%
(钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1% 、19.5%Fe和3.4%
、19.5%Fe和3.4% )为原料制备钒酸铋,并回收
)为原料制备钒酸铋,并回收 制备食品抗氧化剂
制备食品抗氧化剂 的流程如下:
的流程如下:
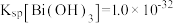 ,
,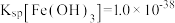 ;当金属离子浓度
;当金属离子浓度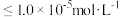 时,认为该离子已沉淀完全。请回答下列问题:
时,认为该离子已沉淀完全。请回答下列问题:(1)“焙烧”中采用高压空气的目的是
 转化成
转化成 发生反应的化学方程式为
发生反应的化学方程式为(2)浸渣的主要成分是
(3)“酸浸”得到的浸液中
 ,则“除铁”调节pH的范围为
,则“除铁”调节pH的范围为(4)“合成”过程中将
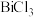 溶液和
溶液和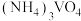 溶液混合容易形成
溶液混合容易形成 胶体,导致过滤困难。为防止生成胶体可采用的措施为
胶体,导致过滤困难。为防止生成胶体可采用的措施为(5)向饱和碳酸钠溶液中通入过量
 可制得
可制得 ,发生反应的化学方程式为
,发生反应的化学方程式为 易变质生成
易变质生成 ,设计简单实验证明产品是否变质:
,设计简单实验证明产品是否变质: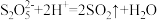 )
)(6)某工厂用20吨该辉铋矿,最终得到18.468吨
 ,则该过程中Bi的损耗率为
,则该过程中Bi的损耗率为
您最近半年使用:0次
解题方法
4 . 某同学利用下图装置制备并收集干燥纯净的 ,并探究
,并探究 与碱的反应。回答下列问题:
与碱的反应。回答下列问题:
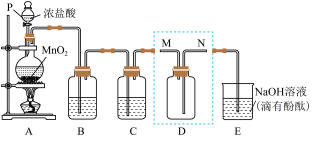
(1)装置A中发生反应的化学方程式为___________ 。
(2)实验室用下列两种方法制氯气:①用含HCl 146g的浓盐酸与足量的 反应;②用
反应;②用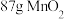 与足量浓盐酸反应。所得的氯气质量①
与足量浓盐酸反应。所得的氯气质量①___________ ②(填“>”“<”“=”)。
(3)装置B的作用是___________ 。
(4)装置D用来收集纯净且干燥的氯气,进气口为___________ (填“M”或“N”)。
(5)36.5%的浓盐酸(密度为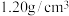 )的物质的量浓度
)的物质的量浓度___________
(6)探究 的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
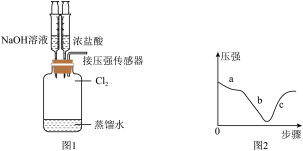
实验步骤如下:
a.向D中加入适量的蒸馏水,振荡。
b.用注射器向装置中加入NaOH溶液。
c.用注射器向装置中加入浓盐酸。
①步骤a,压强减小的原因___________ 。
②步骤b, 与NaOH溶液反应而导致压强减小
与NaOH溶液反应而导致压强减小
③步骤c,装置D中的现象___________ 。
(7)小组同学观察到E中红色褪去,并对褪色原因提出假设:
假设1:___________ ;
假设2:ClO-破坏了酚酞的结构。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许D中褪色后的溶液放入试管中,___________ (填“操作”),若___________ (填“现象”)。则假设1成立。
(8)二氧化氯( )现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。
)现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。 对酸性污水中的
对酸性污水中的 也有明显的去除效果。配平以下方程式
也有明显的去除效果。配平以下方程式________
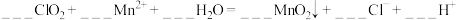
 ,并探究
,并探究 与碱的反应。回答下列问题:
与碱的反应。回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)实验室用下列两种方法制氯气:①用含HCl 146g的浓盐酸与足量的
 反应;②用
反应;②用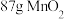 与足量浓盐酸反应。所得的氯气质量①
与足量浓盐酸反应。所得的氯气质量①(3)装置B的作用是
(4)装置D用来收集纯净且干燥的氯气,进气口为
(5)36.5%的浓盐酸(密度为
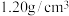 )的物质的量浓度
)的物质的量浓度(6)探究
 的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
实验步骤如下:
a.向D中加入适量的蒸馏水,振荡。
b.用注射器向装置中加入NaOH溶液。
c.用注射器向装置中加入浓盐酸。
①步骤a,压强减小的原因
②步骤b,
 与NaOH溶液反应而导致压强减小
与NaOH溶液反应而导致压强减小③步骤c,装置D中的现象
(7)小组同学观察到E中红色褪去,并对褪色原因提出假设:
假设1:
假设2:ClO-破坏了酚酞的结构。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许D中褪色后的溶液放入试管中,
(8)二氧化氯(
 )现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。
)现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。 对酸性污水中的
对酸性污水中的 也有明显的去除效果。配平以下方程式
也有明显的去除效果。配平以下方程式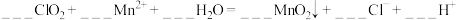
您最近半年使用:0次
名校
5 . 某学习小组用铁泥(主要成分为 、FeO和少量Fe)制备
、FeO和少量Fe)制备 纳米材料的流程示意图如下:
纳米材料的流程示意图如下:

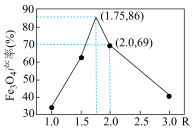
已知:步骤⑤中,相同条件下测得 的产率与
的产率与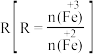 的关系如图所示。
的关系如图所示。
(1)步骤①中,发生置换反应的离子方程式为________ 。
(2)向滤液A中滴加几滴酸性高锰酸钾溶液,若高锰酸钾溶液褪色,能否证明滤液A中一定含有Fc²⁺,并说明理由_______ 。
(3)步骤④中,反应完成后需再加热一段时间除去剩余 ,目的是
,目的是________ 。
(4)浊液D中铁元素以FeOOH形式存在,写出步骤⑤中发生反应的离子方程式_______ 。
(5)设浊液D中FeOOH的物质的量为amol,滤液B中铁元素的物质的量为bmol。为使 的产率最高,则
的产率最高,则
_______ (填数值,精确至0.001)。
 、FeO和少量Fe)制备
、FeO和少量Fe)制备 纳米材料的流程示意图如下:
纳米材料的流程示意图如下:
已知:步骤⑤中,相同条件下测得
 的产率与
的产率与 的关系如图所示。
的关系如图所示。
(1)步骤①中,发生置换反应的离子方程式为
(2)向滤液A中滴加几滴酸性高锰酸钾溶液,若高锰酸钾溶液褪色,能否证明滤液A中一定含有Fc²⁺,并说明理由
(3)步骤④中,反应完成后需再加热一段时间除去剩余
 ,目的是
,目的是(4)浊液D中铁元素以FeOOH形式存在,写出步骤⑤中发生反应的离子方程式
(5)设浊液D中FeOOH的物质的量为amol,滤液B中铁元素的物质的量为bmol。为使
 的产率最高,则
的产率最高,则
您最近半年使用:0次
名校
解题方法
6 . 高铁酸钠(Na2FeO4)是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取Na2FeO4并回收金属Cu,工艺流程如下:
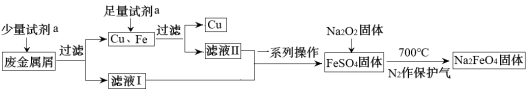
(1)试剂a为___________ (填化学式)。
(2)证明滤液I中无Fe3+的实验方法是___________ ;用离子方程式解释滤液I不含有Fe3+可能的原因___________ 。
(3)流程中Na2O2不可暴露在空气中时间过长,原因是___________ (用化学方程式表示)。
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中___________ 作还原剂;每生成1mol Na2FeO4转移的电子数为___________ 。
(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为____________ ,配平该化学方程式,化学计量数从左至右分别为___________ 。
(6)用Na2FeO4代替Cl2处理饮用水的优点是___________ (只答一条即可)。

(1)试剂a为
(2)证明滤液I中无Fe3+的实验方法是
(3)流程中Na2O2不可暴露在空气中时间过长,原因是
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2
 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为
(6)用Na2FeO4代替Cl2处理饮用水的优点是
您最近半年使用:0次
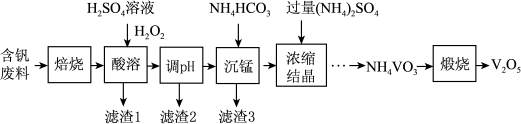
7 . 五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料(含V2O3、FeO、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
已知:25℃时,难溶电解质的溶度积常数如表所示:
(1)“焙烧”的目的是___________ 。
(2)酸溶时加入H2O2的目的是___________ 。
(3)常温下,若“调pH”为7,Cu2+是否能沉淀完全:___________ (填“是”或“否”)(溶液中离子浓度小于10−5 mol∙L−1时,认为该离子沉淀完全)。
(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为___________ 。
(5)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为___________ 。
(6)在煅烧NH4VO3生成的V2O5过程中,固体残留率= ×100%随温度变化的曲线如图所示。其分解过程中,A点失去的物质是
×100%随温度变化的曲线如图所示。其分解过程中,A点失去的物质是________ (填写化学式)。
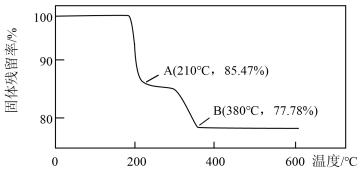
(7)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入过量稀硫酸使其完全反应,生成(VO2)2SO4,并配成100mL溶液。取10.00mL溶液用0.1000 mol∙L−1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO 黄色(被还原为VO2+蓝色),该反应的离子方程式:
黄色(被还原为VO2+蓝色),该反应的离子方程式:___________ ;该产品的纯度为___________ 。

已知:25℃时,难溶电解质的溶度积常数如表所示:
| 难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
| Ksp | 2.2×10−20 | 4×10−14 | 1.9×10−33 |
(2)酸溶时加入H2O2的目的是
(3)常温下,若“调pH”为7,Cu2+是否能沉淀完全:
(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为
(5)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为
(6)在煅烧NH4VO3生成的V2O5过程中,固体残留率=
 ×100%随温度变化的曲线如图所示。其分解过程中,A点失去的物质是
×100%随温度变化的曲线如图所示。其分解过程中,A点失去的物质是
(7)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入过量稀硫酸使其完全反应,生成(VO2)2SO4,并配成100mL溶液。取10.00mL溶液用0.1000 mol∙L−1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO
 黄色(被还原为VO2+蓝色),该反应的离子方程式:
黄色(被还原为VO2+蓝色),该反应的离子方程式:
您最近半年使用:0次
8 . 完成下列问题
(1)某同学设计如下实验研究 的性质:
的性质:
①从理论上看 既有氧化性又有还原性的原因是
既有氧化性又有还原性的原因是_______ 。
②能证明 具有还原性的实验是
具有还原性的实验是_______ (填序号)。可作为证据的实验现象是_______ (填字母序号)。
③配平方程式:______
_______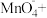 ______
______ _______
_______ _______
_______ _______
_______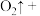 _______
_______
(2)某一反应体系有反应物和生成物共五种物质: 、
、 、
、 、
、 、
、 。已知该反应中
。已知该反应中 只发生过程:
只发生过程: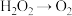 。该反应中,发生还原反应的过程是:
。该反应中,发生还原反应的过程是:_______ →_______ 。
(3)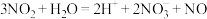 用单线桥表示反应电子转移方向和数目
用单线桥表示反应电子转移方向和数目_______ 。
(1)某同学设计如下实验研究
 的性质:
的性质:| 序号 | 实验 | 实验现象 |
| ⅰ | 向5% 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ⅱ | 向5% 溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 既有氧化性又有还原性的原因是
既有氧化性又有还原性的原因是②能证明
 具有还原性的实验是
具有还原性的实验是③配平方程式:
_______
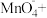 ______
______ _______
_______ _______
_______ _______
_______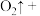 _______
_______
(2)某一反应体系有反应物和生成物共五种物质:
 、
、 、
、 、
、 、
、 。已知该反应中
。已知该反应中 只发生过程:
只发生过程: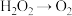 。该反应中,发生还原反应的过程是:
。该反应中,发生还原反应的过程是:(3)
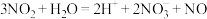 用单线桥表示反应电子转移方向和数目
用单线桥表示反应电子转移方向和数目
您最近半年使用:0次
解题方法
9 . 实验小组对Na2S2O3分别与FeCl3、Fe2(SO4)3的反应进行实验探究。 实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。实验过程
资料:i.Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;
ii.Fe3++
 Fe(S2O3)+(暗紫色),Fe2+遇
Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象
(1)向试管中滴加溶液所用的仪器是___________ ;配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:___________ 。
(2)对实验I中现象产生的原因探究如下:
①证明有Fe2+生成:取实验I中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到___________ 。
②实验I中紫色褪去时 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是___________ 。
③实验I和II对比,I中出现淡黄色浑浊,而II中不出现淡黄色浑浊的原因是___________ 。
(3)为探究实验II和III中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是___________ 。
②由实验IV和实验V得出的结论是___________ 。
| 实验编号 | I | II | III |
| 实验操作 | 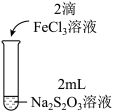 | 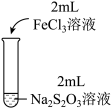 | 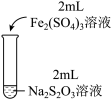 |
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色静置后紫色褪去,久置后不出现淡黄色浑浊 | 溶液呈紫色,静置后紫色缓慢褪去,久置后不出现淡黄色浑浊 |
ii.Fe3++

 Fe(S2O3)+(暗紫色),Fe2+遇
Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象(1)向试管中滴加溶液所用的仪器是
(2)对实验I中现象产生的原因探究如下:
①证明有Fe2+生成:取实验I中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到
②实验I中紫色褪去时
 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是③实验I和II对比,I中出现淡黄色浑浊,而II中不出现淡黄色浑浊的原因是
(3)为探究实验II和III中紫色褪去快慢不同的原因,设计实验如下:
| 实验编号 | IV | V |
| 实验操作 | 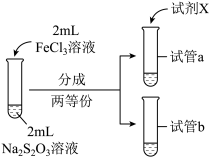 | 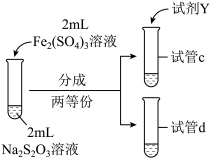 |
| 实验现象 | 紫色褪去时间a>b | 紫色褪去时间c<d |
②由实验IV和实验V得出的结论是
您最近半年使用:0次
10 . 过二硫酸钾( )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
实验(一):探究过二硫酸钾的强氧化性。
探究 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:
(1)同学甲用碰撞理论分析,实验Ⅰ中 和
和 反应很慢的主要原因是
反应很慢的主要原因是___________
(2)同学乙猜想实验Ⅱ中 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:
(ⅰ)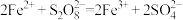 ;(ⅱ)___________。
;(ⅱ)___________。
①补充反应(ⅱ):___________ 。
②请你设计实验证明同学乙的猜想:___________ 。
(3)查阅文献知,氧化性: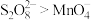 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是___________ ,该反应的离子方程式为___________ 。
实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
取适量的 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
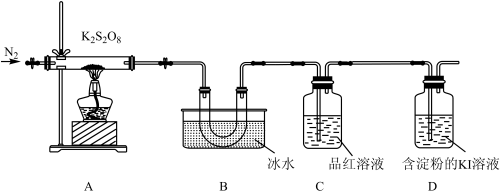
(4)加热之前,先通入一段时间 ,当观察到D中
,当观察到D中___________ (填实验现象)时点燃酒精灯。
(5)B中U形管收集的物质是___________ (填化学式)。
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为___________ 。
 )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。实验(一):探究过二硫酸钾的强氧化性。
探究
 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:| 实验 | 操作 | 现象 |
| Ⅰ | 在10L含淀粉的 的 的 溶液中滴加 溶液中滴加   溶液 溶液 | 一段时间后,溶液缓慢变蓝 |
| Ⅱ | 在 含淀粉的 含淀粉的 的 的 溶液中先滴几滴 溶液中先滴几滴 的 的 溶液,再滴加 溶液,再滴加   溶液 溶液 | 溶液迅速变蓝 |
 和
和 反应很慢的主要原因是
反应很慢的主要原因是(2)同学乙猜想实验Ⅱ中
 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:(ⅰ)
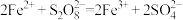 ;(ⅱ)___________。
;(ⅱ)___________。①补充反应(ⅱ):
②请你设计实验证明同学乙的猜想:
(3)查阅文献知,氧化性:
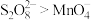 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
| 气体 |  |  |  |
| 熔点/℃ | 16.8 | -72.7 | -218.4 |
| 沸点/℃ | 44.8 | -10 | -182.9 |
 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
(4)加热之前,先通入一段时间
 ,当观察到D中
,当观察到D中(5)B中U形管收集的物质是
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中
 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为
您最近半年使用:0次
2022-04-13更新
|
532次组卷
|
5卷引用:陕西省榆林市2022届高三第二次联考化学试题
陕西省榆林市2022届高三第二次联考化学试题(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题甘肃省兰州第一中学2022-2023学年高三上学期期中考试化学试题热点1物质性质探究类实验



