名校
解题方法
1 . 工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: 难溶于水;
难溶于水;
②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1) 中Cu的化合价为
中Cu的化合价为___________ ,酸浸过程中, 反应的离子方程式
反应的离子方程式___________ 。
(2)检验“酸浸”液中是否含 ,可选择
,可选择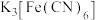 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是___________ 。
(3)氧化后,从反应体系中分离出 粗产品的操作名称是
粗产品的操作名称是___________ 。
(4)上述流程中,基态原子未成对电子数最多的金属元素名称是___________ 。
(5)向 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式___________ 。
(6)已知常温下, ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: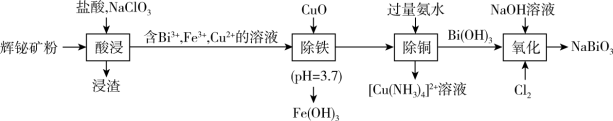
 难溶于水;
难溶于水;②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1)
 中Cu的化合价为
中Cu的化合价为 反应的离子方程式
反应的离子方程式(2)检验“酸浸”液中是否含
 ,可选择
,可选择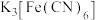 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是(3)氧化后,从反应体系中分离出
 粗产品的操作名称是
粗产品的操作名称是(4)上述流程中,基态原子未成对电子数最多的金属元素名称是
(5)向
 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式(6)已知常温下,
 ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=
您最近一年使用:0次
2 . 五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料(含V2O3、FeO、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
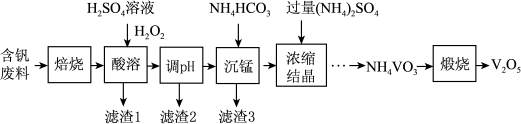
已知:25℃时,难溶电解质的溶度积常数如表所示:
(1)“焙烧”的目的是___________ 。
(2)酸溶时加入H2O2的目的是___________ 。
(3)常温下,若“调pH”为7,Cu2+是否能沉淀完全:___________ (填“是”或“否”)(溶液中离子浓度小于10−5 mol∙L−1时,认为该离子沉淀完全)。
(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为___________ 。
(5)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为___________ 。
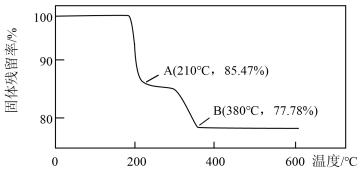
(6)在煅烧NH4VO3生成的V2O5过程中,固体残留率= ×100%随温度变化的曲线如图所示。其分解过程中,A点失去的物质是
×100%随温度变化的曲线如图所示。其分解过程中,A点失去的物质是________ (填写化学式)。
(7)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入过量稀硫酸使其完全反应,生成(VO2)2SO4,并配成100mL溶液。取10.00mL溶液用0.1000 mol∙L−1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO 黄色(被还原为VO2+蓝色),该反应的离子方程式:
黄色(被还原为VO2+蓝色),该反应的离子方程式:___________ ;该产品的纯度为___________ 。

已知:25℃时,难溶电解质的溶度积常数如表所示:
| 难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
| Ksp | 2.2×10−20 | 4×10−14 | 1.9×10−33 |
(2)酸溶时加入H2O2的目的是
(3)常温下,若“调pH”为7,Cu2+是否能沉淀完全:
(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为
(5)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为
(6)在煅烧NH4VO3生成的V2O5过程中,固体残留率=
 ×100%随温度变化的曲线如图所示。其分解过程中,A点失去的物质是
×100%随温度变化的曲线如图所示。其分解过程中,A点失去的物质是
(7)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入过量稀硫酸使其完全反应,生成(VO2)2SO4,并配成100mL溶液。取10.00mL溶液用0.1000 mol∙L−1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO
 黄色(被还原为VO2+蓝色),该反应的离子方程式:
黄色(被还原为VO2+蓝色),该反应的离子方程式:
您最近一年使用:0次
解题方法
3 . 实验小组对Na2S2O3分别与FeCl3、Fe2(SO4)3的反应进行实验探究。 实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。实验过程
资料:i.Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;
ii.Fe3++
 Fe(S2O3)+(暗紫色),Fe2+遇
Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象
(1)向试管中滴加溶液所用的仪器是___________ ;配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:___________ 。
(2)对实验I中现象产生的原因探究如下:
①证明有Fe2+生成:取实验I中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到___________ 。
②实验I中紫色褪去时 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是___________ 。
③实验I和II对比,I中出现淡黄色浑浊,而II中不出现淡黄色浑浊的原因是___________ 。
(3)为探究实验II和III中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是___________ 。
②由实验IV和实验V得出的结论是___________ 。
| 实验编号 | I | II | III |
| 实验操作 | 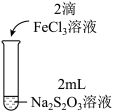 | 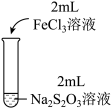 | 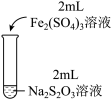 |
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色静置后紫色褪去,久置后不出现淡黄色浑浊 | 溶液呈紫色,静置后紫色缓慢褪去,久置后不出现淡黄色浑浊 |
ii.Fe3++

 Fe(S2O3)+(暗紫色),Fe2+遇
Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象(1)向试管中滴加溶液所用的仪器是
(2)对实验I中现象产生的原因探究如下:
①证明有Fe2+生成:取实验I中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到
②实验I中紫色褪去时
 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是③实验I和II对比,I中出现淡黄色浑浊,而II中不出现淡黄色浑浊的原因是
(3)为探究实验II和III中紫色褪去快慢不同的原因,设计实验如下:
| 实验编号 | IV | V |
| 实验操作 | 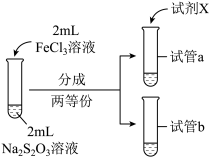 | 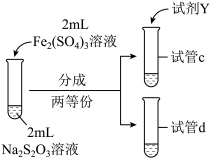 |
| 实验现象 | 紫色褪去时间a>b | 紫色褪去时间c<d |
②由实验IV和实验V得出的结论是
您最近一年使用:0次
名校
4 . 氯化亚铜(CuCl)是白色粉末,微溶于水,广泛应用于化工和印染等行业。某研究性学习小组模拟热分解CuCl2•2H2O制备CuCl的过程,并进行相关物质转化的探究。
已知:酸性条件下Cu+不稳定

下列说法不正确的是
已知:酸性条件下Cu+不稳定

下列说法不正确的是
| A.X气体是HCl,可抑制CuCl2•2H2O加热时水解 |
| B.途径1中产生的Cl2可以回收利用,也可以通入饱和NaOH溶液中除去 |
C.途径2中200℃时反应的化学方程式为Cu2(OH)2Cl2 2CuO+2HCl↑ 2CuO+2HCl↑ |
D.CuCl与稀硫酸反应的离子方程式为2Cu++4H++SO =2Cu2++SO2↑+2H2O =2Cu2++SO2↑+2H2O |
您最近一年使用:0次
2023-04-12更新
|
1048次组卷
|
7卷引用:陕西省西安市长安区第一中学2023-2024学年高三上学期第三次教学质量检测(期中)化学试题
陕西省西安市长安区第一中学2023-2024学年高三上学期第三次教学质量检测(期中)化学试题北京市顺义区2023届高三下学期第二次化学统练题(已下线)专题10 物质的反应及转化(已下线)第07练 元素及其化合物基础知识和应用 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题江西省丰城中学2023-2024学年高三上学期开学考试化学试题河南省中原名校联盟2024届高三上学期9月调研考试化学试题
解题方法
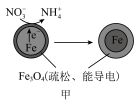
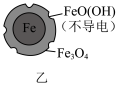
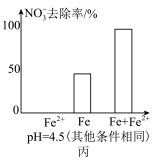
5 . 用零价铁去除酸性水体中的 是地下水修复研究的热点之一、下列说法错误的是
是地下水修复研究的热点之一、下列说法错误的是
 是地下水修复研究的热点之一、下列说法错误的是
是地下水修复研究的热点之一、下列说法错误的是
|
|
|
铁粉还原水体中 的反应原理示意图(已知:形成了原电池) 的反应原理示意图(已知:形成了原电池) | 足量铁粉还原水体中的 后,铁表面最终的形态示意图 后,铁表面最终的形态示意图 | 初始 的水体中,分别加入 的水体中,分别加入 、Fe(足量)、Fe(足量)和 、Fe(足量)、Fe(足量)和 时 时 去除率(%)的对比图像 去除率(%)的对比图像 |
| A.图甲中电极Fe发生氧化反应 |
B.图甲中正极发生的电极反应式为 |
C.当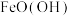 附着在Fe表面后会阻碍零价铁还原水体中的 附着在Fe表面后会阻碍零价铁还原水体中的 |
D.由图丙可知,去除 时,若只加入适量 时,若只加入适量 ,就可直接还原 ,就可直接还原 ,从而提高 ,从而提高 的去除率 的去除率 |
您最近一年使用:0次
名校
解题方法
6 . 碱式硫酸铁[Fe(OH)SO4]是一种絮疑剂,常用于污水处理。工业上利用废铁屑(含少量Al2O3、Fe2O3等)生产碱式硫酸铁的工艺流程如图所示。
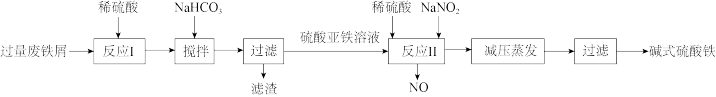
下列说法错误的是

下列说法错误的是
| A.“反应I”后的溶液中主要存在的阳离子有H+、Fe2+、Al3+ |
| B.“反应II”中加入稀硫酸可抑制Fe3+的水解 |
C.“反应II”对应的离子方程式为Fe2++NO +2H+=Fe3++NO↑+H2O +2H+=Fe3++NO↑+H2O |
| D.若用O2代替NaNO2,则每消耗112mL(标准状况)O2相当于节约了2.76gNaNO2 |
您最近一年使用:0次
2022-08-23更新
|
827次组卷
|
3卷引用:陕西省西安市2023届高三上学期8月联考化学试题
名校
7 . 三氧化二铬(Cr2O3) 是一种深绿色的固体,熔点很高,难溶于水,其化学性质类似于Al2O3,水溶液中Cr(+3)具有还原性。下列关于Cr2O3的说法错误的是
| A.与稀硫酸反应: Cr2O3+ 3H2SO4 = Cr2(SO4)3+ 3H2O |
B.与NaOH溶液反应: Cr2O3+ 4OH- = 2 +2H2O +2H2O |
C.碱性条件下被H2O2氧化为Cr(+6): Cr2O3+ 3H2O2+ 4OH- =2 + 5H2O + 5H2O |
| D.由于金属性铝强于铬,且铬的熔点较高,故可用铝热法还原Cr2O3制取金属铬 |
您最近一年使用:0次
2022-05-31更新
|
1460次组卷
|
5卷引用:陕西省西安市蓝田县乡镇高中联考2023-2024学年高一上学期11月期中化学试题
陕西省西安市蓝田县乡镇高中联考2023-2024学年高一上学期11月期中化学试题内蒙古自治区赤峰市2022届高三下学期4月模拟考试理综合化学试题(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)河北省昌黎第一中学2023届高三上学期第二次调研考试化学试题河南省濮阳市油田第一中学2024届高三上学期第一次考试理科综合化学试题
解题方法
8 . I.化合物甲和化合物乙的混合粉末是汽车安全气囊中存放的化学物质,经组成分析,确定该混合粉末仅含 Na、Fe、N、O 四种元素。为研究安全气囊工作的化学原理,进行以下实验操作:
(1)工业上冶炼单质2的化学方程式为________ ;
(2)若化合物丙在空气中转化为碳酸氢盐,则反应的化学方程式为________ ;
(3)化合物甲可用下列方法制备:30℃时,将水合肼(N2H4•H2O)、亚硝酸甲酯(CH3ONO)、NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式________ 。
II.晶体硅是一种重要的非金属材料。实验室用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略)。制备纯硅的主要反应为:SiHCl3+H2 = Si(纯)+3HCl
请回答下列问题:
(1)下列说法不正确的是___________ ;
A.装置B中的溶液可以是浓硫酸
B.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的 SiHCl3 气化
C.装置D中观察到的现象是有固体物质生成
D.装置D可以采用普通玻璃管代替石英管
E.为保证制备纯硅实验的成功,关键的操作步骤有检查实验装置的气密性,控制好反应温度以及排尽装置中的空气、干燥气体
F.尾气处理装置中可以将导管直接插入盛有NaOH 溶液的烧杯中
(2)为检验某粗硅中存在的铁元素,可采取的实验操作方法是__________ ;

(1)工业上冶炼单质2的化学方程式为
(2)若化合物丙在空气中转化为碳酸氢盐,则反应的化学方程式为
(3)化合物甲可用下列方法制备:30℃时,将水合肼(N2H4•H2O)、亚硝酸甲酯(CH3ONO)、NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式
II.晶体硅是一种重要的非金属材料。实验室用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略)。制备纯硅的主要反应为:SiHCl3+H2 = Si(纯)+3HCl

请回答下列问题:
(1)下列说法不正确的是
A.装置B中的溶液可以是浓硫酸
B.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的 SiHCl3 气化
C.装置D中观察到的现象是有固体物质生成
D.装置D可以采用普通玻璃管代替石英管
E.为保证制备纯硅实验的成功,关键的操作步骤有检查实验装置的气密性,控制好反应温度以及排尽装置中的空气、干燥气体
F.尾气处理装置中可以将导管直接插入盛有NaOH 溶液的烧杯中
(2)为检验某粗硅中存在的铁元素,可采取的实验操作方法是
您最近一年使用:0次
2020-06-22更新
|
586次组卷
|
2卷引用:陕西省西安市选课分科摸底考2023-2024学年高一下学期4月月考化学试题
名校
解题方法
9 . 工业上用发烟HClO4将潮湿的CrC13氧化为棕色的烟[CrO2(C1O4)2],来除去Cr(Ⅲ),HClO4中部分氯元素转化为最低价态。下列说法错误的是( )
| A.CrO2(C1O4)2中Cr元素显+6价 |
| B.HClO4属于强酸,该反应还生成了另一种强酸 |
| C.该反应中,参加反应的氧化剂与氧化产物的物质的量之比为3:8 |
D.该反应离子方程式为19ClO +8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O +8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O |
您最近一年使用:0次
2020-06-28更新
|
1860次组卷
|
12卷引用:陕西省西安市长安区第一中学2021-2022学年高二下学期期末考试化学试题
陕西省西安市长安区第一中学2021-2022学年高二下学期期末考试化学试题山东省济南二中2020届高三线上检测化学试题山东省日照市五莲县2020届高三上学期10月模块诊断性测试化学试题山东省滨州市2020届高三第三次模拟考试化学试题(已下线)专题04 氧化还原反应-2020年高考真题和模拟题化学分项汇编(已下线)易错05 氧化还原反应概念及规律-备战2021年高考化学一轮复习易错题湖南省长沙市雅礼中学2021届高三上学期第一次月考化学试题河北省石家庄精英中学2021届高三二轮专题一阶段考试化学试卷(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)重庆市南开中学校2021--2022学年高一上学期期末化学试题黑龙江省大庆铁人中学2022-2023学年高一上学期期末考试化学试题(已下线)第5讲 氧化还原反应方程式的配平与计算
10 . 已知:2Fe2++Br2=2Fe3++2Br-,2Br-+Cl2=Br2+2Cl- , 2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。下列有关说法中,正确的是
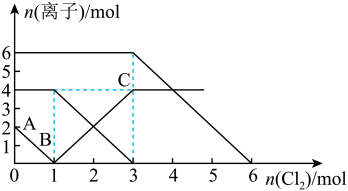

| A.还原性:I-<Fe2+<Br- |
| B.当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| C.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
| D.原混合溶液中FeBr2的物质的量为6mol |
您最近一年使用:0次
2020-11-19更新
|
661次组卷
|
2卷引用:陕西省西安市蓝田县城关中学大学区联考2023-2024学年高一上学期1月期末化学试题