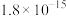解题方法
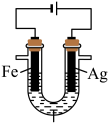
1 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制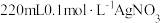 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: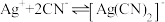 ,
,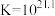 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是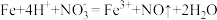 和
和___________ (用离子方程式表示,已知氧化性: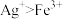 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中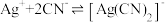 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为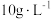 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为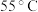 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由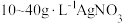 溶液和
溶液和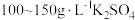 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: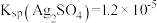 。
。
I.实验准备。
(1)用
 固体配制
固体配制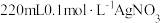 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
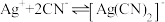 ,
,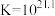 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的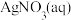 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
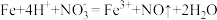 和
和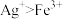 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
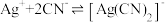 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(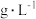 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为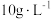 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
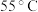 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
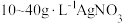 溶液和
溶液和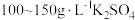 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
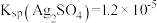 。
。
您最近半年使用:0次
7日内更新
|
121次组卷
|
3卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2 . 二氧化钒(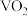 )是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以
)是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以 为原料合成用于制备
为原料合成用于制备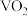 的氧钒(
的氧钒(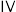 )碱式碳酸铵晶体。过程如下:
)碱式碳酸铵晶体。过程如下:
(1)步骤i中生成 的同时还产生一种无色无污染的气体,所发生反应的化学方程式为
的同时还产生一种无色无污染的气体,所发生反应的化学方程式为___________ 。只用浓盐酸与 反应也能制备
反应也能制备 溶液,从安全与环保角度分析,该反应不被推广的主要原因是
溶液,从安全与环保角度分析,该反应不被推广的主要原因是___________ 。
(2)步骤ii可用如图仪器组装完成。___________ (用各接口字母表示)。
②B装置的作用是___________ 。
③反应结束后,将三颈烧瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和
溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和 溶液洗涤除去的阴离子主要是
溶液洗涤除去的阴离子主要是___________ ,用无水乙醇洗涤的目的是___________ 。
(3)测定氧钒(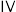 )碱式碳酸铵晶体粗产品中钒的含量。
)碱式碳酸铵晶体粗产品中钒的含量。
称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%  溶液至稍过量。再用尿素除去过量的
溶液至稍过量。再用尿素除去过量的 ,滴入几滴铁氰化钾{
,滴入几滴铁氰化钾{ }溶液,最后用c mol/L
}溶液,最后用c mol/L  标准溶液滴定至终点,消耗体积为b mL。滴定反应为:
标准溶液滴定至终点,消耗体积为b mL。滴定反应为: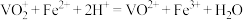 。
。
① 溶液的作用是
溶液的作用是___________ 。
②粗产品中钒的质量分数的表达式为___________ 。
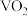 )是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以
)是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以 为原料合成用于制备
为原料合成用于制备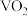 的氧钒(
的氧钒(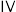 )碱式碳酸铵晶体。过程如下:
)碱式碳酸铵晶体。过程如下:
(1)步骤i中生成
 的同时还产生一种无色无污染的气体,所发生反应的化学方程式为
的同时还产生一种无色无污染的气体,所发生反应的化学方程式为 反应也能制备
反应也能制备 溶液,从安全与环保角度分析,该反应不被推广的主要原因是
溶液,从安全与环保角度分析,该反应不被推广的主要原因是(2)步骤ii可用如图仪器组装完成。
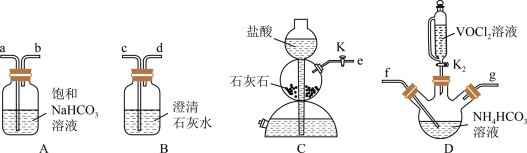
②B装置的作用是
③反应结束后,将三颈烧瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和
 溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和
溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和 溶液洗涤除去的阴离子主要是
溶液洗涤除去的阴离子主要是(3)测定氧钒(
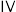 )碱式碳酸铵晶体粗产品中钒的含量。
)碱式碳酸铵晶体粗产品中钒的含量。称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L
 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%  溶液至稍过量。再用尿素除去过量的
溶液至稍过量。再用尿素除去过量的 ,滴入几滴铁氰化钾{
,滴入几滴铁氰化钾{ }溶液,最后用c mol/L
}溶液,最后用c mol/L  标准溶液滴定至终点,消耗体积为b mL。滴定反应为:
标准溶液滴定至终点,消耗体积为b mL。滴定反应为: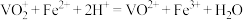 。
。①
 溶液的作用是
溶液的作用是②粗产品中钒的质量分数的表达式为
您最近半年使用:0次
解题方法
3 . 四氧化三锰( )是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备高纯
)是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备高纯 的工艺流程如下图所示。
的工艺流程如下图所示。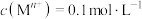 ]形成氢氧化物沉淀的pH范围如下表:
]形成氢氧化物沉淀的pH范围如下表:
回答下列问题:
(1)“氧化”中添加适量的 的作用是
的作用是___________ (用离子方程式表示)。
(2)“除杂1”的目的是除去 、
、 等杂质离子,则“滤渣3”中主要有
等杂质离子,则“滤渣3”中主要有___________ ,“调pH”时溶液的pH范围应调节为___________ 之间。
(3)“除杂2”的目的是生成 沉淀除去
沉淀除去 ,若溶液酸度过高,会导致
,若溶液酸度过高,会导致___________ 。
(4))常温下,利用表格中的数据,计算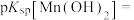
___________ (已知 )。
)。
(5)在“沉锰”时,可用尿素[ ]代替
]代替 ,同时控制温度在115~120℃,写出尿素“沉锰”反应的离子方程式
,同时控制温度在115~120℃,写出尿素“沉锰”反应的离子方程式___________ 。
(6) 和氨水混合在80℃下得到的
和氨水混合在80℃下得到的 的产率最高,若继续升高温度,会导致产率降低,原因可能是
的产率最高,若继续升高温度,会导致产率降低,原因可能是___________ 。
 )是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备高纯
)是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备高纯 的工艺流程如下图所示。
的工艺流程如下图所示。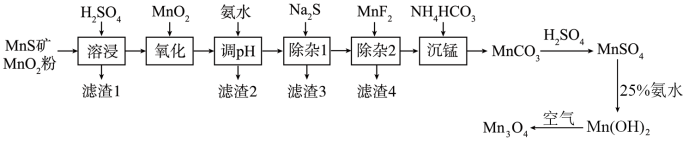
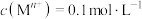 ]形成氢氧化物沉淀的pH范围如下表:
]形成氢氧化物沉淀的pH范围如下表:| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“氧化”中添加适量的
 的作用是
的作用是(2)“除杂1”的目的是除去
 、
、 等杂质离子,则“滤渣3”中主要有
等杂质离子,则“滤渣3”中主要有(3)“除杂2”的目的是生成
 沉淀除去
沉淀除去 ,若溶液酸度过高,会导致
,若溶液酸度过高,会导致(4))常温下,利用表格中的数据,计算
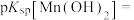
 )。
)。(5)在“沉锰”时,可用尿素[
 ]代替
]代替 ,同时控制温度在115~120℃,写出尿素“沉锰”反应的离子方程式
,同时控制温度在115~120℃,写出尿素“沉锰”反应的离子方程式(6)
 和氨水混合在80℃下得到的
和氨水混合在80℃下得到的 的产率最高,若继续升高温度,会导致产率降低,原因可能是
的产率最高,若继续升高温度,会导致产率降低,原因可能是
您最近半年使用:0次
解题方法
4 . 重铬酸钾是一种重要的化工原料,工业上以某含铬矿(主要成分为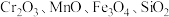 等)为主要原料制备重铬酸钾的工艺流程如图所示:
等)为主要原料制备重铬酸钾的工艺流程如图所示: 的条件下,
的条件下, (III)不能被氧化,高锰酸钾的还原产物是
(III)不能被氧化,高锰酸钾的还原产物是 。
。
回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有_______ (任写两条)。
(2)浸渣的主要成分为_______ (填化学式);“除铁、除锰”时沉锰的离子方程式为_______ 。
(3)“焙烧”时发生反应的化学方程式为_______ 。
(4)调 ”的目的是为了完成
”的目的是为了完成 和
和 的转换,涉及反应:
的转换,涉及反应: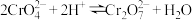 ;常温下,某
;常温下,某 溶液中含铬元素
溶液中含铬元素 ,调节溶液的
,调节溶液的 后两种离子的变化曲线如图所示,
后两种离子的变化曲线如图所示,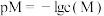 ,其中
,其中 可表示
可表示 或
或 ,图中表示
,图中表示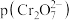 随
随 变化的曲线为
变化的曲线为_______ (填“X”或“Y”);其中反应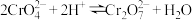 的平衡常数
的平衡常数
_______ 。 ”,在完成转换的同时制备
”,在完成转换的同时制备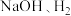 和
和 (装置如图所示):
(装置如图所示):_______ (填化学式),离子交换膜为_______ (填“阴离子”“质子”或“阳离子”)交换膜。
(6)“交换”过程中有关物质的溶解度如图所示,有同学认为结晶过滤的温度应是 和
和 溶解度相差最大的时候,你认为这个观点是否正确并说明理由:
溶解度相差最大的时候,你认为这个观点是否正确并说明理由:_______ 。
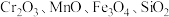 等)为主要原料制备重铬酸钾的工艺流程如图所示:
等)为主要原料制备重铬酸钾的工艺流程如图所示: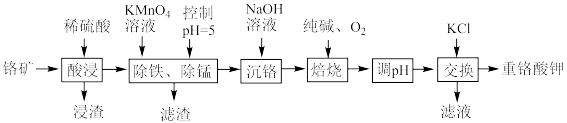
 的条件下,
的条件下, (III)不能被氧化,高锰酸钾的还原产物是
(III)不能被氧化,高锰酸钾的还原产物是 。
。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有
(2)浸渣的主要成分为
(3)“焙烧”时发生反应的化学方程式为
(4)调
 ”的目的是为了完成
”的目的是为了完成 和
和 的转换,涉及反应:
的转换,涉及反应: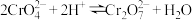 ;常温下,某
;常温下,某 溶液中含铬元素
溶液中含铬元素 ,调节溶液的
,调节溶液的 后两种离子的变化曲线如图所示,
后两种离子的变化曲线如图所示,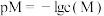 ,其中
,其中 可表示
可表示 或
或 ,图中表示
,图中表示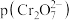 随
随 变化的曲线为
变化的曲线为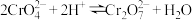 的平衡常数
的平衡常数

 ”,在完成转换的同时制备
”,在完成转换的同时制备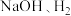 和
和 (装置如图所示):
(装置如图所示):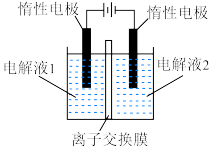
(6)“交换”过程中有关物质的溶解度如图所示,有同学认为结晶过滤的温度应是
 和
和 溶解度相差最大的时候,你认为这个观点是否正确并说明理由:
溶解度相差最大的时候,你认为这个观点是否正确并说明理由: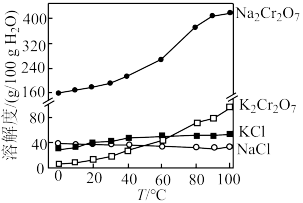
您最近半年使用:0次
名校
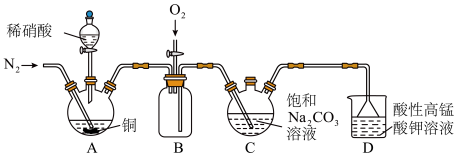
5 . 亚硝酸钠( )主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用
)主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用 表示)制备亚硝酸钠,简易流程如图。
表示)制备亚硝酸钠,简易流程如图。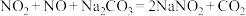 ,
,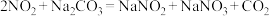
 溶液和饱和
溶液和饱和 溶液在加热条件下反应可制得
溶液在加热条件下反应可制得 ,该反应的化学方程式为
,该反应的化学方程式为_______ ;实验时装置B中应间断性通入适量的 ,其目的是
,其目的是_______ 。
(2)装置C中盛装饱和 溶液的仪器的名称是
溶液的仪器的名称是_______ ;NO不能单独被纯碱溶液吸收,为了使 完全被纯碱溶液吸收且产品纯度最高,
完全被纯碱溶液吸收且产品纯度最高,
_______ 。
(3)装置D的作用是_______ ,采用“倒置漏斗”措施的目的是_______ 。
(4)设计实验探究 的性质。制备
的性质。制备 实验完毕后,从装置C中分离出
实验完毕后,从装置C中分离出 固体粗产品(不含
固体粗产品(不含 杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
上述实验_______ (填标号)的结论不可靠。经实验测得实验丙反应后的溶液中氮元素仅以 的形式存在,酸性
的形式存在,酸性 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为_______ 。
 )主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用
)主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用 表示)制备亚硝酸钠,简易流程如图。
表示)制备亚硝酸钠,简易流程如图。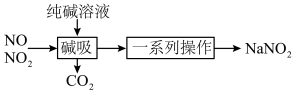
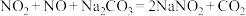 ,
,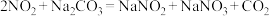
 溶液和饱和
溶液和饱和 溶液在加热条件下反应可制得
溶液在加热条件下反应可制得 ,该反应的化学方程式为
,该反应的化学方程式为 ,其目的是
,其目的是(2)装置C中盛装饱和
 溶液的仪器的名称是
溶液的仪器的名称是 完全被纯碱溶液吸收且产品纯度最高,
完全被纯碱溶液吸收且产品纯度最高,
(3)装置D的作用是
(4)设计实验探究
 的性质。制备
的性质。制备 实验完毕后,从装置C中分离出
实验完毕后,从装置C中分离出 固体粗产品(不含
固体粗产品(不含 杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。| 实验 | 实验操作及现象 | 结论 |
| 甲 | 滴入无色酚酞溶液中,无色酚酞溶液变红 |  是弱酸 是弱酸 |
| 乙 | 滴入少量酸性KI-淀粉溶液中,振荡,酸性KI-淀粉溶液变蓝 | 酸性条件下 具有氧化性 具有氧化性 |
| 丙 | 滴入少量酸性 溶液中,振荡,酸性 溶液中,振荡,酸性 溶液褪色 溶液褪色 | 酸性条件 具有还原性 具有还原性 |
 的形式存在,酸性
的形式存在,酸性 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为
您最近半年使用:0次
解题方法
6 . 被誉为“工业维他命”的铂族金属钌(Ru)广泛用于航天航空、石油化学、信息传感工业、制药等高科技领域。以下工艺实现了电子废弃物中铂族金属钌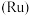 的回收利用。已知电子废弃物主要成分为
的回收利用。已知电子废弃物主要成分为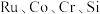 等物质,请回答以下问题:
等物质,请回答以下问题: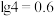 ②常见物质的
②常见物质的 如下表所示:
如下表所示:
(1)为加快“酸浸”时的浸取速率,下列措施中无法达到目的是______ (填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加盐酸浓度 e.适当升高温度
(2)滤渣2为______ 。
(3)“氧化溶浸”环节生成配离子 反应的离子方程式为
反应的离子方程式为______ 。
(4)“还原1”环节所需氧化剂和还原剂的物质的量之比为1:1,则 的氧化产物为
的氧化产物为______ 。
(5)滤液1中含 和
和 的浓度分别为
的浓度分别为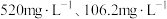 ,“调
,“调 ”时调
”时调 的范围为
的范围为______ 。(已知:当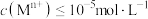 时,可认为
时,可认为 已经沉淀完全)
已经沉淀完全)
(6)沉钴。向除杂后的 溶液中加入
溶液中加入 溶液或
溶液或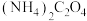 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替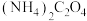 溶液的原因是
溶液的原因是______ 。
(7)制备 。将所得的
。将所得的 草酸钴晶体
草酸钴晶体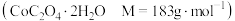 高温灼烧,其热重分析曲线如图:
高温灼烧,其热重分析曲线如图: 点对应的物质的化学式:
点对应的物质的化学式:______ ,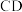 段发生反应的化学方程式为:
段发生反应的化学方程式为:______ 。
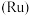 的回收利用。已知电子废弃物主要成分为
的回收利用。已知电子废弃物主要成分为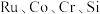 等物质,请回答以下问题:
等物质,请回答以下问题: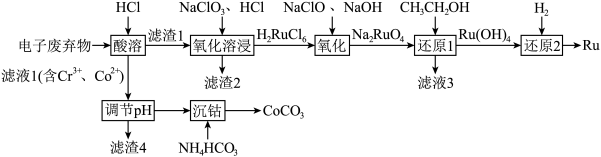
 ②常见物质的
②常见物质的 如下表所示:
如下表所示:化合物 |
|
|
|
|
|
(1)为加快“酸浸”时的浸取速率,下列措施中无法达到目的是
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加盐酸浓度 e.适当升高温度
(2)滤渣2为
(3)“氧化溶浸”环节生成配离子
 反应的离子方程式为
反应的离子方程式为(4)“还原1”环节所需氧化剂和还原剂的物质的量之比为1:1,则
 的氧化产物为
的氧化产物为(5)滤液1中含
 和
和 的浓度分别为
的浓度分别为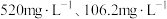 ,“调
,“调 ”时调
”时调 的范围为
的范围为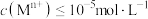 时,可认为
时,可认为 已经沉淀完全)
已经沉淀完全)(6)沉钴。向除杂后的
 溶液中加入
溶液中加入 溶液或
溶液或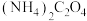 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替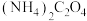 溶液的原因是
溶液的原因是(7)制备
 。将所得的
。将所得的 草酸钴晶体
草酸钴晶体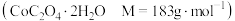 高温灼烧,其热重分析曲线如图:
高温灼烧,其热重分析曲线如图: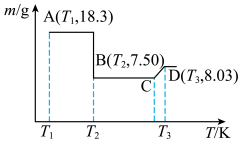
 点对应的物质的化学式:
点对应的物质的化学式: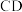 段发生反应的化学方程式为:
段发生反应的化学方程式为:
您最近半年使用:0次
7 . 利用含钴废料(主要成分为 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: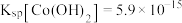 ;
;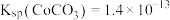 。
。
请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为 和
和___________ 。“酸浸”时 发生反应的总离子方程式为
发生反应的总离子方程式为___________ 。
(2)“萃取”时 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)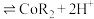 ,若萃取剂的量一定时,
,若萃取剂的量一定时,___________ (填“一次萃取”或“少量多次萃取”)的萃取效率更高。若“酸浸”后浸出液的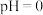 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为___________ (结果保留一位小数,溶液体积变化忽略不计)。
(3)“沉锰”时, 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为___________ 。
(4)可以通过电解 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是___________ 。若Ⅱ室溶液中溶质的质量增加了 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为___________ 。
 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: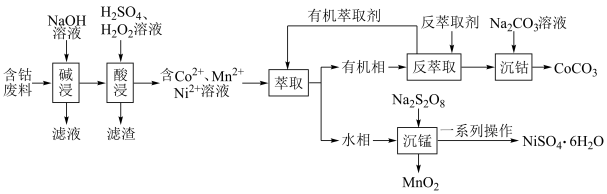
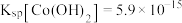 ;
;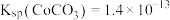 。
。请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为
 和
和 发生反应的总离子方程式为
发生反应的总离子方程式为(2)“萃取”时
 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)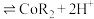 ,若萃取剂的量一定时,
,若萃取剂的量一定时,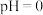 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为(3)“沉锰”时,
 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为(4)可以通过电解
 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为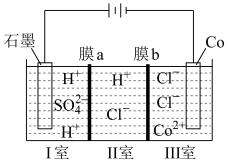
您最近半年使用:0次
名校
解题方法
8 . 工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: 难溶于水;
难溶于水;
②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1) 中Cu的化合价为
中Cu的化合价为___________ ,酸浸过程中, 反应的离子方程式
反应的离子方程式___________ 。
(2)检验“酸浸”液中是否含 ,可选择
,可选择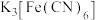 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是___________ 。
(3)氧化后,从反应体系中分离出 粗产品的操作名称是
粗产品的操作名称是___________ 。
(4)上述流程中,基态原子未成对电子数最多的金属元素名称是___________ 。
(5)向 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式___________ 。
(6)已知常温下,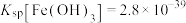 ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
 难溶于水;
难溶于水;②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1)
 中Cu的化合价为
中Cu的化合价为 反应的离子方程式
反应的离子方程式(2)检验“酸浸”液中是否含
 ,可选择
,可选择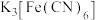 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是(3)氧化后,从反应体系中分离出
 粗产品的操作名称是
粗产品的操作名称是(4)上述流程中,基态原子未成对电子数最多的金属元素名称是
(5)向
 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式(6)已知常温下,
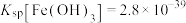 ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=
您最近半年使用:0次
解题方法
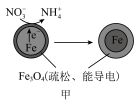
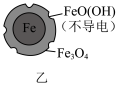
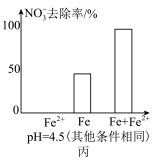
9 . 用零价铁去除酸性水体中的 是地下水修复研究的热点之一、下列说法错误的是
是地下水修复研究的热点之一、下列说法错误的是
 是地下水修复研究的热点之一、下列说法错误的是
是地下水修复研究的热点之一、下列说法错误的是
|
|
|
铁粉还原水体中 的反应原理示意图(已知:形成了原电池) 的反应原理示意图(已知:形成了原电池) | 足量铁粉还原水体中的 后,铁表面最终的形态示意图 后,铁表面最终的形态示意图 | 初始 的水体中,分别加入 的水体中,分别加入 、Fe(足量)、Fe(足量)和 、Fe(足量)、Fe(足量)和 时 时 去除率(%)的对比图像 去除率(%)的对比图像 |
| A.图甲中电极Fe发生氧化反应 |
B.图甲中正极发生的电极反应式为 |
C.当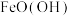 附着在Fe表面后会阻碍零价铁还原水体中的 附着在Fe表面后会阻碍零价铁还原水体中的 |
D.由图丙可知,去除 时,若只加入适量 时,若只加入适量 ,就可直接还原 ,就可直接还原 ,从而提高 ,从而提高 的去除率 的去除率 |
您最近半年使用:0次
解题方法
10 . 铋酸钠( ,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为
,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为 ,含
,含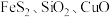 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图。
的工艺流程如图。
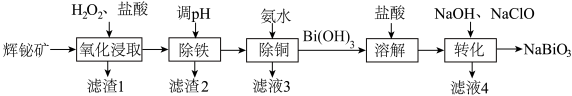
已知:“氧化浸取”时,铋元素转化为 ,硫元素转化为硫单质。回答下列问题:
,硫元素转化为硫单质。回答下列问题:
(1) 中铋元素的化合价为
中铋元素的化合价为___________ 价;“氧化浸取”时温度不能过高的原因是___________ ;“氧化浸取”时 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(2)“滤渣1”的主要成分为硫单质和___________ (写化学式)。
(3)“除铜”时,发生反应 ,该反应的平衡常数
,该反应的平衡常数
___________ 。{已知
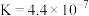 }
}
(4)在酸性介质中, 可将
可将 氧化为
氧化为 ,反应后
,反应后 元素呈
元素呈 价,则向足量稀硫酸和
价,则向足量稀硫酸和 稀溶液的混合溶液中加入
稀溶液的混合溶液中加入 时,反应中n(氧化剂):n(还原剂)=
时,反应中n(氧化剂):n(还原剂)=___________ 。
(5)“转化”时生成 反应的离子方程式为
反应的离子方程式为___________ 。
 ,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为
,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为 ,含
,含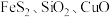 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图。
的工艺流程如图。
已知:“氧化浸取”时,铋元素转化为
 ,硫元素转化为硫单质。回答下列问题:
,硫元素转化为硫单质。回答下列问题:(1)
 中铋元素的化合价为
中铋元素的化合价为 发生反应的化学方程式为
发生反应的化学方程式为(2)“滤渣1”的主要成分为硫单质和
(3)“除铜”时,发生反应
 ,该反应的平衡常数
,该反应的平衡常数

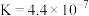 }
}(4)在酸性介质中,
 可将
可将 氧化为
氧化为 ,反应后
,反应后 元素呈
元素呈 价,则向足量稀硫酸和
价,则向足量稀硫酸和 稀溶液的混合溶液中加入
稀溶液的混合溶液中加入 时,反应中n(氧化剂):n(还原剂)=
时,反应中n(氧化剂):n(还原剂)=(5)“转化”时生成
 反应的离子方程式为
反应的离子方程式为
您最近半年使用:0次