名校
1 .  具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
Ⅰ.下列是制备 的一种流程:
的一种流程:
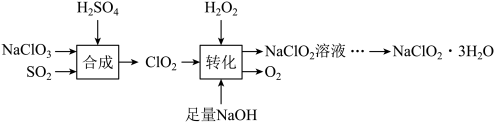
已知: 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 。
。
(1)写出“合成”中发生反应的离子方程式:___________ 。若生成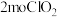 时,电子转移的数目是
时,电子转移的数目是___________ 。
(2)“转化”过程中 的作用是
的作用是___________ (选填“氧化剂”或“还原剂”),写出反应的化学方程式是___________ 。
(3)由 溶液得到
溶液得到 的操作为:蒸发浓缩,
的操作为:蒸发浓缩,___________ ,过滤洗涤,得到 产品。
产品。
Ⅱ.为确定产品的纯度,进行如下实验:
步骤1:取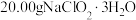 样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的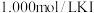 溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用
溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用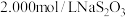 溶液滴定至终点。
溶液滴定至终点。
步骤3:重复以上操作2-3次测得滴定 溶液的平均体积为22.00mL。
溶液的平均体积为22.00mL。
已知: ,
,
(4)试计算该 样品的纯度
样品的纯度___________ 。
 具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。Ⅰ.下列是制备
 的一种流程:
的一种流程:
已知:
 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 。
。(1)写出“合成”中发生反应的离子方程式:
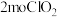 时,电子转移的数目是
时,电子转移的数目是(2)“转化”过程中
 的作用是
的作用是(3)由
 溶液得到
溶液得到 的操作为:蒸发浓缩,
的操作为:蒸发浓缩, 产品。
产品。Ⅱ.为确定产品的纯度,进行如下实验:
步骤1:取
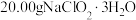 样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的
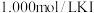 溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用
溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用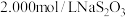 溶液滴定至终点。
溶液滴定至终点。步骤3:重复以上操作2-3次测得滴定
 溶液的平均体积为22.00mL。
溶液的平均体积为22.00mL。已知:
 ,
,
(4)试计算该
 样品的纯度
样品的纯度
您最近一年使用:0次
名校
解题方法
2 . 目前工业制备硫酸主要采用接触法,以黄铁矿( )为原料在沸腾炉制得
)为原料在沸腾炉制得 在经过氧化和和吸收获得硫酸。
在经过氧化和和吸收获得硫酸。
(1)请写出黄铁矿在沸腾炉里燃烧制得 的反应方程
的反应方程___________ ,若生成 气体标准状况下179.2L,则反应中转移的电子物质的量为
气体标准状况下179.2L,则反应中转移的电子物质的量为___________ 。
(2)某同学用如图装置(夹持装置略)探究铜丝与过量浓硫酸的反应,回答下列问题:

①铜与浓硫酸反应的化学方程式为___________ 。
②C中应加入的试剂为NaOH溶液,倒置漏斗的作用是___________ 。
③与向浓硫酸中直接加入铜片相比,该装置用可上下移动的铜丝,优点是:___________ 。
(3)油画的白色燃料中曾含二价铅盐,二价铅盐经过长时间空气(含有微量 )的侵蚀,生成PbS而变黑,可用一定量的
)的侵蚀,生成PbS而变黑,可用一定量的 溶液擦洗修复,
溶液擦洗修复, 与PbS反应生成
与PbS反应生成 的和
的和 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(4)硝酸是重要的化工原料,也是重要的氧化剂,将过量的铁投入到500mL的稀硝酸中,请写出对应的离子方程式___________ ,若生成标况下的气体为4.48L,则硝酸的物质的量浓度为___________ 。“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”,减少废气的排放是环境保护的重要内容之一,氮氧化物是形成光化学烟雾的主要元凶,利用碱液吸收法可以有效地吸收氮氧化物,发生的反应有 、
、
 ,若某混合气体中含a mol NO和b mol
,若某混合气体中含a mol NO和b mol  ,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为___________ 。
 )为原料在沸腾炉制得
)为原料在沸腾炉制得 在经过氧化和和吸收获得硫酸。
在经过氧化和和吸收获得硫酸。(1)请写出黄铁矿在沸腾炉里燃烧制得
 的反应方程
的反应方程 气体标准状况下179.2L,则反应中转移的电子物质的量为
气体标准状况下179.2L,则反应中转移的电子物质的量为(2)某同学用如图装置(夹持装置略)探究铜丝与过量浓硫酸的反应,回答下列问题:

①铜与浓硫酸反应的化学方程式为
②C中应加入的试剂为NaOH溶液,倒置漏斗的作用是
③与向浓硫酸中直接加入铜片相比,该装置用可上下移动的铜丝,优点是:
(3)油画的白色燃料中曾含二价铅盐,二价铅盐经过长时间空气(含有微量
 )的侵蚀,生成PbS而变黑,可用一定量的
)的侵蚀,生成PbS而变黑,可用一定量的 溶液擦洗修复,
溶液擦洗修复, 与PbS反应生成
与PbS反应生成 的和
的和 ,写出该反应的化学方程式
,写出该反应的化学方程式(4)硝酸是重要的化工原料,也是重要的氧化剂,将过量的铁投入到500mL的稀硝酸中,请写出对应的离子方程式
 、
、
 ,若某混合气体中含a mol NO和b mol
,若某混合气体中含a mol NO和b mol  ,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
您最近一年使用:0次
3 .  是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
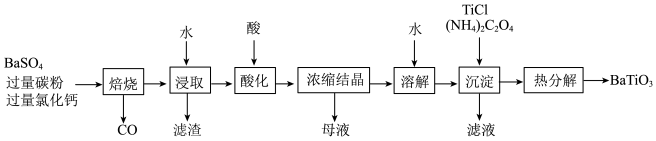
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是作___________ (填“还原剂”或“氧化剂”)。
(2)“焙烧”后固体产物有 、易溶于水的BaS,和微溶于水的CaS。焙烧反应过程中
、易溶于水的BaS,和微溶于水的CaS。焙烧反应过程中 和C的物质的量之比为
和C的物质的量之比为___________ 。
(3)“酸化”步骤应选用的酸是___________ (填标号)。
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?___________ ,其原因是___________ 。
(5)“沉淀”步骤中生成是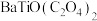 ,其中Ti的化合价为
,其中Ti的化合价为___________ 。
(6)“热分解”生成粉状的钛酸钡,同时产生了 和CO的混合气体,写出该步骤反应的化学方程式
和CO的混合气体,写出该步骤反应的化学方程式___________ 。
 是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是作
(2)“焙烧”后固体产物有
 、易溶于水的BaS,和微溶于水的CaS。焙烧反应过程中
、易溶于水的BaS,和微溶于水的CaS。焙烧反应过程中 和C的物质的量之比为
和C的物质的量之比为(3)“酸化”步骤应选用的酸是
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?
(5)“沉淀”步骤中生成是
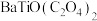 ,其中Ti的化合价为
,其中Ti的化合价为(6)“热分解”生成粉状的钛酸钡,同时产生了
 和CO的混合气体,写出该步骤反应的化学方程式
和CO的混合气体,写出该步骤反应的化学方程式
您最近一年使用:0次
4 . 单一盐R仅由Fe、N、O三种元素组成,某化学兴趣小组称取4.84 g盐R进行相关实验,数据和现象如下:
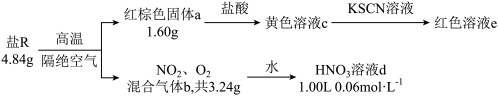
已知:①红棕色固体a为纯净物;
②混合气体b通入足量的水中,完全反应后,仅得到一种生成物;
③不考虑反应过程中的质量损失;
④ 遇KSCN溶液显血红色。
遇KSCN溶液显血红色。
回答下列问题:
(1)红棕色固体a为___________ (填化学式),其在生活中的用途有___________ (填一种即可)。
(2)盐R中Fe元素的化合价为___________ 价。
(3)写出盐R在上述条件下发生反应的化学方程式:___________ ,该反应中氧化产物与还原产物的总物质的量之比为___________ 。
(4)写出上述混合气体b通入水中发生反应的离子方程式:___________ 。
(5)研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铜加入上述所得的稀释后的溶液d中(假设溶液d很稀),恰好完全反应,无气体放出,则消耗铜的质量为___________ g。

已知:①红棕色固体a为纯净物;
②混合气体b通入足量的水中,完全反应后,仅得到一种生成物;
③不考虑反应过程中的质量损失;
④
 遇KSCN溶液显血红色。
遇KSCN溶液显血红色。回答下列问题:
(1)红棕色固体a为
(2)盐R中Fe元素的化合价为
(3)写出盐R在上述条件下发生反应的化学方程式:
(4)写出上述混合气体b通入水中发生反应的离子方程式:
(5)研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铜加入上述所得的稀释后的溶液d中(假设溶液d很稀),恰好完全反应,无气体放出,则消耗铜的质量为
您最近一年使用:0次
2023-04-18更新
|
252次组卷
|
6卷引用:陕西省西安市第八十三中学2022-2023学年高一下学期中考试化学试题
名校
解题方法
5 . 氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如图:
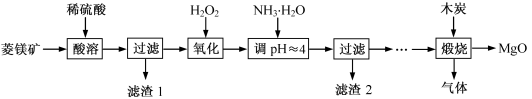
(1)MgCO3与稀硫酸反应的离子方程式为____ 。
(2)加入H2O2氧化时,发生反应的化学方程式为____ 。
(3)滤渣2的成分是____ (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;
MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是____ (填化学式)。
②A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:____ 。

(1)MgCO3与稀硫酸反应的离子方程式为
(2)加入H2O2氧化时,发生反应的化学方程式为
(3)滤渣2的成分是
(4)煅烧过程存在以下反应:
2MgSO4+C
 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;MgSO4+C
 MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;MgSO4+3C
 MgO+S↑+3CO↑。
MgO+S↑+3CO↑。利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是
②A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:
您最近一年使用:0次
2022-06-21更新
|
328次组卷
|
2卷引用:陕西省西安高级中学2021-2022学年高一上学期竞赛化学试题
名校
6 . 三氧化二铬(Cr2O3) 是一种深绿色的固体,熔点很高,难溶于水,其化学性质类似于Al2O3,水溶液中Cr(+3)具有还原性。下列关于Cr2O3的说法错误的是
| A.与稀硫酸反应: Cr2O3+ 3H2SO4 = Cr2(SO4)3+ 3H2O |
B.与NaOH溶液反应: Cr2O3+ 4OH- = 2 +2H2O +2H2O |
C.碱性条件下被H2O2氧化为Cr(+6): Cr2O3+ 3H2O2+ 4OH- =2 + 5H2O + 5H2O |
| D.由于金属性铝强于铬,且铬的熔点较高,故可用铝热法还原Cr2O3制取金属铬 |
您最近一年使用:0次
2022-05-31更新
|
1460次组卷
|
5卷引用:陕西省西安市蓝田县乡镇高中联考2023-2024学年高一上学期11月期中化学试题
陕西省西安市蓝田县乡镇高中联考2023-2024学年高一上学期11月期中化学试题内蒙古自治区赤峰市2022届高三下学期4月模拟考试理综合化学试题(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)河北省昌黎第一中学2023届高三上学期第二次调研考试化学试题河南省濮阳市油田第一中学2024届高三上学期第一次考试理科综合化学试题
名校
解题方法
7 . 含有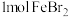 的溶液中,通入
的溶液中,通入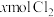 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是
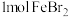 的溶液中,通入
的溶液中,通入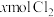 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是A.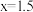 , ,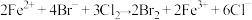 |
B.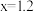 , ,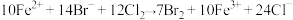 |
C. , ,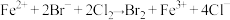 |
D. , ,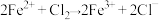 |
您最近一年使用:0次
2021-04-08更新
|
648次组卷
|
4卷引用:陕西省西安市铁一中学2023-2024学年高一上学期第二次月考化学试题
陕西省西安市铁一中学2023-2024学年高一上学期第二次月考化学试题上海市金山区2021届高三二模化学试题宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)
8 . 已知:2Fe2++Br2=2Fe3++2Br-,2Br-+Cl2=Br2+2Cl- , 2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。下列有关说法中,正确的是
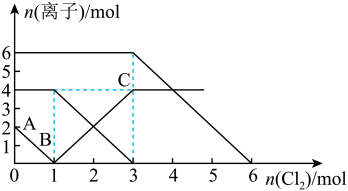

| A.还原性:I-<Fe2+<Br- |
| B.当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| C.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
| D.原混合溶液中FeBr2的物质的量为6mol |
您最近一年使用:0次
2020-11-19更新
|
661次组卷
|
2卷引用:陕西省西安市蓝田县城关中学大学区联考2023-2024学年高一上学期1月期末化学试题
9 . 某离子反应涉及H2O、ClO-、 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
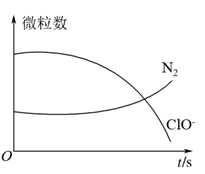
 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
| A.该反应中Cl-为氧化产物 |
| B.消耗1个还原剂微粒,转移6e- |
C. 被ClO-氧化成N2 被ClO-氧化成N2 |
| D.反应后溶液的酸性减弱 |
您最近一年使用:0次
2020-10-02更新
|
1132次组卷
|
8卷引用:陕西省渭南市澄城县2022-2023学年高一下学期期末检测化学试题
解题方法
10 . I.化合物甲和化合物乙的混合粉末是汽车安全气囊中存放的化学物质,经组成分析,确定该混合粉末仅含 Na、Fe、N、O 四种元素。为研究安全气囊工作的化学原理,进行以下实验操作:
(1)工业上冶炼单质2的化学方程式为________ ;
(2)若化合物丙在空气中转化为碳酸氢盐,则反应的化学方程式为________ ;
(3)化合物甲可用下列方法制备:30℃时,将水合肼(N2H4•H2O)、亚硝酸甲酯(CH3ONO)、NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式________ 。
II.晶体硅是一种重要的非金属材料。实验室用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略)。制备纯硅的主要反应为:SiHCl3+H2 = Si(纯)+3HCl
请回答下列问题:
(1)下列说法不正确的是___________ ;
A.装置B中的溶液可以是浓硫酸
B.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的 SiHCl3 气化
C.装置D中观察到的现象是有固体物质生成
D.装置D可以采用普通玻璃管代替石英管
E.为保证制备纯硅实验的成功,关键的操作步骤有检查实验装置的气密性,控制好反应温度以及排尽装置中的空气、干燥气体
F.尾气处理装置中可以将导管直接插入盛有NaOH 溶液的烧杯中
(2)为检验某粗硅中存在的铁元素,可采取的实验操作方法是__________ ;

(1)工业上冶炼单质2的化学方程式为
(2)若化合物丙在空气中转化为碳酸氢盐,则反应的化学方程式为
(3)化合物甲可用下列方法制备:30℃时,将水合肼(N2H4•H2O)、亚硝酸甲酯(CH3ONO)、NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式
II.晶体硅是一种重要的非金属材料。实验室用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略)。制备纯硅的主要反应为:SiHCl3+H2 = Si(纯)+3HCl

请回答下列问题:
(1)下列说法不正确的是
A.装置B中的溶液可以是浓硫酸
B.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的 SiHCl3 气化
C.装置D中观察到的现象是有固体物质生成
D.装置D可以采用普通玻璃管代替石英管
E.为保证制备纯硅实验的成功,关键的操作步骤有检查实验装置的气密性,控制好反应温度以及排尽装置中的空气、干燥气体
F.尾气处理装置中可以将导管直接插入盛有NaOH 溶液的烧杯中
(2)为检验某粗硅中存在的铁元素,可采取的实验操作方法是
您最近一年使用:0次
2020-06-22更新
|
586次组卷
|
2卷引用:陕西省西安市选课分科摸底考2023-2024学年高一下学期4月月考化学试题



