解题方法
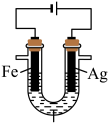
1 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制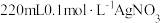 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: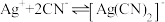 ,
,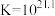 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是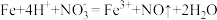 和
和___________ (用离子方程式表示,已知氧化性: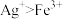 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中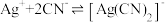 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为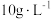 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由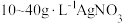 溶液和
溶液和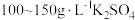 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: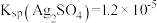 。
。
I.实验准备。
(1)用
 固体配制
固体配制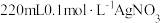 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
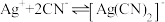 ,
,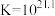 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的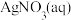 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
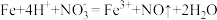 和
和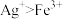 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
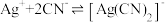 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(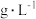 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为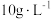 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
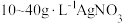 溶液和
溶液和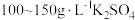 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
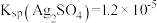 。
。
您最近一年使用:0次
2024-04-16更新
|
258次组卷
|
5卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
2 . 金属铅在工业生产、国防建设和医学诊疗等方面都有着重要的应用,废旧铅蓄电池随意丢弃会造成环境污染,可以按照如图工艺制备高纯 、芒硝
、芒硝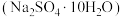 等。
等。
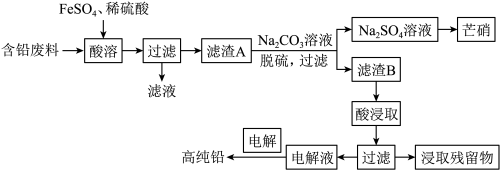
已知:①铅蓄电池的含铅废料主要成分为 、
、 、
、 、
、 。
。
② 是一种无机强酸。
是一种无机强酸。
回答下列问题:
(1)为了加快酸溶的速率,可采取的方法有___________ (写一种即可),酸溶过程中 被
被 还原时发生反应的离子方程式为
还原时发生反应的离子方程式为___________ ,检验酸溶后过滤的滤液中是否有 ,可以选择的试剂为
,可以选择的试剂为___________ (填标号)。
A.酸性高锰酸钾溶液 B.稀硝酸
C. 溶液 D.
溶液 D.
(2)向滤渣 中加入
中加入 溶液实现脱硫,滤渣
溶液实现脱硫,滤渣 为
为___________ (填化学式);滤渣B需要洗涤干净,检验滤渣B洗涤干净的一种方法是取最后一次洗涤液,滴加___________ (填标号),通过现象进行判断。
a.稀盐酸 b.稀硫酸
c.氯化钡溶液 d.氢氧化钠溶液
(3)一般采用 溶液与滤渣
溶液与滤渣 反应,生成
反应,生成 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;以石墨为阳极、高纯铅为阴极,电解 溶液(溶液呈弱酸性,整个过程中
溶液(溶液呈弱酸性,整个过程中 不参与反应)制备铅,阳极的电极反应式为
不参与反应)制备铅,阳极的电极反应式为___________ ,当电路中转移 电子时,阴极理论上增重
电子时,阴极理论上增重___________ g。
 、芒硝
、芒硝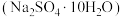 等。
等。
已知:①铅蓄电池的含铅废料主要成分为
 、
、 、
、 、
、 。
。②
 是一种无机强酸。
是一种无机强酸。回答下列问题:
(1)为了加快酸溶的速率,可采取的方法有
 被
被 还原时发生反应的离子方程式为
还原时发生反应的离子方程式为 ,可以选择的试剂为
,可以选择的试剂为A.酸性高锰酸钾溶液 B.稀硝酸
C.
 溶液 D.
溶液 D.
(2)向滤渣
 中加入
中加入 溶液实现脱硫,滤渣
溶液实现脱硫,滤渣 为
为a.稀盐酸 b.稀硫酸
c.氯化钡溶液 d.氢氧化钠溶液
(3)一般采用
 溶液与滤渣
溶液与滤渣 反应,生成
反应,生成 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为 溶液(溶液呈弱酸性,整个过程中
溶液(溶液呈弱酸性,整个过程中 不参与反应)制备铅,阳极的电极反应式为
不参与反应)制备铅,阳极的电极反应式为 电子时,阴极理论上增重
电子时,阴极理论上增重
您最近一年使用:0次
名校
解题方法
3 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为____________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),其中
),其中 元素的化合价为
元素的化合价为______ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素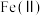 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ ;再加入石灰乳,所得滤渣中主要成分是 、
、______ 。
②通入混合气中 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是____________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是____________ 。 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成
 沉淀的离子方程式:
沉淀的离子方程式:______ 。
②若“镍钴分离”后溶液中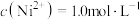 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中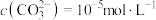 ,则沉镍率=
,则沉镍率=______ 。[已知: ,沉镍率=
,沉镍率=
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。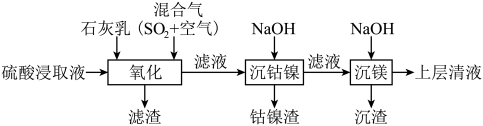
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),其中
),其中 元素的化合价为
元素的化合价为(3)已知:
 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素
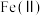 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是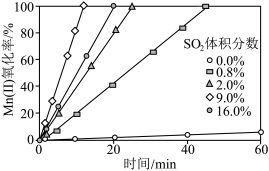
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
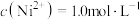 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中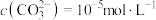 ,则沉镍率=
,则沉镍率= ,沉镍率=
,沉镍率=
您最近一年使用:0次
2024-02-17更新
|
468次组卷
|
4卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学安徽省合肥市第一中学2023-2024学年高三上学期期末考试化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学
名校
解题方法
4 . 过硫酸钾( )可用作破胶剂、聚合促进剂、氧化剂、分析试剂等,
)可用作破胶剂、聚合促进剂、氧化剂、分析试剂等, 时分解。实验小组对过硫酸钾进行相关探究。回答下列问题:
时分解。实验小组对过硫酸钾进行相关探究。回答下列问题:
(1) 可用于检验酸性溶液中的
可用于检验酸性溶液中的 ,在催化剂的作用下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
,在催化剂的作用下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
①完成化学方程式:
______ 。
②当生成 高锰酸钾时,共有
高锰酸钾时,共有___________  电子发生转移。
电子发生转移。
(2)小组同学预测过硫酸钾的分解产物有 、
、 、
、 和
和 ,并用下图所示装置验证分解产物中含有
,并用下图所示装置验证分解产物中含有 和
和 (部分夹持及加热仪器已省略)。
(部分夹持及加热仪器已省略)。
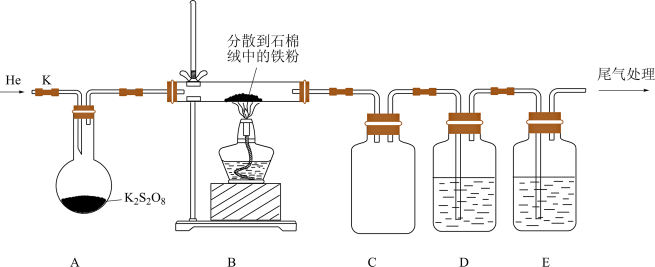
①装置D、E中盛放的试剂依次为___________ 、___________ (填字母)。装置D、E中均有气泡冒出,还观察到的现象分别为___________ 、___________ 。
a.品红溶液 b.NaOH溶液 c. 溶液 d.
溶液 d. 溶液 e.浓
溶液 e.浓
②实验时,通入He排尽装置中的空气后,应先加热装置___________ (填“A”或“B”),其中装置A适合的加热方式为___________ 。
③装置B中石棉绒的作用为___________ 。
 )可用作破胶剂、聚合促进剂、氧化剂、分析试剂等,
)可用作破胶剂、聚合促进剂、氧化剂、分析试剂等, 时分解。实验小组对过硫酸钾进行相关探究。回答下列问题:
时分解。实验小组对过硫酸钾进行相关探究。回答下列问题:(1)
 可用于检验酸性溶液中的
可用于检验酸性溶液中的 ,在催化剂的作用下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
,在催化剂的作用下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。①完成化学方程式:

②当生成
 高锰酸钾时,共有
高锰酸钾时,共有 电子发生转移。
电子发生转移。(2)小组同学预测过硫酸钾的分解产物有
 、
、 、
、 和
和 ,并用下图所示装置验证分解产物中含有
,并用下图所示装置验证分解产物中含有 和
和 (部分夹持及加热仪器已省略)。
(部分夹持及加热仪器已省略)。
①装置D、E中盛放的试剂依次为
a.品红溶液 b.NaOH溶液 c.
 溶液 d.
溶液 d. 溶液 e.浓
溶液 e.浓
②实验时,通入He排尽装置中的空气后,应先加热装置
③装置B中石棉绒的作用为
您最近一年使用:0次
名校
解题方法
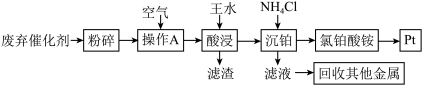
5 . 汽车废弃催化剂中含有Pt,还含有少量的Fe2O3、MgO、Al2O3、SiO2。一种从汽车废弃催化剂中回收铂的流程如下:
有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
(1)长期使用的催化剂,表面会覆盖积碳和有机物,粉碎废弃催化剂后,需进行预处理操作A,操作A的名称为_______ 。
(2)酸浸工序中Pt溶于王水生成NO和氯铂酸(H2PtCl6),该反应的化学方程式为_______ 。有同学提议,将王水换成盐酸和过氧化氢的混合溶液,其优点是_______ 。
(3)铂的浸出率与不同加热方式、不同固液比的关系如下图所示:
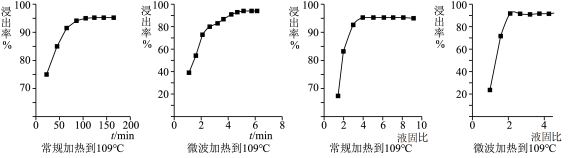
由图可知,Pt 浸出的最佳条件为_______ 。
(4)酸浸温度不宜过高的原因为_______ 。
(5)沉铂时,加入适当过量NH4Cl的目的是_______ 。
(6)通过调节滤液的pH以回收其他金属,依次析出的金属离子为_______ ,当Al3+开始沉淀时,溶液中的Fe3+浓度为_______ mol/L。

有关金属离子开始沉淀和沉淀完全的pH见下表:
| 金属离子 | Al3+ | Mg2+ | Fe3+ |
| 开始沉淀的pH | 3.5 | 9.5 | 2.2 |
| 沉淀完全(c=1.0× 10-5mol/L)的pH | 4.7 | 11.1 | 3.2 |
(1)长期使用的催化剂,表面会覆盖积碳和有机物,粉碎废弃催化剂后,需进行预处理操作A,操作A的名称为
(2)酸浸工序中Pt溶于王水生成NO和氯铂酸(H2PtCl6),该反应的化学方程式为
(3)铂的浸出率与不同加热方式、不同固液比的关系如下图所示:

由图可知,Pt 浸出的最佳条件为
(4)酸浸温度不宜过高的原因为
(5)沉铂时,加入适当过量NH4Cl的目的是
(6)通过调节滤液的pH以回收其他金属,依次析出的金属离子为
您最近一年使用:0次
2023-06-15更新
|
259次组卷
|
2卷引用:2024届陕西省商洛市柞水中学高三下学期理科综合能力测试6-高中化学
解题方法
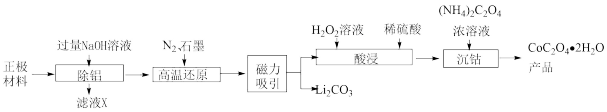
6 . 锂离子电池在我们日常生活中随处可见,随之而来的是废旧电池的合理处理,否则会造成新的环境污染。从废旧锂离子电池正极材料(主要含LiCoO2、Al等)中回收Co并制取CoC2O4·2H2O的工艺流程如图所示:
已知:①LiCoO2与NaOH溶液不反应;
②金属Co易被磁铁吸引,与稀硫酸反应生成大量氢气。
回答下列问题:
(1)“除铝”前需将废旧锂离子电池经过放电、破碎处理,其中破碎的目的是______ ,滤液X的主要溶质是______ (填化学式)。
(2)“高温还原”时,有CO生成,发生反应的化学方程式为______ ;“高温还原”时,通入N2的目的是______ 。
(3)从安全性角度考虑,“酸浸”时先加入过氧化氢溶液,再加入稀硫酸的原因是______ ,“酸浸”发生的总离子反应方程式为_______ 。
(4)“沉钴”时,检验钴离子已沉淀完全的方法是______ ,已知钴离子恰好完全沉淀(离子浓度等于10-5mol•L-1)时,c(C2O )=2.0×10-5mol•L-1,则该温度下Ksp(CoC2O4)=
)=2.0×10-5mol•L-1,则该温度下Ksp(CoC2O4)=______ 。

已知:①LiCoO2与NaOH溶液不反应;
②金属Co易被磁铁吸引,与稀硫酸反应生成大量氢气。
回答下列问题:
(1)“除铝”前需将废旧锂离子电池经过放电、破碎处理,其中破碎的目的是
(2)“高温还原”时,有CO生成,发生反应的化学方程式为
(3)从安全性角度考虑,“酸浸”时先加入过氧化氢溶液,再加入稀硫酸的原因是
(4)“沉钴”时,检验钴离子已沉淀完全的方法是
 )=2.0×10-5mol•L-1,则该温度下Ksp(CoC2O4)=
)=2.0×10-5mol•L-1,则该温度下Ksp(CoC2O4)=
您最近一年使用:0次
2023-02-17更新
|
205次组卷
|
2卷引用:2024届陕西省商洛市高三下学期尖子生学情诊断考试(第二次)理综试卷-高中化学
名校
解题方法
7 . 一种用富含纤维素的木屑水解液浸取锰阳极泥(含 、
、 、
、 、
、 等)制备
等)制备 的工艺流程如下。
的工艺流程如下。
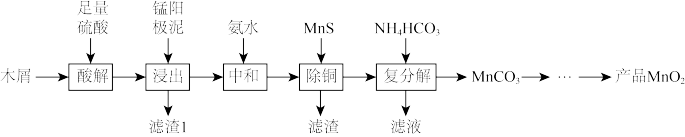
已知:部分锰的氧化物的部分性质如表。
(1)若“酸解”时使用了浓度为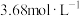 的稀硫酸,则配制
的稀硫酸,则配制
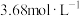 稀硫酸需量取98%的浓
稀硫酸需量取98%的浓 (密度为
(密度为 )的体积为
)的体积为________ mL。
(2)木屑“酸解”的最终产物X的化学式为________ ;“浸出”时, 被X还原为
被X还原为 时生成
时生成 ,该反应中
,该反应中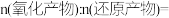
________ ,利用“浸出”得到“滤渣1”利用了“滤渣1”不溶于的特性。
(3)“复分解”时发生反应的离子方程式为________________________ ;向“滤液”中加入足量熟石灰并加热,产生的气体电子式为________ ,该气体用水吸收后,再加入________ (填流程名称)循环利用。
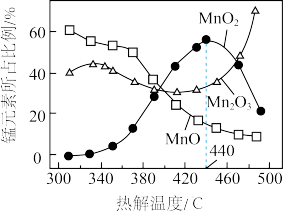
(4) 在空气中热解时,生成各氧化物的锰元素所占百分比与热解温度关系如图所示。欲使
在空气中热解时,生成各氧化物的锰元素所占百分比与热解温度关系如图所示。欲使 尽可能多地转化为
尽可能多地转化为 ,需采取的操作有热解、酸溶、过滤、洗涤、干燥,由图可知,“热解”宜在
,需采取的操作有热解、酸溶、过滤、洗涤、干燥,由图可知,“热解”宜在________ ℃下进行,其中用蒸馏水洗涤固体的具体操作为______ ;用硫酸酸溶 时发生反应的化学方程式为
时发生反应的化学方程式为________________________ 。
 、
、 、
、 、
、 等)制备
等)制备 的工艺流程如下。
的工艺流程如下。
已知:部分锰的氧化物的部分性质如表。
锰的氧化物 | 部分性质 |
| 难溶于水、弱酸、弱碱、硝酸、冷硫酸 |
| 不溶于水,溶于无机酸 |
| 不溶于水、醋酸和氯化铵溶液,溶于其他无机酸;在酸溶液中发生自身氧化还原反应,产物为 和 和 |
(1)若“酸解”时使用了浓度为
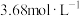 的稀硫酸,则配制
的稀硫酸,则配制
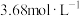 稀硫酸需量取98%的浓
稀硫酸需量取98%的浓 (密度为
(密度为 )的体积为
)的体积为(2)木屑“酸解”的最终产物X的化学式为
 被X还原为
被X还原为 时生成
时生成 ,该反应中
,该反应中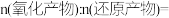
(3)“复分解”时发生反应的离子方程式为
(4)
 在空气中热解时,生成各氧化物的锰元素所占百分比与热解温度关系如图所示。欲使
在空气中热解时,生成各氧化物的锰元素所占百分比与热解温度关系如图所示。欲使 尽可能多地转化为
尽可能多地转化为 ,需采取的操作有热解、酸溶、过滤、洗涤、干燥,由图可知,“热解”宜在
,需采取的操作有热解、酸溶、过滤、洗涤、干燥,由图可知,“热解”宜在 时发生反应的化学方程式为
时发生反应的化学方程式为
您最近一年使用:0次
2022-12-01更新
|
174次组卷
|
3卷引用:陕西省商洛市2022-2023学年高三上学期12月联考化学试题
解题方法
8 . 亚氯酸钠(NaClO2)是二氧化氯(ClO2)泡腾片的主要成分。实验室以氯酸钠(NaClO3)为原料先制得ClO2,再制备NaClO2粗产品,其流程如图:

已知:①ClO2可被NaOH溶液吸收,反应为2ClO2+2NaOH=NaClO3+NaClO2+H2O。
②无水NaClO2性质稳定,有水存在时受热易分解。
(1)反应Ⅰ中若物质X为SO2,则该制备ClO2反应的离子方程式为___ 。
(2)实验在如图-1所示的装置中进行。

①若X为硫磺与浓硫酸,也可反应生成ClO2。该反应较剧烈。若该反应在装置A的三颈烧瓶中进行,则三种试剂(a.浓硫酸;b.硫黄;c.NaClO3溶液)添加入三颈烧瓶的顺序依次为___ (填字母)。
②反应Ⅱ中双氧水的作用是___ 。保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的操作有:装置A中分批加入硫黄、___ (写出一种即可)。
(3)将装置B中溶液蒸发可析出NaClO2,蒸发过程中宜控制的条件为___ (填“减压”、“常压”或“加压”)。
(4)反应Ⅰ所得废液中主要溶质为Na2SO4和NaHSO4,直接排放会污染环境且浪费资源。为从中获得芒硝(Na2SO4·10H2O)和石膏(水合硫酸钙),请补充完整实验方案:___ ,将滤液进一步处理后排放(实验中须使用的试剂和设备有:CaO固体、酚酞、冰水和冰水浴)。已知:CaSO4不溶于Na2SO4水溶液;Na2SO4的溶解度曲线如图−2所示。


已知:①ClO2可被NaOH溶液吸收,反应为2ClO2+2NaOH=NaClO3+NaClO2+H2O。
②无水NaClO2性质稳定,有水存在时受热易分解。
(1)反应Ⅰ中若物质X为SO2,则该制备ClO2反应的离子方程式为
(2)实验在如图-1所示的装置中进行。

①若X为硫磺与浓硫酸,也可反应生成ClO2。该反应较剧烈。若该反应在装置A的三颈烧瓶中进行,则三种试剂(a.浓硫酸;b.硫黄;c.NaClO3溶液)添加入三颈烧瓶的顺序依次为
②反应Ⅱ中双氧水的作用是
(3)将装置B中溶液蒸发可析出NaClO2,蒸发过程中宜控制的条件为
(4)反应Ⅰ所得废液中主要溶质为Na2SO4和NaHSO4,直接排放会污染环境且浪费资源。为从中获得芒硝(Na2SO4·10H2O)和石膏(水合硫酸钙),请补充完整实验方案:

您最近一年使用:0次
2020-04-06更新
|
401次组卷
|
3卷引用:陕西省商洛中学2020届高三第三次模拟考试化学试题