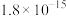名校
解题方法
1 . 铈的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳酸铈(主要含CeFCO3)为原料制备CeO2的工艺流程如下:

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
③Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_______ 。
(2)“氧化焙烧”后的固体产物中含有CeO2和CeF4,CeO2和CeF4的物质的量之比为3:1,“酸浸”时发生反应的离子方程式为_______ 。传统工艺中用盐酸替代硫酸,其缺点为_______ 。
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP CeTBP4++F-,氟洗液中添加Al3+的作用是
CeTBP4++F-,氟洗液中添加Al3+的作用是_______ 。
(4)“反萃取”步骤中发生反应的离子方程式为_______ 。
(5)已知CeO2(1-x)中的Ce为+3、+4价且x>0,现取CeO2(1-x)固体0.875g,加入足量硫酸和3.058gFeSO4·7H2O(M=278g·mol-1)充分溶解,使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。(已知氧化性:Ce4+>KMnO4)
①固体中+4价Ce的质量分数为_______ 。
②若加入的FeSO4·7H2O部分变质,会导致测定的x值_______ (填“偏高”“偏低”或“不变”)。

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。③Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)“氧化焙烧”后的固体产物中含有CeO2和CeF4,CeO2和CeF4的物质的量之比为3:1,“酸浸”时发生反应的离子方程式为
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP
 CeTBP4++F-,氟洗液中添加Al3+的作用是
CeTBP4++F-,氟洗液中添加Al3+的作用是(4)“反萃取”步骤中发生反应的离子方程式为
(5)已知CeO2(1-x)中的Ce为+3、+4价且x>0,现取CeO2(1-x)固体0.875g,加入足量硫酸和3.058gFeSO4·7H2O(M=278g·mol-1)充分溶解,使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。(已知氧化性:Ce4+>KMnO4)
①固体中+4价Ce的质量分数为
②若加入的FeSO4·7H2O部分变质,会导致测定的x值
您最近半年使用:0次
解题方法
2 . 被誉为“工业维他命”的铂族金属钌(Ru)广泛用于航天航空、石油化学、信息传感工业、制药等高科技领域。以下工艺实现了电子废弃物中铂族金属钌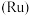 的回收利用。已知电子废弃物主要成分为
的回收利用。已知电子废弃物主要成分为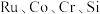 等物质,请回答以下问题:
等物质,请回答以下问题: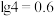 ②常见物质的
②常见物质的 如下表所示:
如下表所示:
(1)为加快“酸浸”时的浸取速率,下列措施中无法达到目的是______ (填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加盐酸浓度 e.适当升高温度
(2)滤渣2为______ 。
(3)“氧化溶浸”环节生成配离子 反应的离子方程式为
反应的离子方程式为______ 。
(4)“还原1”环节所需氧化剂和还原剂的物质的量之比为1:1,则 的氧化产物为
的氧化产物为______ 。
(5)滤液1中含 和
和 的浓度分别为
的浓度分别为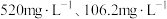 ,“调
,“调 ”时调
”时调 的范围为
的范围为______ 。(已知:当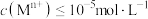 时,可认为
时,可认为 已经沉淀完全)
已经沉淀完全)
(6)沉钴。向除杂后的 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是______ 。
(7)制备 。将所得的
。将所得的 草酸钴晶体
草酸钴晶体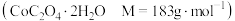 高温灼烧,其热重分析曲线如图:
高温灼烧,其热重分析曲线如图: 点对应的物质的化学式:
点对应的物质的化学式:______ ,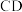 段发生反应的化学方程式为:
段发生反应的化学方程式为:______ 。
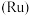 的回收利用。已知电子废弃物主要成分为
的回收利用。已知电子废弃物主要成分为 等物质,请回答以下问题:
等物质,请回答以下问题: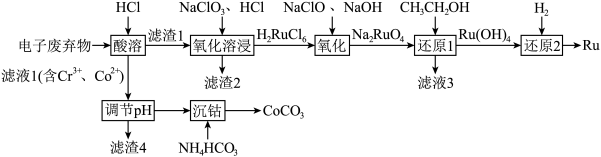
 ②常见物质的
②常见物质的 如下表所示:
如下表所示:化合物 |
|
|
|
|
|
(1)为加快“酸浸”时的浸取速率,下列措施中无法达到目的是
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加盐酸浓度 e.适当升高温度
(2)滤渣2为
(3)“氧化溶浸”环节生成配离子
 反应的离子方程式为
反应的离子方程式为(4)“还原1”环节所需氧化剂和还原剂的物质的量之比为1:1,则
 的氧化产物为
的氧化产物为(5)滤液1中含
 和
和 的浓度分别为
的浓度分别为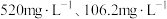 ,“调
,“调 ”时调
”时调 的范围为
的范围为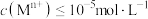 时,可认为
时,可认为 已经沉淀完全)
已经沉淀完全)(6)沉钴。向除杂后的
 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是(7)制备
 。将所得的
。将所得的 草酸钴晶体
草酸钴晶体 高温灼烧,其热重分析曲线如图:
高温灼烧,其热重分析曲线如图: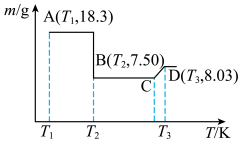
 点对应的物质的化学式:
点对应的物质的化学式: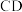 段发生反应的化学方程式为:
段发生反应的化学方程式为:
您最近半年使用:0次
名校
解题方法
3 . 钠的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:
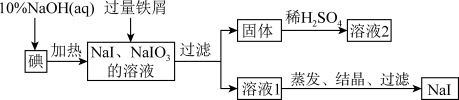
回答下列问题:
(1) 溶液和碘反应时需要严格控制温度,温度过低,获得副产物的化学式为
溶液和碘反应时需要严格控制温度,温度过低,获得副产物的化学式为__________ 。
(2)加入铁屑的目的是__________ ;过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的离子方程式为__________ 。
(3)若参与流程的碘单质为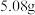 ,最终得到
,最终得到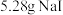 ,则反应的产率为
,则反应的产率为__________ 。
(4)溶液2经一系列操作得到硫酸亚铁晶体 ,称取该晶体样品放入下图所示装置高温加热,使其完全分解,对所得产物进行探究。
,称取该晶体样品放入下图所示装置高温加热,使其完全分解,对所得产物进行探究。
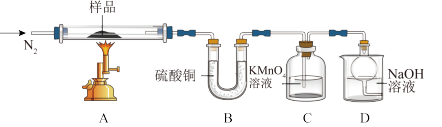
①硫酸亚铁晶体完全分解后,装置A中固体变为红棕色,装置B中硫酸铜粉末变蓝,装置C中高锰酸钾溶液褪色。根据化合价分析,产物中有还原性气体__________ (填化学式),装置D中球形干燥管的作用是__________ 。
②写出 分解的化学方程式
分解的化学方程式__________ 。
(5)用流程图的形式表示用溶液2制备 的过程
的过程__________ 。(用箭头表示转化关系,箭头上注明试剂、反应条件及操作,如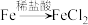 )
)

回答下列问题:
(1)
 溶液和碘反应时需要严格控制温度,温度过低,获得副产物的化学式为
溶液和碘反应时需要严格控制温度,温度过低,获得副产物的化学式为(2)加入铁屑的目的是
(3)若参与流程的碘单质为
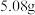 ,最终得到
,最终得到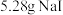 ,则反应的产率为
,则反应的产率为(4)溶液2经一系列操作得到硫酸亚铁晶体
 ,称取该晶体样品放入下图所示装置高温加热,使其完全分解,对所得产物进行探究。
,称取该晶体样品放入下图所示装置高温加热,使其完全分解,对所得产物进行探究。
①硫酸亚铁晶体完全分解后,装置A中固体变为红棕色,装置B中硫酸铜粉末变蓝,装置C中高锰酸钾溶液褪色。根据化合价分析,产物中有还原性气体
②写出
 分解的化学方程式
分解的化学方程式(5)用流程图的形式表示用溶液2制备
 的过程
的过程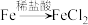 )
)
您最近半年使用:0次
2024-01-13更新
|
64次组卷
|
2卷引用:陕西省咸阳市实验中学2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
4 . 三水合硝酸铜[ ,
,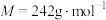 ]是一种重要的无机试剂,常用作搪瓷着色剂,也用于镀铜、制氧化铜及农药等。回答下列问题:
]是一种重要的无机试剂,常用作搪瓷着色剂,也用于镀铜、制氧化铜及农药等。回答下列问题:
I.三水合硝酸铜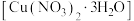 的制备。
的制备。
实验室常用废铜屑与稀硝酸反应制备硝酸铜溶液,过滤出剩余铜屑,再经蒸发浓缩、冷却结晶、过滤、乙醇洗涤后得到三水合硝酸铜晶体。
(1)制备硝酸铜时发生反应的离子方程式为___________ 。
(2)若废铜屑中含有杂质铁,则检验所得硝酸铜溶液中含有铁元素的方法为___________ 。
II. 溶液的配制。
溶液的配制。
(3)实验室里需要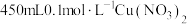 溶液。用三水合硝酸铜
溶液。用三水合硝酸铜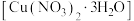 配制该溶液时,下列仪器不需要的是
配制该溶液时,下列仪器不需要的是___________ (填仪器名称)。___________ g。
(5)配制过程中,下列操作将导致溶液浓度偏小的是___________(填序号)。
III.三水合硝酸铜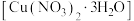 热分解实验。
热分解实验。
(6)将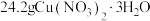 样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在
样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在 过程中有红棕色气体产生,反应的化学方程式为
过程中有红棕色气体产生,反应的化学方程式为___________ 。继续升温至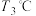 时生成的固体产物为
时生成的固体产物为___________ (填化学式)。
 ,
,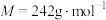 ]是一种重要的无机试剂,常用作搪瓷着色剂,也用于镀铜、制氧化铜及农药等。回答下列问题:
]是一种重要的无机试剂,常用作搪瓷着色剂,也用于镀铜、制氧化铜及农药等。回答下列问题:I.三水合硝酸铜
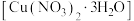 的制备。
的制备。实验室常用废铜屑与稀硝酸反应制备硝酸铜溶液,过滤出剩余铜屑,再经蒸发浓缩、冷却结晶、过滤、乙醇洗涤后得到三水合硝酸铜晶体。
(1)制备硝酸铜时发生反应的离子方程式为
(2)若废铜屑中含有杂质铁,则检验所得硝酸铜溶液中含有铁元素的方法为
II.
 溶液的配制。
溶液的配制。(3)实验室里需要
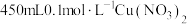 溶液。用三水合硝酸铜
溶液。用三水合硝酸铜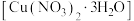 配制该溶液时,下列仪器不需要的是
配制该溶液时,下列仪器不需要的是
(5)配制过程中,下列操作将导致溶液浓度偏小的是___________(填序号)。
| A.加水定容时俯视刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
III.三水合硝酸铜
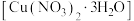 热分解实验。
热分解实验。(6)将
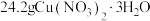 样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在
样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在 过程中有红棕色气体产生,反应的化学方程式为
过程中有红棕色气体产生,反应的化学方程式为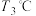 时生成的固体产物为
时生成的固体产物为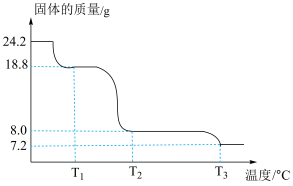
您最近半年使用:0次
2023-10-09更新
|
553次组卷
|
4卷引用:2024届陕西省西安市第一中学高三下学期第十次模拟考试理综试题-高中化学
名校
解题方法
5 . 从烟气脱硝催化剂(含 、
、 、
、 、
、 等)回收
等)回收 的工艺流程如下(已知
的工艺流程如下(已知 、
、 、
、 不溶于稀硫酸)。
不溶于稀硫酸)。
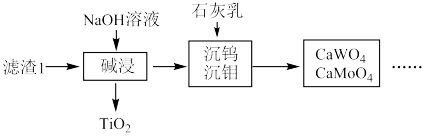
(1)粉碎的目的是_______ ,滤渣1的成分为_______ 。
(2)若酸浸还原产物为 ,其中V的化合价是
,其中V的化合价是_______ 。用 代替无水
代替无水 做还原剂,写出“酸浸还原”的离子反应方程式
做还原剂,写出“酸浸还原”的离子反应方程式_______ 。
(3)写出“富集氧化”过程的化学方程式_______ ,若用 代替
代替 ,要使3mol
,要使3mol  变为
变为 ,至少需要
,至少需要
_______ mol。
(4)可用 滴定法测定
滴定法测定 的浸出率,对含4.95g
的浸出率,对含4.95g  的废脱硝催化剂进行浸出,浸出后的
的废脱硝催化剂进行浸出,浸出后的 溶液用0.1000mol/L的
溶液用0.1000mol/L的 溶液滴定,消耗
溶液滴定,消耗 溶液100mL,则
溶液100mL,则 的浸出率为
的浸出率为_______ %。(保留1位小数)
(5) 焙烧过程发生反应(ⅰ)
焙烧过程发生反应(ⅰ) ,(ⅱ)
,(ⅱ) ,现对234g
,现对234g 样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。
样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。________ 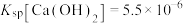 ,
,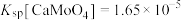 ,且
,且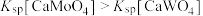 。
。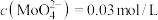 的浸出液中加入石灰乳,需溶液pH为
的浸出液中加入石灰乳,需溶液pH为_______ 时开始产生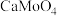 沉淀。
沉淀。
 、
、 、
、 、
、 等)回收
等)回收 的工艺流程如下(已知
的工艺流程如下(已知 、
、 、
、 不溶于稀硫酸)。
不溶于稀硫酸)。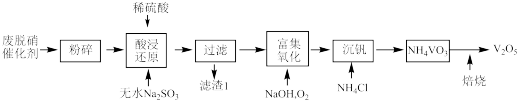
(1)粉碎的目的是
(2)若酸浸还原产物为
 ,其中V的化合价是
,其中V的化合价是 代替无水
代替无水 做还原剂,写出“酸浸还原”的离子反应方程式
做还原剂,写出“酸浸还原”的离子反应方程式(3)写出“富集氧化”过程的化学方程式
 代替
代替 ,要使3mol
,要使3mol  变为
变为 ,至少需要
,至少需要
(4)可用
 滴定法测定
滴定法测定 的浸出率,对含4.95g
的浸出率,对含4.95g  的废脱硝催化剂进行浸出,浸出后的
的废脱硝催化剂进行浸出,浸出后的 溶液用0.1000mol/L的
溶液用0.1000mol/L的 溶液滴定,消耗
溶液滴定,消耗 溶液100mL,则
溶液100mL,则 的浸出率为
的浸出率为(5)
 焙烧过程发生反应(ⅰ)
焙烧过程发生反应(ⅰ) ,(ⅱ)
,(ⅱ) ,现对234g
,现对234g 样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。
样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。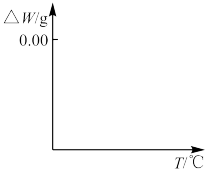
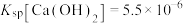 ,
,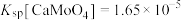 ,且
,且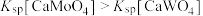 。
。
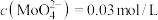 的浸出液中加入石灰乳,需溶液pH为
的浸出液中加入石灰乳,需溶液pH为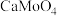 沉淀。
沉淀。
您最近半年使用:0次
2023-02-24更新
|
809次组卷
|
4卷引用:陕西省安康市高新中学2023-2024学年高三下学期2月月考理综试题-高中化学
6 . 钠及其化合物在自然界广泛存在,并有重要用途。
(1)写出过氧化钠中阴离子的电子式:_______ 。
(2)把一定量过氧化钠和未知量碳酸氢钠混合物放置在密闭体系中,充分加热后排出气体,固体残留物中一定含有的物质是_______ (填化学式)。
(3)熔融态的过氧化钠是非常好的氧化剂,可用于工业上氧化FeSO4制高铁酸钠(Na2FeO4)(称为干法制备),干法制备中每1mol FeSO4参加反应转移4mol电子,产物中还有氧气生成。写出干法制取高铁酸钠的化学方程式:_______ 。
(4)将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。实验小组对该白色物质进行如下探究:
【提出假设】假设1:白色物质是Na2O;
假设2:白色物质是Na2CO3;
假设3:白色物质是Na2O和Na2CO3的混合物。
该小组对燃烧后的白色产物进行如下探究:
【思考与交流】
①通过方案1和方案2的实验,上述三个假设中,_______ 成立。钠在二氧化碳中燃烧的化学方程式为_______ 。
②有同学认为白色物质可能是氢氧化钠,你是否同意他的观点,简述理由:_______ 。
(1)写出过氧化钠中阴离子的电子式:
(2)把一定量过氧化钠和未知量碳酸氢钠混合物放置在密闭体系中,充分加热后排出气体,固体残留物中一定含有的物质是
(3)熔融态的过氧化钠是非常好的氧化剂,可用于工业上氧化FeSO4制高铁酸钠(Na2FeO4)(称为干法制备),干法制备中每1mol FeSO4参加反应转移4mol电子,产物中还有氧气生成。写出干法制取高铁酸钠的化学方程式:
(4)将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。实验小组对该白色物质进行如下探究:
【提出假设】假设1:白色物质是Na2O;
假设2:白色物质是Na2CO3;
假设3:白色物质是Na2O和Na2CO3的混合物。
该小组对燃烧后的白色产物进行如下探究:
| 实验操作 | 实验现象 | 结论 | |
| 方案一 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞溶液 | 溶液变成红色 | 白色物质为Na2O |
| 方案二 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CuCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞溶液 | 无明显现象 |
【思考与交流】
①通过方案1和方案2的实验,上述三个假设中,
②有同学认为白色物质可能是氢氧化钠,你是否同意他的观点,简述理由:
您最近半年使用:0次
名校
解题方法
7 . 钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如图:

已知:①还原性:Cl->Co2+;
②Fe3+和C2O 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的____ 。
(2)滤渣的主要成分为____ (填化学式)。
(3)从含铝废液得到Al(OH)3的离子方程式为____ 。
(4)滤液A中的溶质除HCl、LiCl外还有____ (填化学式)。写出LiCoO2和盐酸反应的化学方程式____ 。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见表,请补充完整表中问题。已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为____ mol·L-1。
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是____ 。

已知:①还原性:Cl->Co2+;
②Fe3+和C2O
 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:(1)废旧电池初步处理为粉末状的目的
(2)滤渣的主要成分为
(3)从含铝废液得到Al(OH)3的离子方程式为
(4)滤液A中的溶质除HCl、LiCl外还有
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见表,请补充完整表中问题。已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
| 序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
| I | 120~220 | CoC2O4·2H2O=CoC2O4+2H2O | 19.67% |
| II | 300~350 | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是
您最近半年使用:0次
2022-05-30更新
|
255次组卷
|
2卷引用:陕西省西安中学2022届高三下学期五月全仿真模拟考试(一)理综化学试题
8 . 我国规定,食盐中加入KIO3.某厂生产碘酸钾(KIO3)的工艺流程如下:
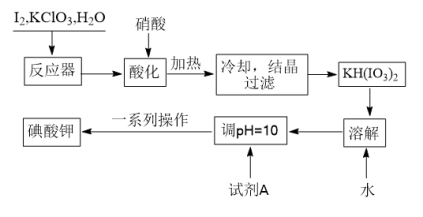
请回答下列问题:
(1)K的质子数为______ ;试剂A是______ ;流程图中“一系列操作”包括蒸发浓缩、降温结晶、过滤、洗涤、干燥。其中,“洗涤剂”是75%的酒精,而不用蒸馏水,其主要原因是______ 。
(2)工业上,还可用电解法制取KIO3。.以石墨和不锈钢为电极材料,电解KI溶液。化学方程式为 。在该反应中,氧化产物是
。在该反应中,氧化产物是___________ 。
(3)常用KI淀粉试纸检验碘盐,其操作是:取少量样品溶于蒸馏水,加几滴食醋,用KI淀粉试纸蘸取该溶液,若变蓝色,则该盐为加碘盐。写出离子方程式___________ 。
(4)测定产品纯度:取wg产品溶于蒸馏水,配制成250mL溶液。取20mL所配制溶液于锥形瓶中,加入过量的KI溶液,滴适量稀硫酸,再滴加几滴指示剂B,用c Na2S2O3溶液滴定至终点,消耗标准溶液为VmL。已知:
Na2S2O3溶液滴定至终点,消耗标准溶液为VmL。已知: 。
。
①根据上述数据,测得产品纯度为___________ (用含w、c、V表达式表示)。
②为了充分反应,滴定之前需要“振荡”锥形瓶中溶液,如果振荡时间过长,测得结果会___________ (填“偏高”、“偏低”或“无影响”)。

请回答下列问题:
(1)K的质子数为
(2)工业上,还可用电解法制取KIO3。.以石墨和不锈钢为电极材料,电解KI溶液。化学方程式为
 。在该反应中,氧化产物是
。在该反应中,氧化产物是(3)常用KI淀粉试纸检验碘盐,其操作是:取少量样品溶于蒸馏水,加几滴食醋,用KI淀粉试纸蘸取该溶液,若变蓝色,则该盐为加碘盐。写出离子方程式
(4)测定产品纯度:取wg产品溶于蒸馏水,配制成250mL溶液。取20mL所配制溶液于锥形瓶中,加入过量的KI溶液,滴适量稀硫酸,再滴加几滴指示剂B,用c
 Na2S2O3溶液滴定至终点,消耗标准溶液为VmL。已知:
Na2S2O3溶液滴定至终点,消耗标准溶液为VmL。已知: 。
。①根据上述数据,测得产品纯度为
②为了充分反应,滴定之前需要“振荡”锥形瓶中溶液,如果振荡时间过长,测得结果会
您最近半年使用:0次
名校
解题方法
9 . 硼(B)及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B元素的化合价为_______ 。
②工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为_______ 。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为_______ 。
(2)工业上以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:

已知:
①“浸出”时,将铁硼矿石粉碎的目的为_______ 。
②“净化除杂”时需先加H2O2溶液,其目的为____ ,然后再调节溶液的pH≈5.0的目的是____ 。
③制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L−1Na2S2O3溶液滴定(I2+2 =2I−+
=2I−+ )至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用
)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___ (填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为____ 。
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B元素的化合价为
②工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为
(2)工业上以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:

已知:
| 金属离子 | Fe3+ | Al3+ |
| 开始沉淀的pH | 2.7 | 3.1 |
| 沉淀完全的pH | 3.7 | 4.9 |
①“浸出”时,将铁硼矿石粉碎的目的为
②“净化除杂”时需先加H2O2溶液,其目的为
③制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L−1Na2S2O3溶液滴定(I2+2
 =2I−+
=2I−+ )至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用
)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用
您最近半年使用:0次
名校
解题方法
10 . 氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的合成路线如图所示,回答下列问题。
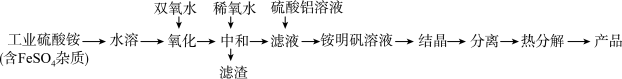
(1)“氧化”步骤发生的离子方程式为:___ ,使用双氧水作氧化剂优点为___ :
(2)“热分解”得到的产物除了氧化铝外,还有NH3、N2、SO2、SO3、H2O生成,则氧化产物和还原产物的物质的量之比为___ 。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值”(失重计算值%=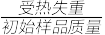 ×100%)如表所示:
×100%)如表所示:
通过上述数据经粗略计算可判断,在温度区间___ 铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是___ 。
(5)合成过程中常使用过量的工业硫酸铵,可利用硫酸铵溶液水解显酸性抑制硫酸铝水解,另外的一个重要作用是___ 。
(6)通常认为金属离子浓度等于1×10-5mol/L即可认为沉淀完全,试计算常温下“中和”步骤中需要调节溶液pH=___ (保留一位小数,已知:Ksp[Fe(OH)3]=8.0×10-38,lg5=0.7)。

(1)“氧化”步骤发生的离子方程式为:
(2)“热分解”得到的产物除了氧化铝外,还有NH3、N2、SO2、SO3、H2O生成,则氧化产物和还原产物的物质的量之比为
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值”(失重计算值%=
 ×100%)如表所示:
×100%)如表所示:| 温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
| 失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
(4)“结晶”步骤中常采用的操作是
(5)合成过程中常使用过量的工业硫酸铵,可利用硫酸铵溶液水解显酸性抑制硫酸铝水解,另外的一个重要作用是
(6)通常认为金属离子浓度等于1×10-5mol/L即可认为沉淀完全,试计算常温下“中和”步骤中需要调节溶液pH=
您最近半年使用:0次
2020-04-04更新
|
353次组卷
|
4卷引用:陕西省榆林市 2020届高考3月线上模拟考试化学试题
陕西省榆林市 2020届高考3月线上模拟考试化学试题安徽省六安市第一中学2020届高三下学期第九次模拟考试理综化学试题(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)