名校
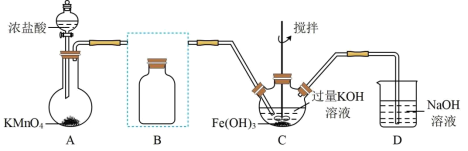
1 .  是重要的无机化工原料。某化学兴趣小组同学用下图所示装置(部分加热及夹持装置已省略)制取
是重要的无机化工原料。某化学兴趣小组同学用下图所示装置(部分加热及夹持装置已省略)制取 并测定其纯度。
并测定其纯度。
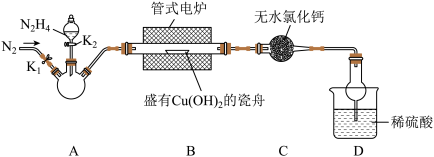
已知:① 为二元弱碱,常温下为无色油状液体,沸点为113.5℃,有较强的还原性。
为二元弱碱,常温下为无色油状液体,沸点为113.5℃,有较强的还原性。
② 在潮湿的空气中易被氧化,在酸性溶液中易发生歧化反应。
在潮湿的空气中易被氧化,在酸性溶液中易发生歧化反应。
③ 为深蓝色,
为深蓝色, 为无色。
为无色。
④ 。
。
回答下列问题:
(1)通入 的作用是
的作用是_______ ,为平稳的产生 气流,装置A应选用的加热方式为
气流,装置A应选用的加热方式为_______ ,B处反应的化学方程式为_______ 。
(2)充分反应后,取B中固体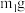 于试管中,加入足量稀硫酸,经过滤、洗涤、干燥后,所得固体质量为
于试管中,加入足量稀硫酸,经过滤、洗涤、干燥后,所得固体质量为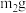 。B中产物溶于稀硫酸的离子方程式为
。B中产物溶于稀硫酸的离子方程式为_______ ,产物中 的百分含量为
的百分含量为_______ 。
(3)取B中少量固体产物于试管中,加入足量稀硫酸;继续滴加过量浓氨水,溶液变为深蓝色;一段时间后,溶液颜色逐渐变浅;再加入过量铜粉,久置溶液变为无色。
①取两份等体积的深蓝色溶液于试管中,分别加入等量的水和稀硫酸,观察到现象_______ ,证明蓝色溶液中存在 。
。
②小组同学猜测最后无色溶液成份为 ,请设计实验验证
,请设计实验验证_______ 。
 是重要的无机化工原料。某化学兴趣小组同学用下图所示装置(部分加热及夹持装置已省略)制取
是重要的无机化工原料。某化学兴趣小组同学用下图所示装置(部分加热及夹持装置已省略)制取 并测定其纯度。
并测定其纯度。
已知:①
 为二元弱碱,常温下为无色油状液体,沸点为113.5℃,有较强的还原性。
为二元弱碱,常温下为无色油状液体,沸点为113.5℃,有较强的还原性。②
 在潮湿的空气中易被氧化,在酸性溶液中易发生歧化反应。
在潮湿的空气中易被氧化,在酸性溶液中易发生歧化反应。③
 为深蓝色,
为深蓝色, 为无色。
为无色。④
 。
。回答下列问题:
(1)通入
 的作用是
的作用是 气流,装置A应选用的加热方式为
气流,装置A应选用的加热方式为(2)充分反应后,取B中固体
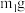 于试管中,加入足量稀硫酸,经过滤、洗涤、干燥后,所得固体质量为
于试管中,加入足量稀硫酸,经过滤、洗涤、干燥后,所得固体质量为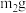 。B中产物溶于稀硫酸的离子方程式为
。B中产物溶于稀硫酸的离子方程式为 的百分含量为
的百分含量为(3)取B中少量固体产物于试管中,加入足量稀硫酸;继续滴加过量浓氨水,溶液变为深蓝色;一段时间后,溶液颜色逐渐变浅;再加入过量铜粉,久置溶液变为无色。
①取两份等体积的深蓝色溶液于试管中,分别加入等量的水和稀硫酸,观察到现象
 。
。②小组同学猜测最后无色溶液成份为
 ,请设计实验验证
,请设计实验验证
您最近半年使用:0次
2022-10-11更新
|
126次组卷
|
3卷引用:山东德州市普通高中2022-2023学年高三上学期10月过程性检测化学试题
2 . 高铁酸钾 (K2FeO4)是一种新型、高效、无毒的多功能水处理剂。查阅资料已知: 为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ.湿法制备高铁酸钾(夹持装置略去)
原理:实验室中常用KClO在强碱性介质中与 反应制备
反应制备
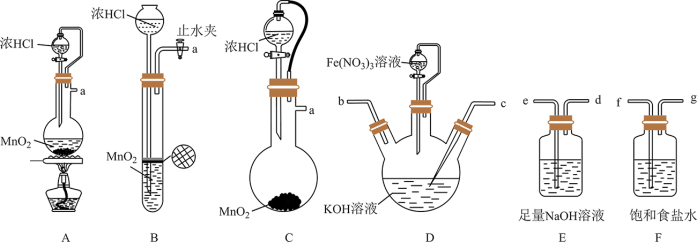
(1)氯气的发生装置可以选择图中的_______ (用图中大写字母表示);化学反应方程式为_______ 。
(2)选择上述装置,制备 ,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。
,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。_________
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。 在硫酸溶液中反应如下:
在硫酸溶液中反应如下:
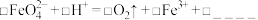
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。__________
②现取D中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。
Ⅱ.干法制备高铁酸钾的主要反应为: 。
。
(4)①该反应中的还原剂是_______ 。
②每生成 转移
转移_______ 个电子(阿伏加德罗常数用 表示)。
表示)。
(5)简要说明 作为复合型水处理剂时所起的作用
作为复合型水处理剂时所起的作用_______ 。
 为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。Ⅰ.湿法制备高铁酸钾(夹持装置略去)
原理:实验室中常用KClO在强碱性介质中与
 反应制备
反应制备

(1)氯气的发生装置可以选择图中的
(2)选择上述装置,制备
 ,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。
,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。
 在硫酸溶液中反应如下:
在硫酸溶液中反应如下: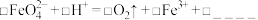
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。
②现取D中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
Ⅱ.干法制备高铁酸钾的主要反应为:
 。
。(4)①该反应中的还原剂是
②每生成
 转移
转移 表示)。
表示)。(5)简要说明
 作为复合型水处理剂时所起的作用
作为复合型水处理剂时所起的作用
您最近半年使用:0次
名校
解题方法
3 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)
(1)写出A中产生氯气的离子方程式:_______
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:_______
(3)在C中发生的2个反应的离子方程式:_______ ;_______
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
(4)由方案Ⅰ中溶液变红可知a中含有_______ 离子,根据方案Ⅱ得出:氧化性Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______
①完成并配平上述离子方程式_______ 。
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)写出A中产生氯气的离子方程式:
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:
(3)在C中发生的2个反应的离子方程式:
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
 (填“>”或“<”)
(填“>”或“<”)(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO
 +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______①完成并配平上述离子方程式
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近半年使用:0次
名校
4 . I.二氧化氯(C1O2)气体是一种常用的高效自来水消毒剂。
(1)KC1O3和浓盐酸在一定温度下反应会生成C1O2和C12,反应方程式为_____ 。
(2)C1O2和Cl2在消毒时自身均被还原为C1-,则常温常压下,等体积的ClO2的消毒能力是Cl2的_____ 倍。
(3)自来水厂用C1O2处理后的水中,要求C1O2的浓度在0.1~0.8mg·L-1之间,用碘量法可以检测水中CIO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:

I.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝;
Ⅱ.加入一定量的Na2S2O3溶液:(已知: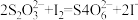 )
)
Ⅲ.加硫酸调节水样pH至1~3。
请回答:
①操作I中反应的离子方程式是_____ 。
②若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mo·L-1的Na2S2O3溶液10mL,则水样中C1O2的浓度是_____ mg·L-1。
Ⅱ.
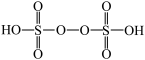
(4)过二硫酸(结构如图)是一种白色晶体,其酸及盐均为强氧化剂。
在Ag+及加热的条件下,S2O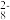 可将溶液中的Mn2+氧化为MnO
可将溶液中的Mn2+氧化为MnO ,该反应的离子方程式为
,该反应的离子方程式为_____ 。
(5)连二亚硫酸钠(N2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为_____ 。
②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1:2时,产物为_____ (填化学式)。
(1)KC1O3和浓盐酸在一定温度下反应会生成C1O2和C12,反应方程式为
(2)C1O2和Cl2在消毒时自身均被还原为C1-,则常温常压下,等体积的ClO2的消毒能力是Cl2的
(3)自来水厂用C1O2处理后的水中,要求C1O2的浓度在0.1~0.8mg·L-1之间,用碘量法可以检测水中CIO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:

I.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝;
Ⅱ.加入一定量的Na2S2O3溶液:(已知:
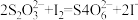 )
)Ⅲ.加硫酸调节水样pH至1~3。
请回答:
①操作I中反应的离子方程式是
②若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mo·L-1的Na2S2O3溶液10mL,则水样中C1O2的浓度是
Ⅱ.
(4)过二硫酸(结构如图)是一种白色晶体,其酸及盐均为强氧化剂。

在Ag+及加热的条件下,S2O
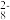 可将溶液中的Mn2+氧化为MnO
可将溶液中的Mn2+氧化为MnO ,该反应的离子方程式为
,该反应的离子方程式为(5)连二亚硫酸钠(N2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为
②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1:2时,产物为
您最近半年使用:0次
名校
5 . 二氯异氰尿酸钠(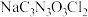 )是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中NaClO法是向NaOH溶液通入
)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中NaClO法是向NaOH溶液通入 产生高浓度NaClO溶液,然后与氰尿酸(
产生高浓度NaClO溶液,然后与氰尿酸( )反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
)反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
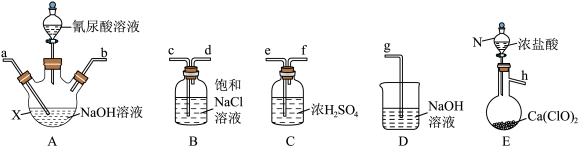
已知:
回答下列问题:
(1)按气流从左至右,导管口连接顺序为___________ 。(填小写字母)
(2)若发现实际操作过程中仪器N中浓盐酸不易流下,可将仪器N换为___________ 。
(3)装置A中制备NaClO溶液完成的现象是___________ ,在加氰尿酸溶液过程仍需不断通入 的理由是
的理由是___________ 。实验过程中若温度过度,pH过小会生成 ,写出
,写出 生成
生成 的化学方程式
的化学方程式______________________ 。
(4)有效氯含量是判断产品质量的标准。实验采用碘量法测定产物有效氯的含量,原理为: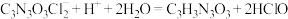 ,
, ,
,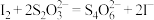 ,准确称取0.5600g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol/L
,准确称取0.5600g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol/L  标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗 溶液15.00mL。
溶液15.00mL。
①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒和量筒外,还需要___________ 。
②滴定至溶液呈微黄色时,加入的指示剂是___________ ,该样品的有效氯为___________ %。(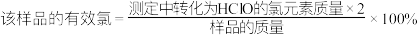 ,保留三位有效数字)
,保留三位有效数字)
③下列操作将导致样品有效氯测定值偏低的是___________ (填标号)。
a.碘量瓶中加入稀硫酸的量过少
b.滴定前滴定管未排气泡滴定后气泡消失
c.读数时,滴定前仰视、滴定后俯视
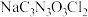 )是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中NaClO法是向NaOH溶液通入
)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中NaClO法是向NaOH溶液通入 产生高浓度NaClO溶液,然后与氰尿酸(
产生高浓度NaClO溶液,然后与氰尿酸( )反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
)反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
已知:

回答下列问题:
(1)按气流从左至右,导管口连接顺序为
(2)若发现实际操作过程中仪器N中浓盐酸不易流下,可将仪器N换为
(3)装置A中制备NaClO溶液完成的现象是
 的理由是
的理由是 ,写出
,写出 生成
生成 的化学方程式
的化学方程式(4)有效氯含量是判断产品质量的标准。实验采用碘量法测定产物有效氯的含量,原理为:
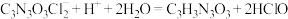 ,
, ,
,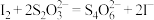 ,准确称取0.5600g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol/L
,准确称取0.5600g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol/L  标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗 溶液15.00mL。
溶液15.00mL。①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒和量筒外,还需要
②滴定至溶液呈微黄色时,加入的指示剂是
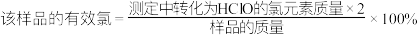 ,保留三位有效数字)
,保留三位有效数字)③下列操作将导致样品有效氯测定值偏低的是
a.碘量瓶中加入稀硫酸的量过少
b.滴定前滴定管未排气泡滴定后气泡消失
c.读数时,滴定前仰视、滴定后俯视
您最近半年使用:0次
2023-11-23更新
|
265次组卷
|
3卷引用:山东省济南市2023-2024学年高三上学期11月期中考试化学试题
名校
6 . 一种制取电池级二氧化锰的工艺流程如下图:
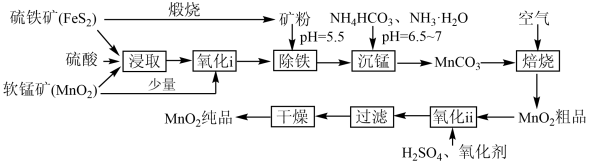
回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式___________ 。
(2)“氧化i”过程软锰矿的作用是___________ 。“氧化ⅱ”过程中,将Mn(Ⅱ)转化为Mn(Ⅳ)的最适宜氧化剂是___________ (填标号)。
a. b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得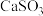 与水形成的浊液
与水形成的浊液 为9,若忽略
为9,若忽略 的第二步水解,则
的第二步水解,则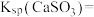
___________ (保留三位有效数字)[已知:室温下亚硫酸(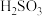 )的电离平衡常数
)的电离平衡常数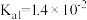 ,
,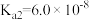 ]
]
(4)“沉锰”过程 转化为
转化为 的离子方程式为
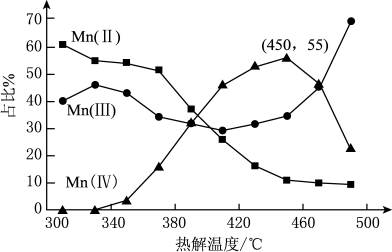
的离子方程式为___________ 。在一定空气流速下,相同时间内“焙烧” ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①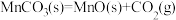
②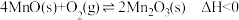
③
为了增大产物中 的占比,可以采用的措施是
的占比,可以采用的措施是___________ (答出两条)。
(5)用氧化还原法测定 样品纯度(杂质不参与下列反应):称取
样品纯度(杂质不参与下列反应):称取 样品
样品 ,试样经过过氧化钠碱熔后,得到
,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 过滤除去
过滤除去 ,用
,用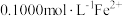 标准溶液滴定
标准溶液滴定 ,用去
,用去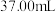 ,则样品中
,则样品中 的质量分数为
的质量分数为___________ (保留3位有效数字)。

回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式
(2)“氧化i”过程软锰矿的作用是
a.
 b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的
 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得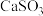 与水形成的浊液
与水形成的浊液 为9,若忽略
为9,若忽略 的第二步水解,则
的第二步水解,则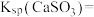
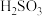 )的电离平衡常数
)的电离平衡常数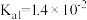 ,
,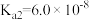 ]
](4)“沉锰”过程
 转化为
转化为 的离子方程式为
的离子方程式为 ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①
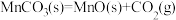
②
③

为了增大产物中
 的占比,可以采用的措施是
的占比,可以采用的措施是(5)用氧化还原法测定
 样品纯度(杂质不参与下列反应):称取
样品纯度(杂质不参与下列反应):称取 样品
样品 ,试样经过过氧化钠碱熔后,得到
,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 过滤除去
过滤除去 ,用
,用 标准溶液滴定
标准溶液滴定 ,用去
,用去 ,则样品中
,则样品中 的质量分数为
的质量分数为
您最近半年使用:0次
名校
7 . 以硫铁矿(主要成分为 ,还有少量
,还有少量 、
、 等杂质)为原料制备绿矾晶体(
等杂质)为原料制备绿矾晶体( ,
, )的工艺流程如下:
)的工艺流程如下:
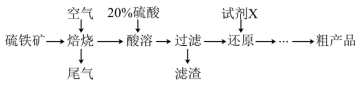
(1)滤渣的成分为___________ 。焙烧步骤中主要反应的化学方程式为___________ 。
(2)流程中省略的步骤含有①蒸发浓缩、冷却结晶②过滤③调溶液pH沉铝④洗涤、干燥,请写出正确顺序___________ (填序号,下同)。你认为获得粗产品后的母液进入___________ 操作中更合理。
(3)取 样品,加水完全溶解,滴加硫酸酸化的
样品,加水完全溶解,滴加硫酸酸化的
 溶液至恰好完全反应(
溶液至恰好完全反应( 被还原为
被还原为 ),消耗
),消耗 溶液
溶液 。则绿矾晶体纯度为
。则绿矾晶体纯度为___________ (可不化简)。
(4)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。F)对硫铁矿进行催化脱硫,同时得到 溶液。其过程如下图所示(其中
溶液。其过程如下图所示(其中 中S的平均化合价为
中S的平均化合价为 价):
价):
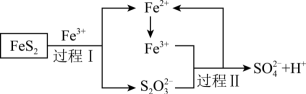
过程Ⅱ中氧化产物与还原产物的物质的量之比为___________ 。
(5) 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(
可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠( ),工业上有多种制备高铁酸钠方法。
),工业上有多种制备高铁酸钠方法。
①干法制备:主要反应为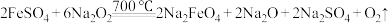 。从氧化还原反应的角度分析,
。从氧化还原反应的角度分析, 的作用为
的作用为___________ 。
②湿法制备:在碱性条件下,用 溶液和
溶液和 溶液反应制备。该反应的离子方程式为
溶液反应制备。该反应的离子方程式为___________ 。
 ,还有少量
,还有少量 、
、 等杂质)为原料制备绿矾晶体(
等杂质)为原料制备绿矾晶体( ,
,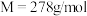 )的工艺流程如下:
)的工艺流程如下:
(1)滤渣的成分为
(2)流程中省略的步骤含有①蒸发浓缩、冷却结晶②过滤③调溶液pH沉铝④洗涤、干燥,请写出正确顺序
(3)取
 样品,加水完全溶解,滴加硫酸酸化的
样品,加水完全溶解,滴加硫酸酸化的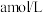
 溶液至恰好完全反应(
溶液至恰好完全反应( 被还原为
被还原为 ),消耗
),消耗 溶液
溶液 。则绿矾晶体纯度为
。则绿矾晶体纯度为(4)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。F)对硫铁矿进行催化脱硫,同时得到
 溶液。其过程如下图所示(其中
溶液。其过程如下图所示(其中 中S的平均化合价为
中S的平均化合价为 价):
价):
过程Ⅱ中氧化产物与还原产物的物质的量之比为
(5)
 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(
可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠( ),工业上有多种制备高铁酸钠方法。
),工业上有多种制备高铁酸钠方法。①干法制备:主要反应为
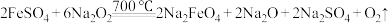 。从氧化还原反应的角度分析,
。从氧化还原反应的角度分析, 的作用为
的作用为②湿法制备:在碱性条件下,用
 溶液和
溶液和 溶液反应制备。该反应的离子方程式为
溶液反应制备。该反应的离子方程式为
您最近半年使用:0次
解题方法
8 .  是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
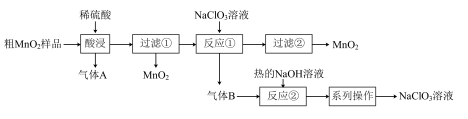
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为___________ 。
(2)反应①的离子方程式为___________ 。
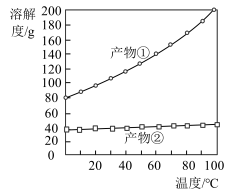
(3)若要得到较浓的 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为___________ (写化学式),“系列操作”为先___________ ,后___________ 。
(4)若粗 样品的质量为
样品的质量为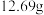 ,经“过滤①”得到
,经“过滤①”得到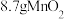 ,并收集到
,并收集到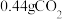 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为___________  。
。
(5)该流程中可循环利用的物质有___________ 。
 是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为
(2)反应①的离子方程式为
(3)若要得到较浓的
 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
(4)若粗
 样品的质量为
样品的质量为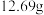 ,经“过滤①”得到
,经“过滤①”得到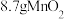 ,并收集到
,并收集到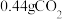 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为 。
。(5)该流程中可循环利用的物质有
您最近半年使用:0次
解题方法
9 . 金属钼(Mo)及其化合物在合金工业中起着重要的作用,生产中常常以辉钼矿(主要成分为 ,含有FeS、CuS、
,含有FeS、CuS、 等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
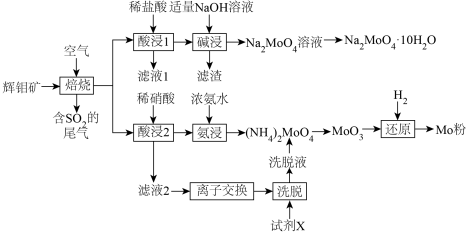
已知:①Mo的常见价态有+4、+6价。
②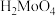 是微溶于水的无机酸,可溶于碱。
是微溶于水的无机酸,可溶于碱。
③氧气不足时,焙烧产物中可能混有 与
与 反应生成的
反应生成的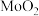 。
。
回答下列问题:
(1)焙烧的产物中Mo元素主要以 、
、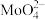 盐的形式存在。生成有
盐的形式存在。生成有 的化学方程式
的化学方程式______________________ 。
(2)与酸浸1相比,酸浸2使用稀硝酸的优点是___________ ,但是缺点是造成 的污染。
的污染。
(3)滤渣的成分主要是___________ 。碱浸时应控制pH不宜过大,原因是______________ 。
(4)已知离子交换环节,阴离子交换树脂R-OH工作原理为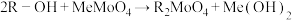 (Me代表金属阳离子),洗脱时使用的试剂X为
(Me代表金属阳离子),洗脱时使用的试剂X为___________ 。
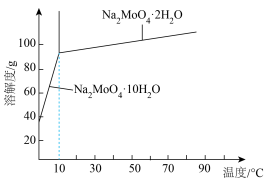
(5)钼酸钠某些晶体的溶解度曲线如图,获得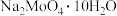 的操作为蒸发浓缩、
的操作为蒸发浓缩、___________ 、过滤、洗涤。
(6)工业上还有电氧化法 制备
制备 的方法,装置如下图所示
的方法,装置如下图所示
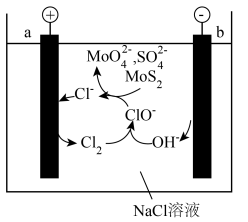
每生成0.1mol 时,外电路转移的电子数为
时,外电路转移的电子数为___________ (阿伏加德罗常数的值用 表示)
表示)
(7)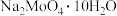 中可能混有
中可能混有 ,以硝酸铅
,以硝酸铅 为标准液测量
为标准液测量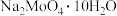 的纯度。根据下表信息,应选用的指示剂为
的纯度。根据下表信息,应选用的指示剂为___________ 。滴定终点的现象为___________ 。
取m g 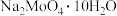 (式量为M)样品配成200mL溶液,取出20.00mL用c mol/L
(式量为M)样品配成200mL溶液,取出20.00mL用c mol/L 标准溶液进行滴定,消耗标准液V mL,
标准溶液进行滴定,消耗标准液V mL,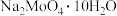 的百分含量为
的百分含量为___________ (写出表达式即可)。
 ,含有FeS、CuS、
,含有FeS、CuS、 等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
已知:①Mo的常见价态有+4、+6价。
②
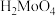 是微溶于水的无机酸,可溶于碱。
是微溶于水的无机酸,可溶于碱。③氧气不足时,焙烧产物中可能混有
 与
与 反应生成的
反应生成的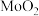 。
。回答下列问题:
(1)焙烧的产物中Mo元素主要以
 、
、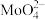 盐的形式存在。生成有
盐的形式存在。生成有 的化学方程式
的化学方程式(2)与酸浸1相比,酸浸2使用稀硝酸的优点是
 的污染。
的污染。(3)滤渣的成分主要是
(4)已知离子交换环节,阴离子交换树脂R-OH工作原理为
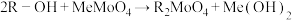 (Me代表金属阳离子),洗脱时使用的试剂X为
(Me代表金属阳离子),洗脱时使用的试剂X为(5)钼酸钠某些晶体的溶解度曲线如图,获得
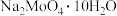 的操作为蒸发浓缩、
的操作为蒸发浓缩、
(6)工业上还有电氧化法
 制备
制备 的方法,装置如下图所示
的方法,装置如下图所示
每生成0.1mol
 时,外电路转移的电子数为
时,外电路转移的电子数为 表示)
表示)(7)
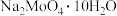 中可能混有
中可能混有 ,以硝酸铅
,以硝酸铅 为标准液测量
为标准液测量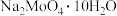 的纯度。根据下表信息,应选用的指示剂为
的纯度。根据下表信息,应选用的指示剂为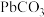 | 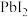 | PbS | 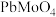 | |
 | 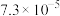 |  | 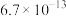 | 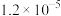 |
| 颜色 | 白色 | 亮黄色 | 黑色 | 白色 |
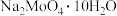 (式量为M)样品配成200mL溶液,取出20.00mL用c mol/L
(式量为M)样品配成200mL溶液,取出20.00mL用c mol/L 标准溶液进行滴定,消耗标准液V mL,
标准溶液进行滴定,消耗标准液V mL,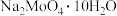 的百分含量为
的百分含量为
您最近半年使用:0次
名校
解题方法
10 . 大力发展新能源汽车产业是我国兑现碳中和承诺的重要战略之一。随着这一产业的发展,如何处理废旧锂电池成为一个亟需解决的问题。某废弃的钴酸锂(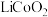 )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:

已知: 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的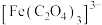 ,
,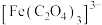 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。
(1)操作①的名称为______ ;由此可推测,氧化铝______ (填“能”或“不能”)溶于氢氧化钠溶液。
(2)溶液②中所含主要溶质为LiCl、 ,请写出
,请写出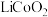 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)______ 。
(3)将溶液中的 转化为
转化为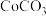 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是__________________ 。
(4)为证明操作④获得的 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入______ ,若无白色沉淀生成,则证明沉淀洗涤干净。
(5)取3.66 g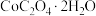 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为______ (填化学式);在956℃条件下反应完全后,剩余固体相对最开始反应前失重59%,此时固体成分的化学式为 ,
,
______ 。
(6)某同学设计如图装置测定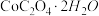 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是______ (填选项)。

A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以______ 离子形态存在,应加入______ 后再进行后续操作。
(8) 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为______ (填选项)。
A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为______ 。
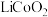 )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
已知:
 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的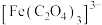 ,
,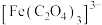 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。(1)操作①的名称为
(2)溶液②中所含主要溶质为LiCl、
 ,请写出
,请写出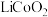 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)(3)将溶液中的
 转化为
转化为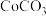 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是(4)为证明操作④获得的
 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入(5)取3.66 g
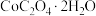 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为 ,
,
(6)某同学设计如图装置测定
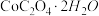 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以
(8)
 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为
您最近半年使用:0次



