解题方法
1 . 某同学利用下图装置制备并收集干燥纯净的 ,并探究
,并探究 与碱的反应。回答下列问题:
与碱的反应。回答下列问题:
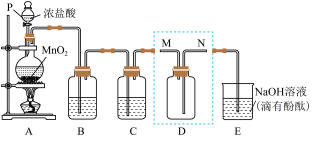
(1)装置A中发生反应的化学方程式为___________ 。
(2)实验室用下列两种方法制氯气:①用含HCl 146g的浓盐酸与足量的 反应;②用
反应;②用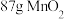 与足量浓盐酸反应。所得的氯气质量①
与足量浓盐酸反应。所得的氯气质量①___________ ②(填“>”“<”“=”)。
(3)装置B的作用是___________ 。
(4)装置D用来收集纯净且干燥的氯气,进气口为___________ (填“M”或“N”)。
(5)36.5%的浓盐酸(密度为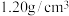 )的物质的量浓度
)的物质的量浓度___________
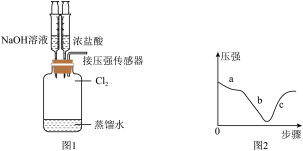
(6)探究 的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
实验步骤如下:
a.向D中加入适量的蒸馏水,振荡。
b.用注射器向装置中加入NaOH溶液。
c.用注射器向装置中加入浓盐酸。
①步骤a,压强减小的原因___________ 。
②步骤b, 与NaOH溶液反应而导致压强减小
与NaOH溶液反应而导致压强减小
③步骤c,装置D中的现象___________ 。
(7)小组同学观察到E中红色褪去,并对褪色原因提出假设:
假设1:___________ ;
假设2:ClO-破坏了酚酞的结构。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许D中褪色后的溶液放入试管中,___________ (填“操作”),若___________ (填“现象”)。则假设1成立。
(8)二氧化氯( )现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。
)现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。 对酸性污水中的
对酸性污水中的 也有明显的去除效果。配平以下方程式
也有明显的去除效果。配平以下方程式________
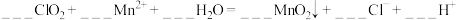
 ,并探究
,并探究 与碱的反应。回答下列问题:
与碱的反应。回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)实验室用下列两种方法制氯气:①用含HCl 146g的浓盐酸与足量的
 反应;②用
反应;②用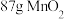 与足量浓盐酸反应。所得的氯气质量①
与足量浓盐酸反应。所得的氯气质量①(3)装置B的作用是
(4)装置D用来收集纯净且干燥的氯气,进气口为
(5)36.5%的浓盐酸(密度为
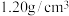 )的物质的量浓度
)的物质的量浓度(6)探究
 的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D.按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
实验步骤如下:
a.向D中加入适量的蒸馏水,振荡。
b.用注射器向装置中加入NaOH溶液。
c.用注射器向装置中加入浓盐酸。
①步骤a,压强减小的原因
②步骤b,
 与NaOH溶液反应而导致压强减小
与NaOH溶液反应而导致压强减小③步骤c,装置D中的现象
(7)小组同学观察到E中红色褪去,并对褪色原因提出假设:
假设1:
假设2:ClO-破坏了酚酞的结构。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许D中褪色后的溶液放入试管中,
(8)二氧化氯(
 )现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。
)现已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。 对酸性污水中的
对酸性污水中的 也有明显的去除效果。配平以下方程式
也有明显的去除效果。配平以下方程式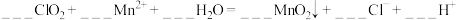
您最近一年使用:0次
名校
解题方法
2 .  常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲
常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲 溶液制备
溶液制备 的流程如图所示,回答下列问题:
的流程如图所示,回答下列问题:

(1)实验室进行过滤操作时所用的玻璃仪器有玻璃棒、___________ ; 的俗名为
的俗名为___________ 。
(2)氯化铁溶液和硫脲溶液反应的离子方程式如下,请补全并配平下列方程式:___________ 。
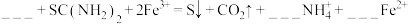
该反应的氧化剂和还原剂的物质的量之比为___________ 。
(3)检验“过滤”后所得的滤液中是否含有 的操作和现象为
的操作和现象为___________ 。
(4)要使 中的
中的 元素全部转化为
元素全部转化为 ,理论上加入的
,理论上加入的 和
和 的物质的量之比为
的物质的量之比为___________ ,实际生产过程中,硫脲的用量比理论的要多一点,原因可能是___________ 。
(5)铁与水蒸气高温反应也能制备 ,若生成
,若生成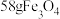 ,则生成的气体的体积为
,则生成的气体的体积为___________ L(换算成标准状况下)。
 常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲
常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲 溶液制备
溶液制备 的流程如图所示,回答下列问题:
的流程如图所示,回答下列问题:
(1)实验室进行过滤操作时所用的玻璃仪器有玻璃棒、
 的俗名为
的俗名为(2)氯化铁溶液和硫脲溶液反应的离子方程式如下,请补全并配平下列方程式:
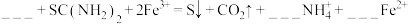
该反应的氧化剂和还原剂的物质的量之比为
(3)检验“过滤”后所得的滤液中是否含有
 的操作和现象为
的操作和现象为(4)要使
 中的
中的 元素全部转化为
元素全部转化为 ,理论上加入的
,理论上加入的 和
和 的物质的量之比为
的物质的量之比为(5)铁与水蒸气高温反应也能制备
 ,若生成
,若生成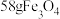 ,则生成的气体的体积为
,则生成的气体的体积为
您最近一年使用:0次
3 . 研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)火药是中国的四大发明之一,永远值得华夏儿女骄傲,黑火药在发生爆炸时,发生如下反应: ,其中作氧化剂的是
,其中作氧化剂的是___________ (填化学式,下同),被还原的是___________ 。
(2)中国古代著作中有“银针验毒”的记录,其原理为 ,则X的化学式是
,则X的化学式是___________ ,其中 在该反应中
在该反应中___________ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)按如图所示操作,充分反应后:

①II中发生反应的离子方程式为___________ 。
②结合I、II实验现象可知 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为___________ 。
(4)高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为: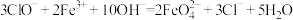
①该反应中发生还原反应的物质是___________ (填化学式,下同),氧化产物是___________ 。
②用双线桥法标出电子转移的数目和方向:___________ 。
(1)火药是中国的四大发明之一,永远值得华夏儿女骄傲,黑火药在发生爆炸时,发生如下反应:
 ,其中作氧化剂的是
,其中作氧化剂的是(2)中国古代著作中有“银针验毒”的记录,其原理为
 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)按如图所示操作,充分反应后:

①II中发生反应的离子方程式为
②结合I、II实验现象可知
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(4)高铁酸钠(
 )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为: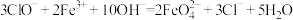
①该反应中发生还原反应的物质是
②用双线桥法标出电子转移的数目和方向:
您最近一年使用:0次
名校
解题方法
4 . 某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜。制备方法如下:
方法一:
(1)甲同学取6.4g铜片和10mL18mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中灰白色沉淀的主要成分。设计下列实验。
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:___________ ;
实验结论:所得灰白色固体的化学式为___________ 。
(2)乙同学还观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。淡黄色固体消失的原因是___________ (用化学反应方程式回答)。直到最后反应完毕,发现试管中还有铜片剩余。乙同学根据自己所学的化学知识,认为试管中还有硫酸剩余。他这样认为的理由是___________ 。
方法二:
(3)丙同学认为甲同学设计的实验方案不好,他自己设计的思路是:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O。
2CuO,CuO+H2SO4=CuSO4+H2O。
对比甲同学的方案,你认为丙同学的优点是:
①___________ ;
②___________ 。
方案三:
(4)丁同学取一块铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色。写出反应的化学反应方程式:___________ 。
方法一:
(1)甲同学取6.4g铜片和10mL18mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中灰白色沉淀的主要成分。设计下列实验。
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:
实验结论:所得灰白色固体的化学式为
(2)乙同学还观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。淡黄色固体消失的原因是
方法二:
(3)丙同学认为甲同学设计的实验方案不好,他自己设计的思路是:2Cu+O2
 2CuO,CuO+H2SO4=CuSO4+H2O。
2CuO,CuO+H2SO4=CuSO4+H2O。对比甲同学的方案,你认为丙同学的优点是:
①
②
方案三:
(4)丁同学取一块铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色。写出反应的化学反应方程式:
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题。
(1)实验室常用如图所示装置来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。
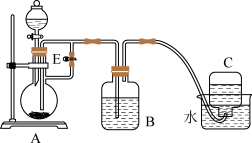
实验时在A中加入铁屑和稀硫酸,B中加入一定量的NaOH溶液,则A中发生的反应的离子方程式是_______ 。实验开始时先将活塞E_______ (填“打开”或“关闭”),C中收集到气体的主要成分是_______ 。实验结束后拔去装置B中橡皮塞,使空气进入,装置B中发生的现象为_______ 。
(2)从制造印刷电路板的腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜,并重新获得FeCl3溶液,处理流程如图所示:
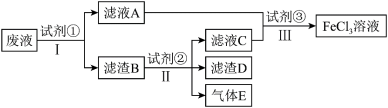
已知试剂①为铁,试剂②为稀盐酸,则滤渣的成分为_______ ,检验废液中Fe3+存在的最佳试剂是_______ (填标号),检验时实验现象为_______ 。
A.氢氧化钠溶液 B.酸性KMnO4溶液
C.氯水 D.KSCN溶液
检验Fe2+可用酸性KMnO4溶液,请写出离子方程式_______
(1)实验室常用如图所示装置来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。

实验时在A中加入铁屑和稀硫酸,B中加入一定量的NaOH溶液,则A中发生的反应的离子方程式是
(2)从制造印刷电路板的腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜,并重新获得FeCl3溶液,处理流程如图所示:

已知试剂①为铁,试剂②为稀盐酸,则滤渣的成分为
A.氢氧化钠溶液 B.酸性KMnO4溶液
C.氯水 D.KSCN溶液
检验Fe2+可用酸性KMnO4溶液,请写出离子方程式
您最近一年使用:0次
2022-12-25更新
|
207次组卷
|
2卷引用:陕西省榆林中学2022-2023学年高一上学期期末考试化学试题
6 . 绿矾是一种重要的硫酸盐,其化学式为FeSO4•7H2O。某化学兴趣小组对绿矾进行如图探究:
I.验证硫酸亚铁的分解产物。将一定量的绿矾固体脱水处理后置于仪器A中,打开K1和K2,缓缓通入N2,加热至恒重,实验后A中残留物为红色粉末。
[查阅资料]硫酸亚铁的分解产物是一种碱性氧化物、一种酸性氧化物和SO3。
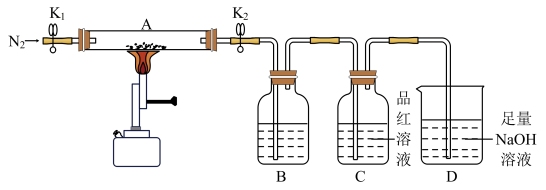
(1)取少量A中红色粉末于试管中,加入稀硫酸使其溶解,向溶液中滴加____ (填化学式)溶液,根据现象判断该红色粉末为Fe2O3。
(2)B、C中有气泡冒出,则B中的溶液为____ (填字母),C中可观察到的现象是____ 。
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.BaCl2溶液
(3)若将装置B和装置C的位置互换,是否可行?并说明理由____ 。
II.测定某绿矾样品中FeSO4•7H2O的含量。步骤如下:
①称取上述样品9.0g,溶于适量的稀硫酸中,配成250mL溶液;
②准确量取25.00mL该溶液于锥形瓶中,用0.02000mol•L-1的KMnO4溶液与之完全反应,消耗KMnO4溶液30.00mL(杂质不与KMnO4溶液反应)。
(4)实验室配制FeSO4溶液时,需加入少量Fe粉,目的是_____ (用离子方程式表示)。
(5)步骤②中KMnO4被还原成MnSO4,该反应的离子方程式为_____ 。
(6)该样品中FeSO4•7H2O的质量分数为_____ (结果精确到0.1%)。
I.验证硫酸亚铁的分解产物。将一定量的绿矾固体脱水处理后置于仪器A中,打开K1和K2,缓缓通入N2,加热至恒重,实验后A中残留物为红色粉末。
[查阅资料]硫酸亚铁的分解产物是一种碱性氧化物、一种酸性氧化物和SO3。

(1)取少量A中红色粉末于试管中,加入稀硫酸使其溶解,向溶液中滴加
(2)B、C中有气泡冒出,则B中的溶液为
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.BaCl2溶液
(3)若将装置B和装置C的位置互换,是否可行?并说明理由
II.测定某绿矾样品中FeSO4•7H2O的含量。步骤如下:
①称取上述样品9.0g,溶于适量的稀硫酸中,配成250mL溶液;
②准确量取25.00mL该溶液于锥形瓶中,用0.02000mol•L-1的KMnO4溶液与之完全反应,消耗KMnO4溶液30.00mL(杂质不与KMnO4溶液反应)。
(4)实验室配制FeSO4溶液时,需加入少量Fe粉,目的是
(5)步骤②中KMnO4被还原成MnSO4,该反应的离子方程式为
(6)该样品中FeSO4•7H2O的质量分数为
您最近一年使用:0次
7 . 某同学为探究元素周期表中元素性质的递变规律,进行了如下系列实验。回答问题:
探究1:验证氯元素的非金属性比硫元素的非金属性强。设计实验如图:

(1)装置A中盛放的试剂是____ (填字母),A中发生反应的化学方程式为____ 。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据是____ (填字母)。
探究2:验证同主族元素原子得电子能力强弱,进行如下实验:
I.向NaBr溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
II.向KI溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
III.在淀粉碘化钾试纸上滴加几滴溴水。
(3)实验I中的现象是____ 。
(4)根据I、II、III的实验现象可得Cl、Br、I的得电子能力强弱顺序为____ 。
(5)实验I、II得到的CCl4层中含有卤素单质,可用NaOH浓溶液反萃取分离回收。以下是反萃取回收I2的操作过程:
①向装有I2的CCl4溶液的分液漏斗中加入少量浓NaOH溶液;
②振荡至溶液的紫红色消失,静置、分层;
③先将CCl4层从仪器的下口放出,再将含I-、IO 的碱溶液从仪器的
的碱溶液从仪器的____ (填“上”或“下”)口倒入烧杯中;
④边搅拌边加入几滴45%的H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式____ 。
探究1:验证氯元素的非金属性比硫元素的非金属性强。设计实验如图:

(1)装置A中盛放的试剂是
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据是
| A.HCl比H2S稳定 | B.铁与Cl2反应生成FeCl3,而铁与硫反应生成FeS |
| C.HClO4的酸性比H2SO4的强 | D.HClO的氧化性比H2SO3的强 |
探究2:验证同主族元素原子得电子能力强弱,进行如下实验:
I.向NaBr溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
II.向KI溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
III.在淀粉碘化钾试纸上滴加几滴溴水。
(3)实验I中的现象是
(4)根据I、II、III的实验现象可得Cl、Br、I的得电子能力强弱顺序为
(5)实验I、II得到的CCl4层中含有卤素单质,可用NaOH浓溶液反萃取分离回收。以下是反萃取回收I2的操作过程:
①向装有I2的CCl4溶液的分液漏斗中加入少量浓NaOH溶液;
②振荡至溶液的紫红色消失,静置、分层;
③先将CCl4层从仪器的下口放出,再将含I-、IO
 的碱溶液从仪器的
的碱溶液从仪器的④边搅拌边加入几滴45%的H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式
您最近一年使用:0次
8 . 根据所学知识回答下列问题:
(1)将一小块新切的金属钠迅速放入平底烧瓶底部,按图甲所示塞紧瓶塞。过一段时间后可观察到的现象有__________ ,发生反应的化学方程式为___________ 。

(2)按图乙所示的装置,进行钠与水反应的实验,实验开始时,振动细铁丝使钠块掉入滴有酚酞的水溶液中,可观察到钠与水反应的现象,不同的现象反映钠的不同性质。

①能证明钠的密度比水的小的现象是___________ 。
②能证明钠的熔点低的现象是___________ 。
③能证明有氢氧化钠生成的现象是___________ 。
(3)少量Na2O2与FeCl2溶液可发生反应,其化学方程式为Na2O2+FeCl2+H2O→Fe(OH)3+FeCl3+NaCl(未配平)。已知FeCl2的化学计量数为6,配平上述化学方程式___________ 。
(4)向Na2O2中滴加浓盐酸,试管壁发热,有刺激性气味的气体产生,反应后所得溶液呈浅黄绿色。推测产生该气体的反应的化学方程式为___________ 。
(1)将一小块新切的金属钠迅速放入平底烧瓶底部,按图甲所示塞紧瓶塞。过一段时间后可观察到的现象有

(2)按图乙所示的装置,进行钠与水反应的实验,实验开始时,振动细铁丝使钠块掉入滴有酚酞的水溶液中,可观察到钠与水反应的现象,不同的现象反映钠的不同性质。

①能证明钠的密度比水的小的现象是
②能证明钠的熔点低的现象是
③能证明有氢氧化钠生成的现象是
(3)少量Na2O2与FeCl2溶液可发生反应,其化学方程式为Na2O2+FeCl2+H2O→Fe(OH)3+FeCl3+NaCl(未配平)。已知FeCl2的化学计量数为6,配平上述化学方程式
(4)向Na2O2中滴加浓盐酸,试管壁发热,有刺激性气味的气体产生,反应后所得溶液呈浅黄绿色。推测产生该气体的反应的化学方程式为
您最近一年使用:0次
解题方法
9 . 二氧化氯( )是一种优良的消毒剂,熔点为
)是一种优良的消毒剂,熔点为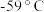 ,沸点为
,沸点为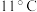 ,浓度过高时易发生分解,甚至爆炸,若用空气、二氧化碳、氮气等气体稀释,则爆炸性降低。用干燥的氯气与亚氯酸钠(
,浓度过高时易发生分解,甚至爆炸,若用空气、二氧化碳、氮气等气体稀释,则爆炸性降低。用干燥的氯气与亚氯酸钠( )固体制备二氧化氯并探究其性质,装置如图:
)固体制备二氧化氯并探究其性质,装置如图:

(1)装置A中盛放浓盐酸的仪器的名称为___________ ,发生反应的离子方程式为___________ 。
(2)用下列两种方法制取氯气:①用含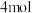 氯化氢的浓盐酸与足量的二氧化锰反应,②用
氯化氢的浓盐酸与足量的二氧化锰反应,②用 二氧化锰与足量的浓盐酸反应。所得氯气___________(填字母)。
二氧化锰与足量的浓盐酸反应。所得氯气___________(填字母)。
(3)装置D中通入干燥空气的作用是___________ 。
(4)探究 性质:
性质:
①通过___________ 法,确认冰水浴槽收集到的液态 为黄绿色。
为黄绿色。
②将二氧化氯泡腾片放入品红溶液中,红色溶液变为无色,微热无色溶液,不变色。由此推知, 具有
具有___________ 性。
③将二氧化氯通入含 的废水中,产生两种对环境友好的气体,氯被还原成最低价离子。这两种气体的化学式为
的废水中,产生两种对环境友好的气体,氯被还原成最低价离子。这两种气体的化学式为___________ 。
 )是一种优良的消毒剂,熔点为
)是一种优良的消毒剂,熔点为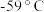 ,沸点为
,沸点为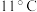 ,浓度过高时易发生分解,甚至爆炸,若用空气、二氧化碳、氮气等气体稀释,则爆炸性降低。用干燥的氯气与亚氯酸钠(
,浓度过高时易发生分解,甚至爆炸,若用空气、二氧化碳、氮气等气体稀释,则爆炸性降低。用干燥的氯气与亚氯酸钠( )固体制备二氧化氯并探究其性质,装置如图:
)固体制备二氧化氯并探究其性质,装置如图:
(1)装置A中盛放浓盐酸的仪器的名称为
(2)用下列两种方法制取氯气:①用含
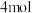 氯化氢的浓盐酸与足量的二氧化锰反应,②用
氯化氢的浓盐酸与足量的二氧化锰反应,②用 二氧化锰与足量的浓盐酸反应。所得氯气___________(填字母)。
二氧化锰与足量的浓盐酸反应。所得氯气___________(填字母)。| A.①比②多 | B.②比①多 | C.一样多 | D.无法比较 |
(3)装置D中通入干燥空气的作用是
(4)探究
 性质:
性质:①通过
 为黄绿色。
为黄绿色。②将二氧化氯泡腾片放入品红溶液中,红色溶液变为无色,微热无色溶液,不变色。由此推知,
 具有
具有③将二氧化氯通入含
 的废水中,产生两种对环境友好的气体,氯被还原成最低价离子。这两种气体的化学式为
的废水中,产生两种对环境友好的气体,氯被还原成最低价离子。这两种气体的化学式为
您最近一年使用:0次
名校
解题方法
10 . 目前工业制备硫酸主要采用接触法,以黄铁矿( )为原料在沸腾炉制得
)为原料在沸腾炉制得 在经过氧化和和吸收获得硫酸。
在经过氧化和和吸收获得硫酸。
(1)请写出黄铁矿在沸腾炉里燃烧制得 的反应方程
的反应方程___________ ,若生成 气体标准状况下179.2L,则反应中转移的电子物质的量为
气体标准状况下179.2L,则反应中转移的电子物质的量为___________ 。
(2)某同学用如图装置(夹持装置略)探究铜丝与过量浓硫酸的反应,回答下列问题:

①铜与浓硫酸反应的化学方程式为___________ 。
②C中应加入的试剂为NaOH溶液,倒置漏斗的作用是___________ 。
③与向浓硫酸中直接加入铜片相比,该装置用可上下移动的铜丝,优点是:___________ 。
(3)油画的白色燃料中曾含二价铅盐,二价铅盐经过长时间空气(含有微量 )的侵蚀,生成PbS而变黑,可用一定量的
)的侵蚀,生成PbS而变黑,可用一定量的 溶液擦洗修复,
溶液擦洗修复, 与PbS反应生成
与PbS反应生成 的和
的和 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(4)硝酸是重要的化工原料,也是重要的氧化剂,将过量的铁投入到500mL的稀硝酸中,请写出对应的离子方程式___________ ,若生成标况下的气体为4.48L,则硝酸的物质的量浓度为___________ 。“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”,减少废气的排放是环境保护的重要内容之一,氮氧化物是形成光化学烟雾的主要元凶,利用碱液吸收法可以有效地吸收氮氧化物,发生的反应有 、
、
 ,若某混合气体中含a mol NO和b mol
,若某混合气体中含a mol NO和b mol  ,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为___________ 。
 )为原料在沸腾炉制得
)为原料在沸腾炉制得 在经过氧化和和吸收获得硫酸。
在经过氧化和和吸收获得硫酸。(1)请写出黄铁矿在沸腾炉里燃烧制得
 的反应方程
的反应方程 气体标准状况下179.2L,则反应中转移的电子物质的量为
气体标准状况下179.2L,则反应中转移的电子物质的量为(2)某同学用如图装置(夹持装置略)探究铜丝与过量浓硫酸的反应,回答下列问题:

①铜与浓硫酸反应的化学方程式为
②C中应加入的试剂为NaOH溶液,倒置漏斗的作用是
③与向浓硫酸中直接加入铜片相比,该装置用可上下移动的铜丝,优点是:
(3)油画的白色燃料中曾含二价铅盐,二价铅盐经过长时间空气(含有微量
 )的侵蚀,生成PbS而变黑,可用一定量的
)的侵蚀,生成PbS而变黑,可用一定量的 溶液擦洗修复,
溶液擦洗修复, 与PbS反应生成
与PbS反应生成 的和
的和 ,写出该反应的化学方程式
,写出该反应的化学方程式(4)硝酸是重要的化工原料,也是重要的氧化剂,将过量的铁投入到500mL的稀硝酸中,请写出对应的离子方程式
 、
、
 ,若某混合气体中含a mol NO和b mol
,若某混合气体中含a mol NO和b mol  ,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
您最近一年使用:0次



