1 . 铊(Tl)本身是一种剧毒物质,为毒性最大的金属元素之一,但是铊在工业中的用途非常广泛,主要存在于一些矿物和工业废水中,也可以从含铊的合金中提取.从某铅锌厂的富铊灰(主要成分为 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示:
①在氯化物-硫酸水溶液中,铊元素以 形式存在;
形式存在;
(2)萃取过程的反应原理为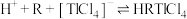 .
.
请回答下列问题:
(1)基态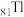 原子核外电子的运动状态有
原子核外电子的运动状态有________ 种.
(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有________________ (写出两条).
(3)写出“浸取I”中 发生反应的化学方程式:
发生反应的化学方程式:________________ ,“滤渣”的主要成分是________ (填化学式).
(4)请从化学平衡的角度解释“反萃取”过程中加入 溶液的原因:
溶液的原因:________________ .
(5)写出“还原氯化沉淀”中反应的离子方程式:________________ .
(6)通过沉淀法也可以去除工业废水中的 和
和 .
.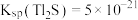 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中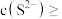
________  (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).
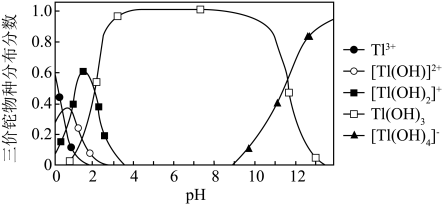
②向含铊废水中加入溴水,使 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是________________ .
 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示: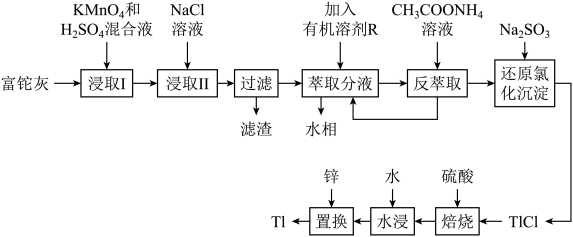
①在氯化物-硫酸水溶液中,铊元素以
 形式存在;
形式存在;(2)萃取过程的反应原理为
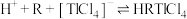 .
.请回答下列问题:
(1)基态
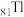 原子核外电子的运动状态有
原子核外电子的运动状态有(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有
(3)写出“浸取I”中
 发生反应的化学方程式:
发生反应的化学方程式:(4)请从化学平衡的角度解释“反萃取”过程中加入
 溶液的原因:
溶液的原因:(5)写出“还原氯化沉淀”中反应的离子方程式:
(6)通过沉淀法也可以去除工业废水中的
 和
和 .
.
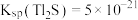 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中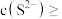
 (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).②向含铊废水中加入溴水,使
 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
您最近一年使用:0次
解题方法
2 . 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。

(1)实验室中常用来制备氯气的化学方程式为__________ 。
(2)工业上利用天然气(主要成分为 )与
)与 进行高温重整制备CO,已知
进行高温重整制备CO,已知 、
、 和CO的燃烧热(
和CO的燃烧热( )分别为
)分别为 、
、 、
、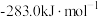 ,则生成1mol CO所需热量为
,则生成1mol CO所需热量为__________ (保留2位小数)。
(3)实验室中可用氯仿( )与双氧水直接反应制备光气,其反应的化学方程式为:
)与双氧水直接反应制备光气,其反应的化学方程式为:__________ 。
(4)右图是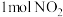 和1mol CO反应生成
和1mol CO反应生成 和NO过程中能量变化示意图,则该反应是
和NO过程中能量变化示意图,则该反应是______ (填“吸热”或“放热”)反应;若使用催化剂,则图中:
______ 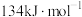 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(5)已知:
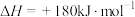

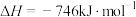
则反应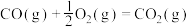 的
的
______ 
(6)已知 、
、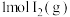 与
与 分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成
分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成 和
和 的热化学方程式为:
的热化学方程式为:______ 。

(1)实验室中常用来制备氯气的化学方程式为
(2)工业上利用天然气(主要成分为
 )与
)与 进行高温重整制备CO,已知
进行高温重整制备CO,已知 、
、 和CO的燃烧热(
和CO的燃烧热( )分别为
)分别为 、
、 、
、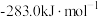 ,则生成1mol CO所需热量为
,则生成1mol CO所需热量为(3)实验室中可用氯仿(
 )与双氧水直接反应制备光气,其反应的化学方程式为:
)与双氧水直接反应制备光气,其反应的化学方程式为:(4)右图是
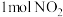 和1mol CO反应生成
和1mol CO反应生成 和NO过程中能量变化示意图,则该反应是
和NO过程中能量变化示意图,则该反应是
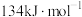 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(5)已知:

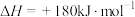

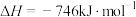
则反应
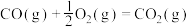 的
的

(6)已知
 、
、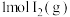 与
与 分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成
分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成 和
和 的热化学方程式为:
的热化学方程式为:
您最近一年使用:0次
解题方法
3 . 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是 、
、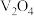 ,含有
,含有 、
、 及
及 、
、 、
、 等化合物杂质)制备单质钒的工艺流程图如下所示:
等化合物杂质)制备单质钒的工艺流程图如下所示:

已知:①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
② 、
、 、
、 远大于
远大于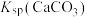 。
。
③一般认为平衡常数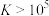 反应较完全。
反应较完全。
回答下列问题:
(1)为了提高“焙烧”效率,可采用的措施有___________ 、___________ 。
(2)“焙烧”时, 、
、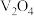 都转化为
都转化为 ,写出
,写出 转化为
转化为 的化学反应方程式
的化学反应方程式_____ 。
(3)“水浸”加入 调节溶液的pH为8.5,可完全除去的金属离子有
调节溶液的pH为8.5,可完全除去的金属离子有_____ ,及部分的______ 。“水浸”加入 不能使
不能使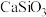 完全转化,原因是
完全转化,原因是______ 。
(4)“离子交换”可表示为 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂, 为
为 在水溶液中的实际存在形式),则“洗脱”过程“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程“淋洗液”最好选用_____ 。
(5)下列金属冶炼方法与本工艺流程中加入钙冶炼V的方法相似的是____。
 、
、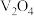 ,含有
,含有 、
、 及
及 、
、 、
、 等化合物杂质)制备单质钒的工艺流程图如下所示:
等化合物杂质)制备单质钒的工艺流程图如下所示:
已知:①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 |
|
|
|
|
开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
 、
、 、
、 远大于
远大于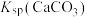 。
。③一般认为平衡常数
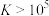 反应较完全。
反应较完全。回答下列问题:
(1)为了提高“焙烧”效率,可采用的措施有
(2)“焙烧”时,
 、
、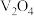 都转化为
都转化为 ,写出
,写出 转化为
转化为 的化学反应方程式
的化学反应方程式(3)“水浸”加入
 调节溶液的pH为8.5,可完全除去的金属离子有
调节溶液的pH为8.5,可完全除去的金属离子有 不能使
不能使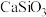 完全转化,原因是
完全转化,原因是(4)“离子交换”可表示为
 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂, 为
为 在水溶液中的实际存在形式),则“洗脱”过程“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程“淋洗液”最好选用(5)下列金属冶炼方法与本工艺流程中加入钙冶炼V的方法相似的是____。
| A.高炉炼铁 | B.电解熔融NaCl制钠 | C.利用铝热反应制锰 | D.氧化汞分解制汞 |
您最近一年使用:0次
2023-03-22更新
|
650次组卷
|
2卷引用:湖南省名校联盟2023届高三3月联考化学试题
4 . 单一盐R仅由Fe、N、O三种元素组成,某化学兴趣小组称取4.84 g盐R进行相关实验,数据和现象如下:
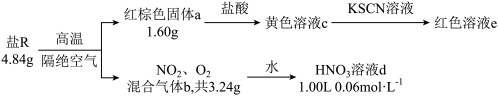
已知:①红棕色固体a为纯净物;
②混合气体b通入足量的水中,完全反应后,仅得到一种生成物;
③不考虑反应过程中的质量损失;
④ 遇KSCN溶液显血红色。
遇KSCN溶液显血红色。
回答下列问题:
(1)红棕色固体a为___________ (填化学式),其在生活中的用途有___________ (填一种即可)。
(2)盐R中Fe元素的化合价为___________ 价。
(3)写出盐R在上述条件下发生反应的化学方程式:___________ ,该反应中氧化产物与还原产物的总物质的量之比为___________ 。
(4)写出上述混合气体b通入水中发生反应的离子方程式:___________ 。
(5)研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铜加入上述所得的稀释后的溶液d中(假设溶液d很稀),恰好完全反应,无气体放出,则消耗铜的质量为___________ g。

已知:①红棕色固体a为纯净物;
②混合气体b通入足量的水中,完全反应后,仅得到一种生成物;
③不考虑反应过程中的质量损失;
④
 遇KSCN溶液显血红色。
遇KSCN溶液显血红色。回答下列问题:
(1)红棕色固体a为
(2)盐R中Fe元素的化合价为
(3)写出盐R在上述条件下发生反应的化学方程式:
(4)写出上述混合气体b通入水中发生反应的离子方程式:
(5)研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铜加入上述所得的稀释后的溶液d中(假设溶液d很稀),恰好完全反应,无气体放出,则消耗铜的质量为
您最近一年使用:0次
2023-04-18更新
|
252次组卷
|
6卷引用:湖南省怀化市溆浦县玉潭高级中学2022-2023学年高一下学期第一次月考化学试题
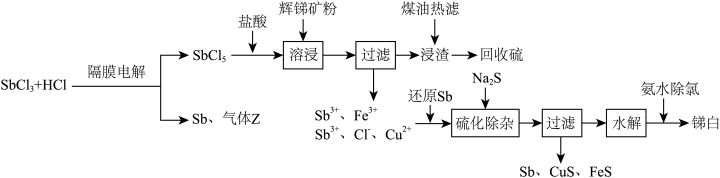
名校
5 . 三氧化二锑,又称锑白,在工业上作阻燃剂、填充剂等,用途广泛。一种利用辉锑矿粉(含 及少量
及少量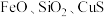 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,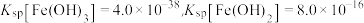 ,
, 。
。
②锑的常见价态为+3、+5价,其中 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。
(1)锑元素的原子序数为51,位于元素周期表第___________ 周期第___________ 族。
(2)溶浸时发生的主要反应的离子方程式为___________ 。
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是___________ 。
(4) 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:___________ ,锑白洗涤后便可干燥保存,检验洗净的试剂为___________ 。
(5)隔膜电解时,气体Z的分子式为___________ ;为平衡两极电荷,应使用___________ 交换膜(填“阴离子”“阳离子”或“质子”),理由是___________ 。
 及少量
及少量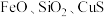 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,
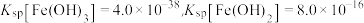 ,
, 。
。②锑的常见价态为+3、+5价,其中
 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。(1)锑元素的原子序数为51,位于元素周期表第
(2)溶浸时发生的主要反应的离子方程式为
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是
(4)
 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:(5)隔膜电解时,气体Z的分子式为
您最近一年使用:0次
2023-02-03更新
|
419次组卷
|
2卷引用:湖南省祁阳市第一中学2023届高三月考(六)化学试题
名校
6 . 钴的化合物种类较多,其中三氯化六氨合(III){[Co(NH3)6]C13}(M=267.5g/mol),在工业上用途广泛。实验室以活性炭作为催化剂,以H2O2作氧化剂氧化CoC12的方法制备三氯化六氨合钴。
已知:①钴单质在300℃以上易被氧气氧化,CoC12易潮解。②Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
I.CoC12的制备。

(1)B装置中盛放浓盐酸的仪器名称是_______ 。
(2)按照气体流向从左到右连接仪器的顺序为_______ →_______ →_______ 。
(3)B装置的烧瓶中发生反应的离子方程式为_______ 。
(4)实验时,要先加入浓盐酸,使B装置中开始生成氯气,待_______ (填现象)时,再加热A装置,目的是_______ 。
II.三氯化六氨合钴(III)的制备。

①先向三颈烧瓶中加入活性炭、CoCl2和NH4Cl溶液,然后滴加稍过量的浓氨水;
②冷水浴冷却至10℃以下,缓慢滴加H2O2溶液并不断搅拌;
③转移至60℃水浴中,恒温加热同时缓慢搅拌;
④冷却结晶,过滤洗涤可得三氯化六氨合钴(III){[Co(NH3)6]Cl3)粗产品。
(5)D装置中制备三氯化六氨合钴(III)的总反应化学方程式为_______ 。
III.纯度测定。
(6)称取mg粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→_______ (按顺序填序号),纯度为_______ (写出表达式)。
a.向锥形瓶中加入稍过量的KI溶液(Co3+被还原后的产物为Co2+),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为VmL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定(产物为 )
)
已知:①钴单质在300℃以上易被氧气氧化,CoC12易潮解。②Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
I.CoC12的制备。

(1)B装置中盛放浓盐酸的仪器名称是
(2)按照气体流向从左到右连接仪器的顺序为
(3)B装置的烧瓶中发生反应的离子方程式为
(4)实验时,要先加入浓盐酸,使B装置中开始生成氯气,待
II.三氯化六氨合钴(III)的制备。

①先向三颈烧瓶中加入活性炭、CoCl2和NH4Cl溶液,然后滴加稍过量的浓氨水;
②冷水浴冷却至10℃以下,缓慢滴加H2O2溶液并不断搅拌;
③转移至60℃水浴中,恒温加热同时缓慢搅拌;
④冷却结晶,过滤洗涤可得三氯化六氨合钴(III){[Co(NH3)6]Cl3)粗产品。
(5)D装置中制备三氯化六氨合钴(III)的总反应化学方程式为
III.纯度测定。
(6)称取mg粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→
a.向锥形瓶中加入稍过量的KI溶液(Co3+被还原后的产物为Co2+),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为VmL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定(产物为
 )
)
您最近一年使用:0次
2022-06-02更新
|
985次组卷
|
4卷引用:湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题
7 . 重铬酸钠在工业生产上具有广泛用途。一种以铬铁矿(含 及少量
及少量 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下:
已知滤渣1为 下列说法错误的是
下列说法错误的是
 及少量
及少量 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下:
已知滤渣1为
 下列说法错误的是
下列说法错误的是A.“高温熔烧"发生的主要反应为 |
B.滤渣2的成分是 和 和 |
| C.“调pH”是向溶液中加NaOH使pH增大 |
D.流程中可循环使用的物质有 |
您最近一年使用:0次
2021-10-28更新
|
122次组卷
|
2卷引用:湖南省三湘名校教育联盟2021-2022学年高三上学期第一次大联考化学试题
8 . 过硼酸钠是一种用途广泛的无机过氧化物,可用作织物的漂白、染色,医药上可作为消毒剂和杀菌剂。一种由硼镁矿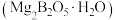 制取过硼酸钠
制取过硼酸钠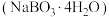 的工艺流程图如下所示。
的工艺流程图如下所示。

已知:
①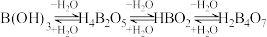 ,若
,若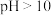 时,以
时,以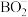 形式存在;若
形式存在;若 时,以
时,以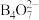 形式存在。
形式存在。
②过硼酸钠为白色晶体,微溶于水,其水溶液不稳定,存在于冷的溶液中,难溶于乙醇。
③硼砂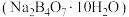 为白色晶体,溶于水吸热,在水中溶解度如图1所示。
为白色晶体,溶于水吸热,在水中溶解度如图1所示。

回答下列问题:
(1)步骤Ⅰ中为加快硼镁矿浸出,除粉碎矿石、升高温度外,还可采取的措施___________ 。(填一项操作即可)
(2)写出步骤Ⅰ中的化学方程式___________ 。
(3)下列说法不正确的是___________。
(4)步骤Ⅲ的回流反应过程需要控制恒温水浴(0℃左右)的理由是_____ 。
请选出正确的操作排序完成装置A中的回流反应:按图2组装好装置→(___________)→(___________)→打开磁力搅拌器→打开冷凝水→(___________)→(___________)→(___________)_____ 。
①用纸槽向c处加入硼砂;②用漏斗向c处加入硼砂;③打开a处旋塞加入双氧水
④调高恒温水浴温度;⑤调低恒温水浴温度;⑥c处加入氢氧化钠溶液。
(5)硼砂水溶液具有缓冲溶液(指酸和盐的混合体系,如醋酸和醋酸钠)的作用,请用离子方程式表示该缓冲溶液的形成过程___________ 。
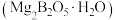 制取过硼酸钠
制取过硼酸钠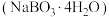 的工艺流程图如下所示。
的工艺流程图如下所示。
已知:
①
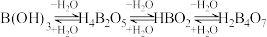 ,若
,若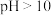 时,以
时,以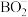 形式存在;若
形式存在;若 时,以
时,以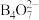 形式存在。
形式存在。②过硼酸钠为白色晶体,微溶于水,其水溶液不稳定,存在于冷的溶液中,难溶于乙醇。
③硼砂
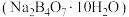 为白色晶体,溶于水吸热,在水中溶解度如图1所示。
为白色晶体,溶于水吸热,在水中溶解度如图1所示。
回答下列问题:
(1)步骤Ⅰ中为加快硼镁矿浸出,除粉碎矿石、升高温度外,还可采取的措施
(2)写出步骤Ⅰ中的化学方程式
(3)下列说法不正确的是___________。
A.步骤Ⅱ中通入的 目的是降低溶液pH值使 目的是降低溶液pH值使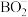 转为 转为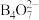 |
| B.步骤Ⅰ、Ⅱ中操作①为过滤,操作②为蒸发浓缩、冷却结晶、抽滤 |
C.步骤Ⅲ发生化学反应生成过硼酸钠(其阴离子结构如图所示),其中硼元素的化合价未发生变化 |
| D.步骤Ⅳ中宜选用的洗涤剂和干燥方式分别为蒸馏水和减压干燥 |
请选出正确的操作排序完成装置A中的回流反应:按图2组装好装置→(___________)→(___________)→打开磁力搅拌器→打开冷凝水→(___________)→(___________)→(___________)
①用纸槽向c处加入硼砂;②用漏斗向c处加入硼砂;③打开a处旋塞加入双氧水
④调高恒温水浴温度;⑤调低恒温水浴温度;⑥c处加入氢氧化钠溶液。
(5)硼砂水溶液具有缓冲溶液(指酸和盐的混合体系,如醋酸和醋酸钠)的作用,请用离子方程式表示该缓冲溶液的形成过程
您最近一年使用:0次
2022-03-26更新
|
691次组卷
|
4卷引用:湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题
湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题浙江省温州市2022届高三高考适应性测试(二模)化学试题(已下线)化学-2022年高考押题预测卷03(浙江卷)浙江省温州市2022届高三选考二模化学试题
解题方法
9 . 钒具有众多优异的物理性能和化学性能,有金属“维生素”之称。钒酸钇(YVO4)广泛应用于光学器械。某化工厂以工业下脚料(含V2O5、K2O、SiO2、少量Fe2O3)为原料制取V、YVO4的工艺流程如下:

其中料液1中钒以VO2+形式存在,碱溶氧化前的钒以V2O2(OH)4固体形成存在。
回答下列问题:
(1)V2O2(OH)4中V元素的化合价为_______ ,写出料渣1的一种用途_______ ,写出一种能提高酸浸还原反应速率的方法_______ 。
(2)酸浸还原过程中,1 mol 可还原
可还原_______ mol V2O5,料液2中的溶质主要是_______ 。
(3)碱溶氧化中发生反应的化学方程式为_______ ,NH4VO3是铵盐,受热或灼烧会发生一系列的分解反应,则当NH4VO3样品质量减轻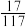 时,剩余固体的成分是
时,剩余固体的成分是_______ (写化学式)。
(4)NH4VO3微溶于冷水,已知常温下Ksp(NH4VO3)=0.0016,则常温下NH4VO3,溶液中c( )最大值为
)最大值为_______ 。 下 列方法不能将V2O5转化为V的是_______ (填字母)。
A.热分解法 B.铝热反应法 C.热还原法

其中料液1中钒以VO2+形式存在,碱溶氧化前的钒以V2O2(OH)4固体形成存在。
回答下列问题:
(1)V2O2(OH)4中V元素的化合价为
(2)酸浸还原过程中,1 mol
 可还原
可还原(3)碱溶氧化中发生反应的化学方程式为
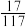 时,剩余固体的成分是
时,剩余固体的成分是(4)NH4VO3微溶于冷水,已知常温下Ksp(NH4VO3)=0.0016,则常温下NH4VO3,溶液中c(
 )最大值为
)最大值为A.热分解法 B.铝热反应法 C.热还原法
您最近一年使用:0次






