名校
解题方法
1 . I.硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
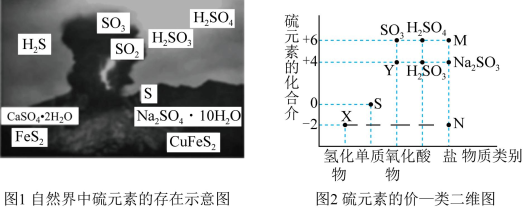
(1)图1中与图2中M、N对应的物质分别是____ 、____ 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为____ 。
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为____ 。
II.为探究影响H2O2分解速率的因素,设计如表实验:
(4)实验①③研究的是____ 对H2O2分解速率的影响。
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=____ 。
(6)实验①②研究的是____ 对H2O2分解速率的影响。
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起____ 作用。

(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为
II.为探究影响H2O2分解速率的因素,设计如表实验:
| 编号 | 温度 | c(H2O2)/mol·L−1 | V(H2O2)/mL | 催化剂 |
| ① | 20℃ | 0.4 | 10 | 无 |
| ② | 20℃ | 0.8 | 10 | 无 |
| ③ | 30℃ | 0.4 | 10 | 无 |
| ④ | 30℃ | 0.4 | 10 | MnO2 |
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=
(6)实验①②研究的是
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起
您最近一年使用:0次
2 . 现有下列物质(括号内为对应物质的主要成分):a.熔融NaOH;b.医用酒精;c.蔗糖晶体;d.加碘盐(NaCl和KIO3);e.“84”消毒液(NaClO);f.小苏打(NaHCO3);g.洁厕灵(HCl),回答下列问题:
(1)上述状态下的物质中,属于电解质且能导电的是_______ (填字母,下同);d和f均为厨房中的常用物质,可用于区分两者的物质是________ 。
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:________ 。
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:___________ ;该反应中被氧化的Ⅰ原子与被还原的Ⅰ原子的个数之比为___________ 。
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:_____ ,__NaClO2+__NaHSO4=___ClO2+___NaCl+__Na2SO4+____H2O;若每片泡腾片中NaClO2的质量分数≥17%为合格品,上述所得ClO2溶液的物质的量浓度为0.002mol/L,则所用泡腾片____ (填“属于”或“不属于”)合格品。
(1)上述状态下的物质中,属于电解质且能导电的是
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:
您最近一年使用:0次
3 . 铅及其化合物用途多样。查资料得知 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:
(1)铅是碳的同族元索,铅原子基态价电子排布式为___________ ,常见价态为_____ 和_____ 。
(2) 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为___________ 。
(3) 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为___________ ; 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和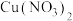 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为___________ 。
(4) 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即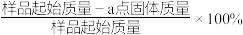 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为___________ 。 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①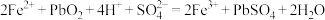
②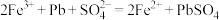
上述过程中 的作用是
的作用是___________ ,请设计实验方案证明 的作用
的作用___________ 。
 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:(1)铅是碳的同族元索,铅原子基态价电子排布式为
(2)
 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为(3)
 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和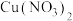 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为(4)
 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即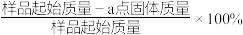 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为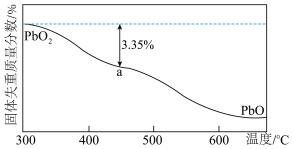
 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:①
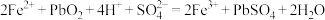
②
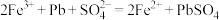
上述过程中
 的作用是
的作用是 的作用
的作用
您最近一年使用:0次
名校
解题方法
4 . 草酸用途广泛。工业制草酸的方法之一是钙化法,工艺流程如图所示。回答下列问题:

已知:草酸钙和硫酸钙的溶度积分别为:Ksp(CaC2O4)=2×10-6、Ksp(CaSO4)=9.1×10-6
(1)气体X是_______ 。(填化学式)
(2)酸化过程发生反应的离子方程式为__ ,为提高酸化反应的产率,可以采取的方法是___ 。
(3)工艺流程中能够循环使用的物质有___ 。
(4)碳酸、草酸在25℃的电离平衡常数如下表:
NaHC2O4溶液显____ 性,其与NaHCO3溶液反应的化学方程式为____ 。
(5)73gCaC2O4·H2O受热分解时,固体产物的质量随温度的变化如下表:
①500℃时固体产物为____ (填化学式)。
②请写出将CaC2O4·H2O加热至1100℃过程中总反应的化学方程式____ 。

已知:草酸钙和硫酸钙的溶度积分别为:Ksp(CaC2O4)=2×10-6、Ksp(CaSO4)=9.1×10-6
(1)气体X是
(2)酸化过程发生反应的离子方程式为
(3)工艺流程中能够循环使用的物质有
(4)碳酸、草酸在25℃的电离平衡常数如下表:
| H2CO3 | H2C2O4 | |
| 电离平衡常数 | Ka1=4.4×10-7 Ka2=4.7×10-11 | Ka1=5.4×10-2 Ka2=5.4×10-5 |
(5)73gCaC2O4·H2O受热分解时,固体产物的质量随温度的变化如下表:
| 温度/℃ | 25 | 300 | 350 | 500 | 800 | 1100 | 1200 |
| 固体质量/g | 73 | 64 | 64 | 50 | 50 | 28 | 28 |
②请写出将CaC2O4·H2O加热至1100℃过程中总反应的化学方程式
您最近一年使用:0次



