名校
解题方法
1 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:
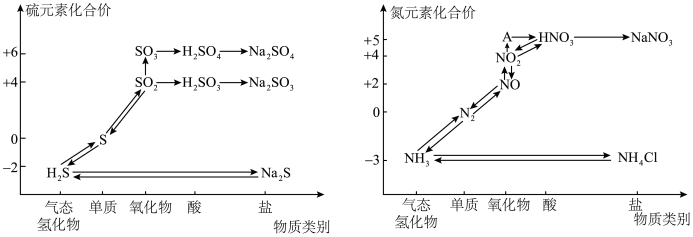
(1)根据 A 对应的化合价和物质类别,A 为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式___________ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ ,反应的离子方程式为___________ 。
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:
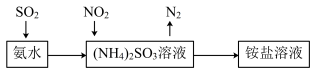
NO2 被吸收过程的离子方程式是___________ 。

(1)根据 A 对应的化合价和物质类别,A 为
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:

NO2 被吸收过程的离子方程式是
您最近一年使用:0次
名校
2 . 氧化还原反应在日常生活和工业生产中有重要应用。
I. 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: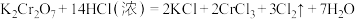 。
。
(1)该反应中被氧化的元素是_______ ,还原产物是_______ 。
(2)该反应中氧化剂与还原剂的个数比为_______ 。
(3)生成标准状况下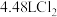 ,转移的电子个数为
,转移的电子个数为_______ (用 表示)。
表示)。
II.阅读下面一段材料并回答问题。
(4)K2FeO4中铁元素的化合价为_______ 。
(5)下列关于K2FeO4的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:_______ 。
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
I.
 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: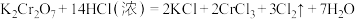 。
。(1)该反应中被氧化的元素是
(2)该反应中氧化剂与还原剂的个数比为
(3)生成标准状况下
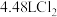 ,转移的电子个数为
,转移的电子个数为 表示)。
表示)。II.阅读下面一段材料并回答问题。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准 |
(5)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
您最近一年使用:0次
名校
解题方法
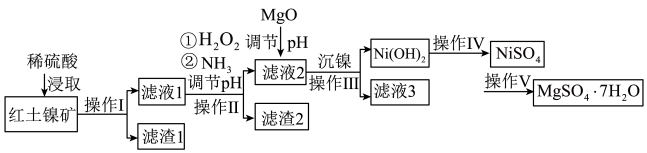
3 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;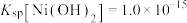 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“浸取”时需将矿样研磨的目的是______ ,“滤渣1”的成分______ (填化学式)。
(2)“滤液1”中加入 的作用是
的作用是______ (用离子反应方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是______ 。
(4)“滤液1”中是否存在 ,可用
,可用______ 检验。
(5)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为______  。
。
(6)操作V是______ 、过滤、洗涤。
(7) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为______ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;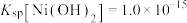 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全( | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“浸取”时需将矿样研磨的目的是
(2)“滤液1”中加入
 的作用是
的作用是(3)操作II为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(4)“滤液1”中是否存在
 ,可用
,可用(5)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(6)操作V是
(7)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
2023-02-10更新
|
1018次组卷
|
7卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题
解题方法
4 . 回答下列问题:
Ⅰ.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究 的性质,请补全实验现象b.
的性质,请补全实验现象b._______ ,根据实验2现象写出该反应的离子方程式_______ 。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与 反应产生促进藻类快速生长。该反应说明氧化性:NaClO
反应产生促进藻类快速生长。该反应说明氧化性:NaClO_______  (填“>”或“<”);当有0.2mol
(填“>”或“<”);当有0.2mol 生成时,转移电子的物质的量为
生成时,转移电子的物质的量为_______ mol。
Ⅱ.亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
_______ _______
_______ _______=_______
_______=_______ _______
_______ _______
_______ _______
_______ _______
_______
(3)请完成该化学方程式并配平。_______
(4)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目_______ 。
Ⅰ.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究
 的性质,请补全实验现象b.
的性质,请补全实验现象b.| 序号 | 实验 | 实验现象 |
| 1 | 向5% 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去; b._______ |
| 2 | 向含5% 的酸性溶液中滴加淀粉碘化钾溶液 的酸性溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与
 反应产生促进藻类快速生长。该反应说明氧化性:NaClO
反应产生促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当有0.2mol
(填“>”或“<”);当有0.2mol 生成时,转移电子的物质的量为
生成时,转移电子的物质的量为Ⅱ.亚硝酸钠(
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______
 _______
_______ _______=_______
_______=_______ _______
_______ _______
_______ _______
_______ _______
_______
(3)请完成该化学方程式并配平。
(4)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目
您最近一年使用:0次
2022-11-02更新
|
234次组卷
|
2卷引用:湖南省长沙市三湘教育联盟2022-2023学年高一上学期11月联考化学试题
名校
解题方法
5 . 硫酸亚铁铵是一种重要的化工原料,用途十分广泛。实验室可用如图所示流程制备硫酸亚铁铵,下列说法错误的是


| A.步骤①中用Na2CO3溶液处理的目的是去除废铁屑表面的油污 |
| B.为了提高产率,步骤②中硫酸一定要过量 |
| C.步骤②中发生的氧化还原反应主要有Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+ |
| D.步骤③的操作为蒸发结晶 |
您最近一年使用:0次





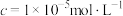 )时的pH
)时的pH

