名校
解题方法
1 . 分类是认识和研究物质及其变化的一种常用的科学方法。下面是有关 的组成及可能发生的反应类型分析,请按要求回答问题。
的组成及可能发生的反应类型分析,请按要求回答问题。
(1) 按组成来看,其属于
按组成来看,其属于_____ (填物质的类别),利用 溶液配制
溶液配制 胶体的方法是:将蒸馏水煮至沸腾,再滴5~6滴
胶体的方法是:将蒸馏水煮至沸腾,再滴5~6滴_____ ,继续煮沸至液体呈_____ ,停止加热。
(2)向 溶液中加少量
溶液中加少量 固体,溶液的导电能力变化情况是
固体,溶液的导电能力变化情况是_____ (填“变大”“变小”或“基本不变”);向 溶液中逐滴滴加NaOH溶液,发生的离子反应方程式为
溶液中逐滴滴加NaOH溶液,发生的离子反应方程式为_____ 。
(3)向 溶液中加次氯酸钠和氢氧化钠的混合溶液,可制得一种新型的绿色消毒剂高铁酸钠(
溶液中加次氯酸钠和氢氧化钠的混合溶液,可制得一种新型的绿色消毒剂高铁酸钠( )。
)。
① 中Fe的化合价为
中Fe的化合价为_____ ;
②该反应中氧化剂的化学式为_____ ;
③完成下列离子方程式的配平:_____ 。

 的组成及可能发生的反应类型分析,请按要求回答问题。
的组成及可能发生的反应类型分析,请按要求回答问题。(1)
 按组成来看,其属于
按组成来看,其属于 溶液配制
溶液配制 胶体的方法是:将蒸馏水煮至沸腾,再滴5~6滴
胶体的方法是:将蒸馏水煮至沸腾,再滴5~6滴(2)向
 溶液中加少量
溶液中加少量 固体,溶液的导电能力变化情况是
固体,溶液的导电能力变化情况是 溶液中逐滴滴加NaOH溶液,发生的离子反应方程式为
溶液中逐滴滴加NaOH溶液,发生的离子反应方程式为(3)向
 溶液中加次氯酸钠和氢氧化钠的混合溶液,可制得一种新型的绿色消毒剂高铁酸钠(
溶液中加次氯酸钠和氢氧化钠的混合溶液,可制得一种新型的绿色消毒剂高铁酸钠( )。
)。①
 中Fe的化合价为
中Fe的化合价为②该反应中氧化剂的化学式为
③完成下列离子方程式的配平:

您最近一年使用:0次
名校
解题方法
2 . 高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示:

【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1)高铁酸钾(K2FeO4)属于___________ (填“酸”“碱”“盐”或“氧化物”),其中铁的化合价为___________ 价。
(2)过程①中活细菌表现了___________ (填“氧化”或“还原”)性,该过程的还原产物是___________ (填离子符号)。
(3)净水利用了Fe(OH)3胶体的聚沉作用。现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学向饱和FeCl3溶液中加入少量NaOH溶液;
乙同学直接加热饱和FeCl3溶液;
丙同学向25mL沸水中逐滴加入几滴FeCl3饱和溶液,煮沸至液体呈红褐色,停止加热。
操作正确的同学是___________ 。取部分Fe(OH)3胶体于试管中并向其中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为___________ ;继续滴加,沉淀减少最终消失,写出化学反应方程式:___________ 。
(4)根据上述原理分析,作水处理剂时,K2FeO4的作用有___________ 。
(5)制备高铁酸钾常用的反应原理为Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。配平该反应的化学方程式:___________ 。
_______Fe(OH)3+______KOH+______KClO=______K2FeO4+______KCl+______H2O

【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1)高铁酸钾(K2FeO4)属于
(2)过程①中活细菌表现了
(3)净水利用了Fe(OH)3胶体的聚沉作用。现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学向饱和FeCl3溶液中加入少量NaOH溶液;
乙同学直接加热饱和FeCl3溶液;
丙同学向25mL沸水中逐滴加入几滴FeCl3饱和溶液,煮沸至液体呈红褐色,停止加热。
操作正确的同学是
(4)根据上述原理分析,作水处理剂时,K2FeO4的作用有
(5)制备高铁酸钾常用的反应原理为Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。配平该反应的化学方程式:
_______Fe(OH)3+______KOH+______KClO=______K2FeO4+______KCl+______H2O
您最近一年使用:0次
名校
3 . 在稀盐酸中, 会与
会与 反应生成一种无色气体
反应生成一种无色气体 ,气体
,气体 对该反应有催化作用,其催化反应过程如图所示:
对该反应有催化作用,其催化反应过程如图所示:

(1)反应过程Ⅱ中,铁元素的化合价未发生变化,则 的化学式为
的化学式为___________ 过程Ⅱ的离子方程式为___________ ,是否是氧化还原反应___________ 。
(2)根据图示信息,写出反应过程I的离子方程式:___________ 。
(3)写出在酸性条件下, 氧化
氧化 的离子方程式:
的离子方程式:___________ 。
 会与
会与 反应生成一种无色气体
反应生成一种无色气体 ,气体
,气体 对该反应有催化作用,其催化反应过程如图所示:
对该反应有催化作用,其催化反应过程如图所示:
(1)反应过程Ⅱ中,铁元素的化合价未发生变化,则
 的化学式为
的化学式为(2)根据图示信息,写出反应过程I的离子方程式:
(3)写出在酸性条件下,
 氧化
氧化 的离子方程式:
的离子方程式:
您最近一年使用:0次
名校
4 . 对物质进行分类是研究物质性质的重要方法。现有如下几种物质:①氢气 ②氧气 ③氧化铜 ④稀盐酸 ⑤氯酸钾 ⑥烧碱 ⑦二氧化锰 ⑧氯化银 ⑨氢氧化铁胶体。回答下列问题:
(1)属于混合物的是_______ (填序号,下同),属于盐的是_______ 。
(2)相互间能发生化合反应的组合是_______ ,相互间能发生复分解反应的组合是_______ 。
(3)⑤在⑦存在下加热时发生反应的化学方程式为_______ ,⑦的作用是_______ 。
(4)⑤易溶于水,其在水溶液中的电离方程式为_______ 。
(5)按照交叉分类法判断,③⑦⑧属于同一类物质的标准是_______ (填字母)。
A.氧化物 B.黑色物质 C.难溶于水的化合物
(1)属于混合物的是
(2)相互间能发生化合反应的组合是
(3)⑤在⑦存在下加热时发生反应的化学方程式为
(4)⑤易溶于水,其在水溶液中的电离方程式为
(5)按照交叉分类法判断,③⑦⑧属于同一类物质的标准是
A.氧化物 B.黑色物质 C.难溶于水的化合物
您最近一年使用:0次
名校
5 . 回答下列问题
(1)平常我们食用的水果中含有丰富的维生素C,维生素C又被称为“抗坏血酸”,在人体内有重要的功能,例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有___________ (填“氧化性”或“还原性”)。
(2)工业废水中含有的重铬酸根离子(Cr2O )有毒,必需处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2+ + Cr2O
)有毒,必需处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2+ + Cr2O + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O,在该反应中,还原剂是
+ 14H+ = 6Fe3+ + 2Cr3+ + 7H2O,在该反应中,还原剂是___________ (填离子符号,下同),氧化剂是___________ 。
(3)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S + 2KNO3 + 3C = K2S + N2↑+ 3CO2↑,在该反应中,还原剂是___________ (填化学式,下同),氧化剂是___________ 。
(4)在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石烙化成团。冷定毁罐取出。……即倭铅也。……以其似铅而性猛,故名之曰‘倭’云。”(注:炉甘石的主要成分是碳酸锌。)
①请完成上述火法炼锌反应的化学方程式:________
ZnCO3 +___________ = ___________ +___________ CO↑。
②在该反应中,还原剂是___________ (填化学式,下同),被还原的是___________ 。
(1)平常我们食用的水果中含有丰富的维生素C,维生素C又被称为“抗坏血酸”,在人体内有重要的功能,例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有
(2)工业废水中含有的重铬酸根离子(Cr2O
 )有毒,必需处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2+ + Cr2O
)有毒,必需处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2+ + Cr2O + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O,在该反应中,还原剂是
+ 14H+ = 6Fe3+ + 2Cr3+ + 7H2O,在该反应中,还原剂是(3)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S + 2KNO3 + 3C = K2S + N2↑+ 3CO2↑,在该反应中,还原剂是
(4)在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石烙化成团。冷定毁罐取出。……即倭铅也。……以其似铅而性猛,故名之曰‘倭’云。”(注:炉甘石的主要成分是碳酸锌。)
①请完成上述火法炼锌反应的化学方程式:
ZnCO3 +___________ = ___________ +___________ CO↑。
②在该反应中,还原剂是
您最近一年使用:0次
名校
解题方法
6 . 氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。请结合相关化学知识回答下列问题:
(1)下列应用或过程不涉及氧化还原反应的是___________(填标号)。
(2)黑火药由硫黄、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+2KNO3+3C K2S+N2↑+3CO2↑,反应中被还原的物质是
K2S+N2↑+3CO2↑,反应中被还原的物质是___________ (填化学式)。
(3)NaH可在野外作生氢剂,反应原理为NaH+H2O=NaOH+H2↑,该反应中氧化产物和还原产物的质量比为___________ 。
(4)在汽车的排气管上装一个催化转化器,可有效降低氮氧化物的排放,其中一个反应为2CO+2NO N2+2CO2.用单线桥法表示出电子转移的方向和数目:
N2+2CO2.用单线桥法表示出电子转移的方向和数目:___________ 。
(5)工业废水中的 有毒,常在酸性条件下用Fe2+做处理剂,将
有毒,常在酸性条件下用Fe2+做处理剂,将 还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为
还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为___________ 。
(1)下列应用或过程不涉及氧化还原反应的是___________(填标号)。
| A.燃料的燃烧 | B.金属的冶炼 |
| C.钢铁的锈蚀 | D.钟乳石的形成 |
 K2S+N2↑+3CO2↑,反应中被还原的物质是
K2S+N2↑+3CO2↑,反应中被还原的物质是(3)NaH可在野外作生氢剂,反应原理为NaH+H2O=NaOH+H2↑,该反应中氧化产物和还原产物的质量比为
(4)在汽车的排气管上装一个催化转化器,可有效降低氮氧化物的排放,其中一个反应为2CO+2NO
 N2+2CO2.用单线桥法表示出电子转移的方向和数目:
N2+2CO2.用单线桥法表示出电子转移的方向和数目:(5)工业废水中的
 有毒,常在酸性条件下用Fe2+做处理剂,将
有毒,常在酸性条件下用Fe2+做处理剂,将 还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为
还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为
您最近一年使用:0次
名校
7 . Ⅰ.氧化还原反应与离子反应在生产生活与科学实验中有重要作用,回答问题。过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A. B.
B.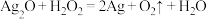
C. D.
D.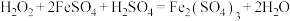
(1)上述反应中, 仅体现氧化性的反应是
仅体现氧化性的反应是___________ (填字母序号,下同), 既体现氧化性又体现还原性的反应是
既体现氧化性又体现还原性的反应是___________ , 、
、 、
、 的氧化性由强到弱的顺序是
的氧化性由强到弱的顺序是___________ 。
(2)某酸性溶液中发生的离子反应,反应物和生成物共六种微粒: 、
、 、
、 、
、 、
、 、
、 ,已知:氧化性
,已知:氧化性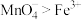 ,则反应的离子方程式为
,则反应的离子方程式为___________ 。
Ⅱ. 和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为 (浓)
(浓)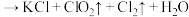 (未配平)
(未配平)
(3)氧化剂是___________ 氧化产物是___________
(4)产生1个 ,转移的电子的个数为
,转移的电子的个数为___________ 个
(5)某反应体系有反应物和生成物共五种物质: 、
、 、
、 (不溶于水)、
(不溶于水)、 、
、 ,已知该反应中
,已知该反应中 只发生如下过程
只发生如下过程 ,写出该反应的化学方程式:
,写出该反应的化学方程式:___________ 。
A.
 B.
B.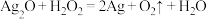
C.
 D.
D.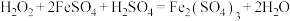
(1)上述反应中,
 仅体现氧化性的反应是
仅体现氧化性的反应是 既体现氧化性又体现还原性的反应是
既体现氧化性又体现还原性的反应是 、
、 、
、 的氧化性由强到弱的顺序是
的氧化性由强到弱的顺序是(2)某酸性溶液中发生的离子反应,反应物和生成物共六种微粒:
 、
、 、
、 、
、 、
、 、
、 ,已知:氧化性
,已知:氧化性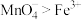 ,则反应的离子方程式为
,则反应的离子方程式为Ⅱ.
 和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为 (浓)
(浓)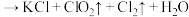 (未配平)
(未配平)(3)氧化剂是
(4)产生1个
 ,转移的电子的个数为
,转移的电子的个数为(5)某反应体系有反应物和生成物共五种物质:
 、
、 、
、 (不溶于水)、
(不溶于水)、 、
、 ,已知该反应中
,已知该反应中 只发生如下过程
只发生如下过程 ,写出该反应的化学方程式:
,写出该反应的化学方程式:
您最近一年使用:0次
名校
8 . Ⅰ.完成下列问题
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是___________ 。
A. B.
B. C.
C.
(2)工业盐的主要成分是 ,曾多次发生过因误食
,曾多次发生过因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有___________ 性(填“氧化”或者“还原”)。下列不能实现上述转化的物质是___________ 。
A. B.
B. C.
C. D.
D.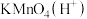
(3)在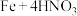 (稀)
(稀) 的反应中,若
的反应中,若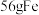 参加反应时,被还原的
参加反应时,被还原的 为
为___________ g。
Ⅱ.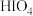 主要以
主要以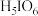 形式存在,
形式存在,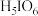 是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化
是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化 。
。
(4)请完成并配平下列离子反应。________
 ___________
___________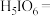 ___________
___________ ___________
___________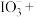 ___________
___________ ___________
___________
(5)根据以上离子方程式判断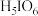 是
是___________ 酸(填“强”或“弱”)。
(6)上述反应,被氧化的元素是___________ (填元素符号)。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是
A.
 B.
B. C.
C.
(2)工业盐的主要成分是
 ,曾多次发生过因误食
,曾多次发生过因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有A.
 B.
B. C.
C. D.
D.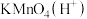
(3)在
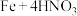 (稀)
(稀) 的反应中,若
的反应中,若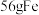 参加反应时,被还原的
参加反应时,被还原的 为
为Ⅱ.
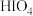 主要以
主要以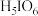 形式存在,
形式存在,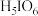 是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化
是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化 。
。(4)请完成并配平下列离子反应。
 ___________
___________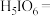 ___________
___________ ___________
___________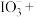 ___________
___________ ___________
___________(5)根据以上离子方程式判断
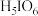 是
是(6)上述反应,被氧化的元素是
您最近一年使用:0次
名校
解题方法
9 . KClO3和浓盐酸在一定温度下反应生成黄绿色的易爆物二氧化氯.其变化可表述为 KClO3+
KClO3+ HCl(浓)=
HCl(浓)= KCl+
KCl+ ClO2↑+
ClO2↑+ Cl2↑+
Cl2↑+ ______。
______。
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)______ 。
(2)浓盐酸在反应中显示出来的性质是______ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生1分子Cl2,转移的电子为______ 个。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的______ 倍(保留小数点后两位)。
 KClO3+
KClO3+ HCl(浓)=
HCl(浓)= KCl+
KCl+ ClO2↑+
ClO2↑+ Cl2↑+
Cl2↑+ ______。
______。(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生1分子Cl2,转移的电子为
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的
您最近一年使用:0次
名校
解题方法
10 . 实验室制备Cl2有三种常用方法:
a.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
b. KMnO4+
KMnO4+ HCl(浓)=
HCl(浓)= KCl+
KCl+ MnCl2+
MnCl2+ Cl2↑+
Cl2↑+ H2O
H2O
c.KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(1)常温下,医用酒精、Cl2、KMnO4、MnCl2、浓盐酸中能导电的是______ ,属于混合物的是______ ,属于电解质的是______ 。
(2)写出反应c对应的离子方程式:______ [已知HCl(浓)可拆分为H+和Cl-]。
(3)配平反应b的方程式______ 。
(4)当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应______ (填“a”“b”或“c”,下同);当得到等质量的Cl2时,消耗HCl的质量最多的是反应______ 。
a.MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2Ob.
 KMnO4+
KMnO4+ HCl(浓)=
HCl(浓)= KCl+
KCl+ MnCl2+
MnCl2+ Cl2↑+
Cl2↑+ H2O
H2Oc.KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(1)常温下,医用酒精、Cl2、KMnO4、MnCl2、浓盐酸中能导电的是
(2)写出反应c对应的离子方程式:
(3)配平反应b的方程式
(4)当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应
您最近一年使用:0次



