名校
1 . 2022年1月,南太平洋岛国汤加境内发生了“21世纪至今最剧烈的火山喷发”,对该国造成了严重的破坏。火山喷发过程部分化学反应如下:
① ;
;
②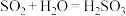 ;
;
③
(1)在上述方程式涉及的物质中,能与盐酸反应的氧化物有_______ (填化学式),属于酸的有_______ (填化学式)。
(2) 与
与 具有某些相似的化学性质,写出用NaOH溶液吸收
具有某些相似的化学性质,写出用NaOH溶液吸收 的化学方程式:
的化学方程式:_______ 。
(3) 是火山爆发过程中产生的酸性气体,属于二元弱酸,其饱和溶液的pH约为4。已知
是火山爆发过程中产生的酸性气体,属于二元弱酸,其饱和溶液的pH约为4。已知 称为正盐,
称为正盐, 称为酸式盐,写出
称为酸式盐,写出 的一种酸式盐的化学式:
的一种酸式盐的化学式:_______ 。
(4)互为同素异形体的物质均为_______ (选填“化合物”或“单质”)。请列举一组互为同素异形体的物质:_______ 。
①
 ;
;②
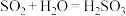 ;
;③

(1)在上述方程式涉及的物质中,能与盐酸反应的氧化物有
(2)
 与
与 具有某些相似的化学性质,写出用NaOH溶液吸收
具有某些相似的化学性质,写出用NaOH溶液吸收 的化学方程式:
的化学方程式:(3)
 是火山爆发过程中产生的酸性气体,属于二元弱酸,其饱和溶液的pH约为4。已知
是火山爆发过程中产生的酸性气体,属于二元弱酸,其饱和溶液的pH约为4。已知 称为正盐,
称为正盐, 称为酸式盐,写出
称为酸式盐,写出 的一种酸式盐的化学式:
的一种酸式盐的化学式:(4)互为同素异形体的物质均为
您最近一年使用:0次
名校
2 . I.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法表示上述反应中电子得失的方向和数目:_____
(2)氧化剂和还原剂的质量比为_______ 。硝酸体现的性质:_______ (填序号)
①只体现酸性 ② 只体现氧化性 ③既体现酸性又体现氧化性
II.已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列六种化合物:①NO;②N2O3;③N2O4;④HNO3;⑤NH3;⑥N2O中:
(3)从氮元素看只能作还原剂的是_______ (填序号,下同)。
(4)可能是HNO2还原产物的是_______ 。
(5)不可能是N2的氧化产物是_______ 。
(6)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式_______ 。
III.工业废水中含有的重铬酸根离子(Cr2O )有毒,必须处理达标后才能排放。工业上常用绿矾 FeSO4·7H2O)做处理剂,反应的离子方程式如下:_______Fe2++_______Cr2O
)有毒,必须处理达标后才能排放。工业上常用绿矾 FeSO4·7H2O)做处理剂,反应的离子方程式如下:_______Fe2++_______Cr2O +_______H+=_______Fe3++_______Cr3++_______H2O,
+_______H+=_______Fe3++_______Cr3++_______H2O,
(7)配平该离子方程式,填上计量系数______
(8)在该反应中氧化剂是_______ (填离子符号)
(1)用双线桥法表示上述反应中电子得失的方向和数目:
(2)氧化剂和还原剂的质量比为
①只体现酸性 ② 只体现氧化性 ③既体现酸性又体现氧化性
II.已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列六种化合物:①NO;②N2O3;③N2O4;④HNO3;⑤NH3;⑥N2O中:
(3)从氮元素看只能作还原剂的是
(4)可能是HNO2还原产物的是
(5)不可能是N2的氧化产物是
(6)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式
III.工业废水中含有的重铬酸根离子(Cr2O
 )有毒,必须处理达标后才能排放。工业上常用绿矾 FeSO4·7H2O)做处理剂,反应的离子方程式如下:_______Fe2++_______Cr2O
)有毒,必须处理达标后才能排放。工业上常用绿矾 FeSO4·7H2O)做处理剂,反应的离子方程式如下:_______Fe2++_______Cr2O +_______H+=_______Fe3++_______Cr3++_______H2O,
+_______H+=_______Fe3++_______Cr3++_______H2O,(7)配平该离子方程式,填上计量系数
(8)在该反应中氧化剂是
您最近一年使用:0次
名校
3 . 铜是生物必需的微量元素,也是人类最早使用的金属之一、铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式___________ 。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式___________ 。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2,该反应的氧化剂是
6Cu+SO2,该反应的氧化剂是___________ ;当生成19.2gCu时,反应中转移的电子为___________ mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜),试写出上述过程中负极的电极反应式___________ 。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成,写出该反应的离子方程式___________ 。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。则试样中CuSO4·5H 2O的质量分数为___________ 。
(1)写出铜与稀硝酸反应的化学方程式
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2,该反应的氧化剂是
6Cu+SO2,该反应的氧化剂是(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜),试写出上述过程中负极的电极反应式
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
您最近一年使用:0次
解题方法
4 . 在工业上次磷酸(H3PO2)常用于化学镀银,发生的反应如下:____Ag++____H3PO2____H2O→____Ag↓+____H3PO4+____H+。
(1)H3PO2中,P元素的化合价为______ ,该反应中的氧化剂为_____ 。
(2)次磷酸H3PO2能与足量的NaOH反应生成NaH2PO2,则从酸的元数分类来看,次磷酸属于____ 酸。(填“一元”、“二元”或“三元”)
(3)配平并书写该离子方程式:____ 。
(4)用双线桥法标出(3)中氧化还原反应的电子转移情况____ 。
(5)该条件下,氧化性强弱Ag+____ H3PO4(填“>”或“<”)。
(6)一定浓度的CuSO4溶液也能将次磷酸氧化为H3PO4,自身被还原为单质,试写出该反应的离子方程式_____ 。
(1)H3PO2中,P元素的化合价为
(2)次磷酸H3PO2能与足量的NaOH反应生成NaH2PO2,则从酸的元数分类来看,次磷酸属于
(3)配平并书写该离子方程式:
(4)用双线桥法标出(3)中氧化还原反应的电子转移情况
(5)该条件下,氧化性强弱Ag+
(6)一定浓度的CuSO4溶液也能将次磷酸氧化为H3PO4,自身被还原为单质,试写出该反应的离子方程式
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是____ ,又变为棕黄色的原因是____ (用离子方程式解释)。
(2)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。写出SO2吸收Br2反应的化学方程式为____ 。
(3)氮氧化物的治理是当前生态环境保护中的重要课题之一。从原理上看,NH3可用于治理NO2,该反应在催化剂条件下可实现,写出化学方程式____ 。
(4)一种新型催化剂能使NO和CO发生反应2NO+2CO 2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
①上述实验中a=_____ ,b=_____ 。
②上述实验中,能验证温度对化学反应速率影响规律的一组实验是_____ (填实验编号)。
(1)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是
(2)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。写出SO2吸收Br2反应的化学方程式为
(3)氮氧化物的治理是当前生态环境保护中的重要课题之一。从原理上看,NH3可用于治理NO2,该反应在催化剂条件下可实现,写出化学方程式
(4)一种新型催化剂能使NO和CO发生反应2NO+2CO
 2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:| 试验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 280 | 1.20×10-3 | b | 124 |
| III | 350 | a | 5.80×10-3 | 82 |
②上述实验中,能验证温度对化学反应速率影响规律的一组实验是
您最近一年使用:0次
名校
解题方法
6 . 以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(如图)。70℃下通过满液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是_______ ;MnO2转化为Mn2+的离子方程式为_______ 。

(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清夜中c(F-)=0.05mol/L,则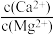 =
=_____ [Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3.在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为_______ 。
(4)制备MnO2,MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(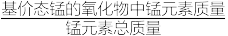 ×100%)随热解温度变化的曲线如图所示。
×100%)随热解温度变化的曲线如图所示。
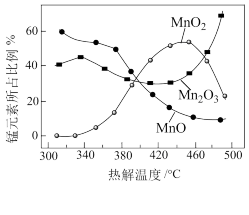
已知:MnO2与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,加热到_______ 。将固体冷却后研成粉末,边搅摔边加入一定量_______ ,_______ ,充分反应后过滤,洗涤,_______ 。固体干燥,得到MnO2(可选用的试剂:1mol/LH2SO4溶液、2mol/LHCl溶液、0.1mo/LBaCl2溶液、0.1mol/LAgNO3溶液)。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(如图)。70℃下通过满液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是

(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清夜中c(F-)=0.05mol/L,则
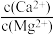 =
=(3)制备MnCO3.在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为
(4)制备MnO2,MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(
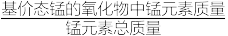 ×100%)随热解温度变化的曲线如图所示。
×100%)随热解温度变化的曲线如图所示。
已知:MnO2与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,加热到
您最近一年使用:0次
2022-10-11更新
|
233次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题
名校
解题方法
7 . 氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为:_______ 。
(2)工业生产中为了储运大量浓硝酸,最好选择_______作为罐体材料。
(3)与氮氧化物有关的全球或区域性大气环境问题有_______ (填字母序号)。
(4)人们开发了溶液吸收、催化还原等尾气处理方法。请以尾气中的NO2处理为例,写出相关反应的化学方程式:纯碱溶液吸收法:(提示:NO2与纯碱溶液反应可发生歧化生成两种盐) _______
(5)氮及其化合物在催化剂a和催化剂b转化过程如图所示,下列分析合理的是_______ 。

A.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
B.N2与H2反应属于氮的固定过程
C.在催化剂b表面形成氮氧键时不涉及电子转移
(6)某兴趣小组对反应2NH3(g) N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_______ mol·L-1·min-1(用含t1的代数式表示);
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是_______ (用图中a、b、c、d表示)。

(1)合成塔中发生反应的化学方程式为:
(2)工业生产中为了储运大量浓硝酸,最好选择_______作为罐体材料。
| A.铜 | B.铂 | C.铝 | D.镁 |
| A.酸雨 | B.沙尘暴 | C.光化学烟雾 | D.白色污染 |
(5)氮及其化合物在催化剂a和催化剂b转化过程如图所示,下列分析合理的是

A.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
B.N2与H2反应属于氮的固定过程
C.在催化剂b表面形成氮氧键时不涉及电子转移
(6)某兴趣小组对反应2NH3(g)
 N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
您最近一年使用:0次
8 . 镁及其化合物在现代工业、国防建设中有着广泛的应用。回答下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的___________ ,还生成少量的___________ (填化学式)。
(2)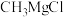 是一种重要的有机合成剂,其中镁的化合价为
是一种重要的有机合成剂,其中镁的化合价为___________ ,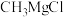 水解时除生成甲烷外,还生成一种碱和一种盐。写出该反应的化学方程式:
水解时除生成甲烷外,还生成一种碱和一种盐。写出该反应的化学方程式:___________ 。
(3)现有一块 合金,将其置于烧杯中。若加入
合金,将其置于烧杯中。若加入 溶液,恰好完全反应生成
溶液,恰好完全反应生成 。若加入
。若加入 少量盐酸,则生成
少量盐酸,则生成 。计算
。计算
___________  。
。
(4) 是常用的阻燃材料。以白云石(
是常用的阻燃材料。以白云石( ,不考虑杂质)为原料制备
,不考虑杂质)为原料制备 和
和 工艺流程如下:
工艺流程如下:

①相同条件下,溶解度:
___________ (填“>”或“<”) 。
。
②“煅烧”时称取 白云石,高温加热到质量不再变化,收集到的
白云石,高温加热到质量不再变化,收集到的 为
为 (标准状况下),若工艺中不考虑
(标准状况下),若工艺中不考虑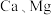 损失,则
损失,则 和
和 的质量分别为
的质量分别为___________ 、___________ 。
(1)单质镁在空气中燃烧的主要产物是白色的
(2)
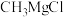 是一种重要的有机合成剂,其中镁的化合价为
是一种重要的有机合成剂,其中镁的化合价为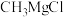 水解时除生成甲烷外,还生成一种碱和一种盐。写出该反应的化学方程式:
水解时除生成甲烷外,还生成一种碱和一种盐。写出该反应的化学方程式:(3)现有一块
 合金,将其置于烧杯中。若加入
合金,将其置于烧杯中。若加入 溶液,恰好完全反应生成
溶液,恰好完全反应生成 。若加入
。若加入 少量盐酸,则生成
少量盐酸,则生成 。计算
。计算
 。
。(4)
 是常用的阻燃材料。以白云石(
是常用的阻燃材料。以白云石( ,不考虑杂质)为原料制备
,不考虑杂质)为原料制备 和
和 工艺流程如下:
工艺流程如下:
①相同条件下,溶解度:

 。
。②“煅烧”时称取
 白云石,高温加热到质量不再变化,收集到的
白云石,高温加热到质量不再变化,收集到的 为
为 (标准状况下),若工艺中不考虑
(标准状况下),若工艺中不考虑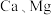 损失,则
损失,则 和
和 的质量分别为
的质量分别为
您最近一年使用:0次
2022-10-06更新
|
89次组卷
|
2卷引用:湖南省邵阳市部分校2022-2023学年高三上学期第一次联考化学试题
9 . I.储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4) 3+8H2O。请回答下列问题:
(1)用双线桥法标明上述反应方程式中电子转移的方向和数目___________ 。
3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4) 3+8H2O。
(2)上述反应中氧化剂是___________ ,被氧化的元素是___________ (填元素符号) 。
(3)H2SO4在上述反应中表现出来的性质是___________(填标号)。
(4)请配平下列离子方程式___________ 。
___________Fe2++___________H++___________ =___________Fe3++___________N2O↑+___________H2O
=___________Fe3++___________N2O↑+___________H2O
II.已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列六种化合物:①NO;②N2O3;③N2O4;④HNO3;⑤NH3;⑥N2O中:
(5)氮元素只能作还原剂的是___________ (填序号,下同)。
(6)可能是HNO2还原产物的是___________ 。
(7)不可能是N2的氧化产物是___________ 。
(8)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式___________ 。
(1)用双线桥法标明上述反应方程式中电子转移的方向和数目
3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4) 3+8H2O。
(2)上述反应中氧化剂是
(3)H2SO4在上述反应中表现出来的性质是___________(填标号)。
| A.酸性 | B.氧化性 | C.氧化性和酸性 | D.还原性和酸性 |
___________Fe2++___________H++___________
 =___________Fe3++___________N2O↑+___________H2O
=___________Fe3++___________N2O↑+___________H2OII.已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列六种化合物:①NO;②N2O3;③N2O4;④HNO3;⑤NH3;⑥N2O中:
(5)氮元素只能作还原剂的是
(6)可能是HNO2还原产物的是
(7)不可能是N2的氧化产物是
(8)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式
您最近一年使用:0次
解题方法
10 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_______ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_______ 。
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:_______ 。
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2.取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:_______ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2.取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:
您最近一年使用:0次



