1 . Ⅰ.次磷酸( )常用于化学镀银,反应为:
)常用于化学镀银,反应为: 。请回答下列问题:
。请回答下列问题:
(1) 中,P元素的化合价为
中,P元素的化合价为___________ ;该反应中,氧化产物是___________ 。
(2)配平该离子方程式:___________ 。
(3) 是一元弱酸,写出其与足量NaOH溶液反应的化学方程式:
是一元弱酸,写出其与足量NaOH溶液反应的化学方程式:___________ 。
(4)若该反应消耗 ,则镀件镀上银的质量为
,则镀件镀上银的质量为___________ g。
Ⅱ.酸性高锰酸钾溶液常用于物质的定性检验与定量分析。现用酸性高锰酸钾溶液测定某补血剂中亚铁的含量:称取含的补血剂a克,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与cmol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。上述过程发生反应的化学方程式为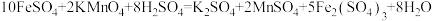 。
。
(5)该补血剂中 的质量分数为
的质量分数为___________ (用含a、c的代数式表示)。
 )常用于化学镀银,反应为:
)常用于化学镀银,反应为: 。请回答下列问题:
。请回答下列问题:(1)
 中,P元素的化合价为
中,P元素的化合价为(2)配平该离子方程式:
(3)
 是一元弱酸,写出其与足量NaOH溶液反应的化学方程式:
是一元弱酸,写出其与足量NaOH溶液反应的化学方程式:(4)若该反应消耗
 ,则镀件镀上银的质量为
,则镀件镀上银的质量为Ⅱ.酸性高锰酸钾溶液常用于物质的定性检验与定量分析。现用酸性高锰酸钾溶液测定某补血剂中亚铁的含量:称取含的补血剂a克,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与cmol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。上述过程发生反应的化学方程式为
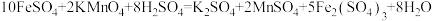 。
。(5)该补血剂中
 的质量分数为
的质量分数为
您最近一年使用:0次
2 . 重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
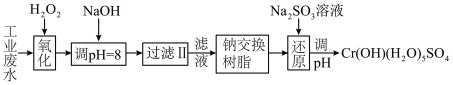
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
(1)氧化过程中可代替H2O2加入的试剂是________ 。(填序号)
(2)已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子_________ (填序号)
(3)常温下,Cr(OH)3的溶度积Ksp=1.0×10-32溶液中pH应为________ 时Cr3+恰好完全沉淀,则还原过程中的离子方程式________________________ (已知在氧化过程中Cr3+转化为 )。
)。
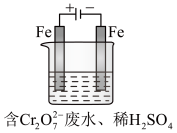
(Ⅱ)酸性条件下,铬元素主要以 形式存在,工业上常用电解法处理含
形式存在,工业上常用电解法处理含 的废水。实验室利用如图装置模拟处理该废水,阳极反应是
的废水。实验室利用如图装置模拟处理该废水,阳极反应是 ,阴极反应式是
,阴极反应式是 。
。
(1)电解时能否用Cu电极来代替Fe电极?________ (填“能”或“不能”)
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为________________________________ 。
(3)若溶液中初始含有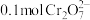 ,则生成的阳离子全部转化成沉淀的质量是
,则生成的阳离子全部转化成沉淀的质量是________ g。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 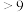 溶解 溶解 |
(1)氧化过程中可代替H2O2加入的试剂是
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)常温下,Cr(OH)3的溶度积Ksp=1.0×10-32溶液中pH应为
 )。
)。(Ⅱ)酸性条件下,铬元素主要以
 形式存在,工业上常用电解法处理含
形式存在,工业上常用电解法处理含 的废水。实验室利用如图装置模拟处理该废水,阳极反应是
的废水。实验室利用如图装置模拟处理该废水,阳极反应是 ,阴极反应式是
,阴极反应式是 。
。(1)电解时能否用Cu电极来代替Fe电极?
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为
(3)若溶液中初始含有
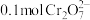 ,则生成的阳离子全部转化成沉淀的质量是
,则生成的阳离子全部转化成沉淀的质量是
您最近一年使用:0次
名校
解题方法
3 . 2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢(HCN)气体。氰化氢的沸点只有26 ℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题:
(1)写出氰化钠遇水产生氰化氢气体的离子方程式_________________________
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式________________________________ 。
(3)爆炸残留在废水中的CN-可以用Cr2O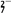 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
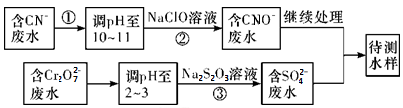
①上述处理废水流程中主要使用的方法是____________
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为_________________ ;
③步骤③中,每处理0.4 mol Cr2O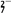 时转移电子2.4 mol,该反应的离子方程式
时转移电子2.4 mol,该反应的离子方程式_________ ;
(1)写出氰化钠遇水产生氰化氢气体的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式
(3)爆炸残留在废水中的CN-可以用Cr2O
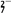 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
①上述处理废水流程中主要使用的方法是
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为
③步骤③中,每处理0.4 mol Cr2O
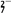 时转移电子2.4 mol,该反应的离子方程式
时转移电子2.4 mol,该反应的离子方程式
您最近一年使用:0次
2017-12-13更新
|
623次组卷
|
2卷引用:湖南省浏阳一中、醴陵一中、南方中学2017-2018学年高二12月联考化学试题



