重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
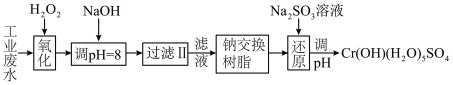
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
(1)氧化过程中可代替H2O2加入的试剂是________ 。(填序号)
(2)已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子_________ (填序号)
(3)常温下,Cr(OH)3的溶度积Ksp=1.0×10-32溶液中pH应为________ 时Cr3+恰好完全沉淀,则还原过程中的离子方程式________________________ (已知在氧化过程中Cr3+转化为 )。
)。
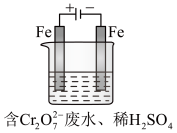
(Ⅱ)酸性条件下,铬元素主要以 形式存在,工业上常用电解法处理含
形式存在,工业上常用电解法处理含 的废水。实验室利用如图装置模拟处理该废水,阳极反应是
的废水。实验室利用如图装置模拟处理该废水,阳极反应是 ,阴极反应式是
,阴极反应式是 。
。
(1)电解时能否用Cu电极来代替Fe电极?________ (填“能”或“不能”)
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为________________________________ 。
(3)若溶液中初始含有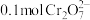 ,则生成的阳离子全部转化成沉淀的质量是
,则生成的阳离子全部转化成沉淀的质量是________ g。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 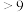 溶解 溶解 |
(1)氧化过程中可代替H2O2加入的试剂是
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)常温下,Cr(OH)3的溶度积Ksp=1.0×10-32溶液中pH应为
 )。
)。(Ⅱ)酸性条件下,铬元素主要以
 形式存在,工业上常用电解法处理含
形式存在,工业上常用电解法处理含 的废水。实验室利用如图装置模拟处理该废水,阳极反应是
的废水。实验室利用如图装置模拟处理该废水,阳极反应是 ,阴极反应式是
,阴极反应式是 。
。(1)电解时能否用Cu电极来代替Fe电极?
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为
(3)若溶液中初始含有
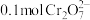 ,则生成的阳离子全部转化成沉淀的质量是
,则生成的阳离子全部转化成沉淀的质量是
更新时间:2021-01-21 06:52:01
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】按要求完成下列各题内容:
(1)写出下列物质的电子式或结构式:
①CO2的电子式:___________ 。
②CH4的结构式:___________ 。
(2)写出下列符合要求的方程式:
①焦炭还原石英砂制粗硅的化学方程式:___________ 。
②用FeCl3溶液作为为“腐蚀液”制造印刷电路板的离子方程式:___________ 。
③用绿矾将酸性溶液中的重铬酸根( )还原为Cr3+的离子方程式
)还原为Cr3+的离子方程式___________ 。
(1)写出下列物质的电子式或结构式:
①CO2的电子式:
②CH4的结构式:
(2)写出下列符合要求的方程式:
①焦炭还原石英砂制粗硅的化学方程式:
②用FeCl3溶液作为为“腐蚀液”制造印刷电路板的离子方程式:
③用绿矾将酸性溶液中的重铬酸根(
 )还原为Cr3+的离子方程式
)还原为Cr3+的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】铝工业产生的硫酸盐溶液经喷雾干燥后得到以硫酸铝为主的固体,硫酸铝的利用成为资源综合利用的一个重要项目。
(1)室温下配制一定浓度的酸性硫酸铝溶液,通过加入CaCO3粉末调节硫酸铝溶液的pH,可制得可溶性的碱式硫酸铝[Ala(OH)b(SO4)c],用于烟气脱硫,碱式硫酸铝中b值的大小影响其脱硫效率。制备碱式硫酸铝溶液时,可以提高b值的措施有_____ (写出一条合理措施即可)
(2)在还原气氛下硫酸铝固体分解得到的活性Al2O3可作为工业催化剂载体。在H2还原气氛下,硫酸铝的分解常温就能进行。这是由于在还原气氛中易生成中间产物Al2S3,随即再与Al2(SO4)3反应得到Al2O3。则Al2(SO4)3与H2反应生成Al2S3的化学方程式为________ 。
(3)将10.00 g Al2(SO4)3·n H2O放入坩埚内,在氩气气氛中灼烧。在热分解过程中,热重分析仪记录数据如下(已去除坩埚的质量):
①温度达1 393 K后固体质量不再变化,经分析固体成分为γ-Al2O3和无定型Al2O3结构的微晶。则Al2(SO4)3·nH2O中的n值为________ 。
②求523 K时固体成分的化学式(请写出计算过程)。__________
(1)室温下配制一定浓度的酸性硫酸铝溶液,通过加入CaCO3粉末调节硫酸铝溶液的pH,可制得可溶性的碱式硫酸铝[Ala(OH)b(SO4)c],用于烟气脱硫,碱式硫酸铝中b值的大小影响其脱硫效率。制备碱式硫酸铝溶液时,可以提高b值的措施有
(2)在还原气氛下硫酸铝固体分解得到的活性Al2O3可作为工业催化剂载体。在H2还原气氛下,硫酸铝的分解常温就能进行。这是由于在还原气氛中易生成中间产物Al2S3,随即再与Al2(SO4)3反应得到Al2O3。则Al2(SO4)3与H2反应生成Al2S3的化学方程式为
(3)将10.00 g Al2(SO4)3·n H2O放入坩埚内,在氩气气氛中灼烧。在热分解过程中,热重分析仪记录数据如下(已去除坩埚的质量):
| 温度 | 298 K | 523 K | 687 K | 1 393 K |
| 固体质量 | 10.00 g | 5.94 g | 5.14 g | 1.53 g |
①温度达1 393 K后固体质量不再变化,经分析固体成分为γ-Al2O3和无定型Al2O3结构的微晶。则Al2(SO4)3·nH2O中的n值为
②求523 K时固体成分的化学式(请写出计算过程)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】I.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料,可以氨气为原料,经一系列反应制得。
NH3 NO
NO NO2
NO2 HNO3。
HNO3。
(1)实验室可用加热浓氨水制备NH3,该反应的化学方程式为____ 。
(2)NH3与O2催化氧化反应中会得到副产物N2O,写出NH3与O2在加热和催化剂作用下生成N2O的化学方程式:____ 。
(3)NO2通入水中制备硝酸时,通常会通入适量的氧气,目的是___ 。
(4)工业生产中为了盛装大量浓硝酸,可选择___ 作为罐体材料。
(5)将12.8gCu与200mL一定浓度的硝酸反应,铜完全溶解,产生的混合气体(设产生的气体只有NO和NO2)在标准状况下的体积为4.48L,待产生的气体全部释放后,向溶液中加入100mL5mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子全部转化成沉淀,原硝酸溶液的物质的量浓度为____ mol·L-1。
II.硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸作原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:Cu→CuO→CuSO4
(6)方案甲中,铜和浓硫酸发生反应的化学方程式是____ 。
(7)这两种方案,你认为哪一种方案更合理?____ 。理由是____ 。
NH3
 NO
NO NO2
NO2 HNO3。
HNO3。(1)实验室可用加热浓氨水制备NH3,该反应的化学方程式为
(2)NH3与O2催化氧化反应中会得到副产物N2O,写出NH3与O2在加热和催化剂作用下生成N2O的化学方程式:
(3)NO2通入水中制备硝酸时,通常会通入适量的氧气,目的是
(4)工业生产中为了盛装大量浓硝酸,可选择
| A.铜 | B.铂 | C.铝 | D.镁 |
II.硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸作原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:Cu→CuO→CuSO4
(6)方案甲中,铜和浓硫酸发生反应的化学方程式是
(7)这两种方案,你认为哪一种方案更合理?
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)“84”消毒液是一种以NaClO为主要成分的高效消毒剂,NaClO溶液呈______ 性(填“酸”“碱”或“中”),原因可用离子方程式表示为_______ 。
(2)25℃时,pH均为3的醋酸和硫酸铝两种溶液中,由水电离出的c(H+)之比为______ 。该温度下,若pH=a的100体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则a+b=______ 。
(3)向浓度均为0.1mol•L-1的CdCl2和ZnCl2混合液中滴加碳酸铵溶液至生成两种沉淀,则溶液中c(Zn2+):c(Cd2+)=______ 。[已知:Ksp(CdCO3)=1.0×10-12、Ksp(ZnCO3)=1.5×10-10]
(4)相同条件下,0.1mol•L-1下列溶液中,c(NH )由小到大的排列顺序是
)由小到大的排列顺序是______ (填序号)。
A.(NH4)2SO4 B.(NH4)2CO3 C.NH4Cl D.NH4HSO4 E.NH3•H2O
(1)“84”消毒液是一种以NaClO为主要成分的高效消毒剂,NaClO溶液呈
(2)25℃时,pH均为3的醋酸和硫酸铝两种溶液中,由水电离出的c(H+)之比为
(3)向浓度均为0.1mol•L-1的CdCl2和ZnCl2混合液中滴加碳酸铵溶液至生成两种沉淀,则溶液中c(Zn2+):c(Cd2+)=
(4)相同条件下,0.1mol•L-1下列溶液中,c(NH
 )由小到大的排列顺序是
)由小到大的排列顺序是A.(NH4)2SO4 B.(NH4)2CO3 C.NH4Cl D.NH4HSO4 E.NH3•H2O
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__ 。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离平衡常数Kb=__ 。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__ ,溶液中离子浓度大小关系为__ 。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=__ 。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__ 。(已知lg2=0.3)
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)25℃,某Na2SO4溶液中c( )=1×10-4 mol/L,则该溶液中c(Na+):c(OH-)=
)=1×10-4 mol/L,则该溶液中c(Na+):c(OH-)=_______ 。
(2)某温度下,测得0.01 mol·L-1的NaOH溶液的pH=11,该温度下,纯水的Kw=_______ 。
(3)25℃时,已知0.1 mol·L-1 CH3COONa溶液pH=8,
①试用离子方程式解释上述CH3COONa溶液pH=8的原因:_______ ;
②精确表达下列算式的数学结果:c(Na+)-c(CH3COO-)=_______ ;c(OH-)-c(CH3COOH)=_______ 。
(4)若向浓度均为0.1 mol/L的NaCl和NaI的混合液中逐渐加入AgNO3粉末,当溶液中I-浓度下降到_______ mol/L时,AgCl开始沉淀。已知:298 K时,Ksp(AgI)=8.5×10-17;Ksp(AgCl)=1.7×10-10。
(5)已知:H2A的 ,
, ;H2B的
;H2B的 ,
, 。
。
①写出向Na2A溶液中通入少量H2B气体发生反应的离子方程式:_______ 。
②NaHA溶液呈_______ (填“酸性”、“碱性”或“中性”)。
(1)25℃,某Na2SO4溶液中c(
 )=1×10-4 mol/L,则该溶液中c(Na+):c(OH-)=
)=1×10-4 mol/L,则该溶液中c(Na+):c(OH-)=(2)某温度下,测得0.01 mol·L-1的NaOH溶液的pH=11,该温度下,纯水的Kw=
(3)25℃时,已知0.1 mol·L-1 CH3COONa溶液pH=8,
①试用离子方程式解释上述CH3COONa溶液pH=8的原因:
②精确表达下列算式的数学结果:c(Na+)-c(CH3COO-)=
(4)若向浓度均为0.1 mol/L的NaCl和NaI的混合液中逐渐加入AgNO3粉末,当溶液中I-浓度下降到
(5)已知:H2A的
 ,
, ;H2B的
;H2B的 ,
, 。
。①写出向Na2A溶液中通入少量H2B气体发生反应的离子方程式:
②NaHA溶液呈
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】研究和开发海水及其综合利用关系到人类的可持续发展。甲、乙两实验小组分别探索从海水中制取金属镁和单质溴的实验。
(1)甲实验小组的流程如图1。
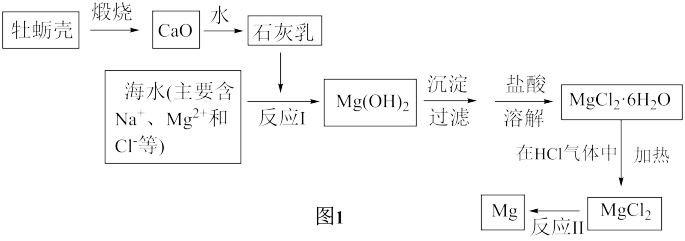
①制备石灰乳的化学反应方程式是___ 、___ 。
②写出反应Ⅰ的离子反应方程式___ 。
③反应Ⅱ是工业冶炼金属镁的反应原理,写出反应Ⅱ的化学反应方程式___ 。
(2)乙实验小组的流程如图2。

①分液漏斗使用前需检漏,检漏的方法为___ ,在步骤③中,萃取后分液漏斗内观察到的现象是___ 。
②写出步骤①发生反应的离子方程式___ ;写出步骤②发生反应的化学方程式___ 。
③在步骤③中,分离出溴单质的实验操作的名称是分液和___ ,后一实验操作用到的玻璃仪器有:___ 。
④在步骤①和步骤②之间设计了通入空气和水蒸气吹出的操作步骤的目的是___ 。
(3)图3各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为___ 。(填序号)

(1)甲实验小组的流程如图1。

①制备石灰乳的化学反应方程式是
②写出反应Ⅰ的离子反应方程式
③反应Ⅱ是工业冶炼金属镁的反应原理,写出反应Ⅱ的化学反应方程式
(2)乙实验小组的流程如图2。

①分液漏斗使用前需检漏,检漏的方法为
②写出步骤①发生反应的离子方程式
③在步骤③中,分离出溴单质的实验操作的名称是分液和
④在步骤①和步骤②之间设计了通入空气和水蒸气吹出的操作步骤的目的是
(3)图3各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某实验小组采用刻蚀废液(主要含 )制取
)制取 和
和 ,实验流程如下:
,实验流程如下:
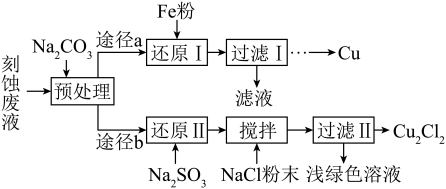
已知: 是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。“还原Ⅱ”中,
是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。“还原Ⅱ”中, 参与反应的离子方程式:
参与反应的离子方程式:_______ 。
 )制取
)制取 和
和 ,实验流程如下:
,实验流程如下:
已知:
 是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。“还原Ⅱ”中,
是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。“还原Ⅱ”中, 参与反应的离子方程式:
参与反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】“垃圾是放错了位置的资源”,应该分类回收。某化学兴趣小组拟采用如下处理方法回收废电池中的资源。
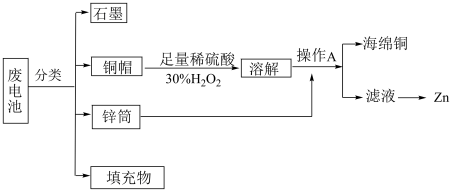
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2, 其正极的电极反应式为_____________________________________________ 。
(2)操作A的名称为____________________ 。
(3)铜帽溶解时加入H2O2的目的是___________________ (用化学方程式表示)。铜帽溶解完全后,可采用________ 方法除去溶液中过量的H2O2。
(4)填充物中可以回收得到氯化铵,写出氯化铵溶液中各离子浓度的大小顺序_________________________________ 。
(5)铜器在潮湿环境中发生的电化学腐蚀如图所示:

①负极反应的电极反应式________________________ 。
②环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,其若生成4.29g Cu2(OH)3Cl,则理论上耗氧气体积为________ L(标准状况)。

(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2, 其正极的电极反应式为
(2)操作A的名称为
(3)铜帽溶解时加入H2O2的目的是
(4)填充物中可以回收得到氯化铵,写出氯化铵溶液中各离子浓度的大小顺序
(5)铜器在潮湿环境中发生的电化学腐蚀如图所示:

①负极反应的电极反应式
②环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,其若生成4.29g Cu2(OH)3Cl,则理论上耗氧气体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】双氧水(H2O2的水溶液)具有重要用途。根据要求回答下列问题:
(1)双氧水常用于伤口消毒,这一过程利用了过氧化氢的_________________ (填过氧化氢的化学性质)。
(2)实验室可双氧水与MnO2制氧气,反应的化学方程式为_______________________ 。
(3)常温下,双氧水难于分解。若往双氧水中滴入少量的Fe2(SO4)3溶液,过氧化氢立即剧烈分解。研究发现,往双氧水中滴加Fe2(SO4)3溶液,发生如下两个反应(未配平):
Fe3+ + H2O2—— Fe2+ + O2↑+ H+、 Fe2+ + H2O2 + H+—— Fe3+ + H2O
①Fe2(SO4)3在双氧水分解中起到_________________ 作用。
②在反应Fe3+ + H2O2 —— Fe2+ + O2↑+ H+中,体现还原性的物质是_____________ ,该反应中氧化剂和还原剂的物质的量之比为_________________ 。
③往10mL 30%的双氧水溶液中滴入2-3滴0.1mol/L的Fe2(SO4)3溶液,直至反应停止。再往反应后所得溶液中滴入KSCN,将观察到的现象是_______________ 。
④试分析:实验室用双氧水制取氧气时,为快速获得氧气,是否可往双氧水中滴入少量FeSO4溶液来实现目的?答:_________ (填“可以”或“不可以”)。
(1)双氧水常用于伤口消毒,这一过程利用了过氧化氢的
(2)实验室可双氧水与MnO2制氧气,反应的化学方程式为
(3)常温下,双氧水难于分解。若往双氧水中滴入少量的Fe2(SO4)3溶液,过氧化氢立即剧烈分解。研究发现,往双氧水中滴加Fe2(SO4)3溶液,发生如下两个反应(未配平):
Fe3+ + H2O2—— Fe2+ + O2↑+ H+、 Fe2+ + H2O2 + H+—— Fe3+ + H2O
①Fe2(SO4)3在双氧水分解中起到
②在反应Fe3+ + H2O2 —— Fe2+ + O2↑+ H+中,体现还原性的物质是
③往10mL 30%的双氧水溶液中滴入2-3滴0.1mol/L的Fe2(SO4)3溶液,直至反应停止。再往反应后所得溶液中滴入KSCN,将观察到的现象是
④试分析:实验室用双氧水制取氧气时,为快速获得氧气,是否可往双氧水中滴入少量FeSO4溶液来实现目的?答:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
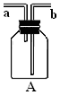
【推荐2】已知气体X是一种难溶于水的无色气体,常温时易与空气中的氧气迅速化合生成红棕色的气体Y。实验室常用以下反应制取X:3Cu+8HNO3=3Cu(NO3)2+2X↑+4H2O,则X为_____________ ;用装置A来收集NO气体,正确的操作步骤是:_________________

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上时就会造成人畜中毒,请回答:
(1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式___________ 。
(2)实验室用硫酸铜溶液吸收PH3时的化学方程式24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4,当吸收2.2molPH3转移电子______ mol
(3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1,写出相应的化学方程式______ 。
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):COS H2S
H2S Na2S
Na2S M溶液+H2
M溶液+H2
①组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是_______ .
②已知M溶液中硫元素的主要存在形式为S2O32﹣,则反应Ⅲ中生成S2O32﹣的离子方程式为________ .
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol),由图象分析可知,a点时M溶液中除S2O32—外,还有____ (填含硫微粒的离子符号)。

(1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式
(2)实验室用硫酸铜溶液吸收PH3时的化学方程式24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4,当吸收2.2molPH3转移电子
(3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1,写出相应的化学方程式
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):COS
 H2S
H2S Na2S
Na2S M溶液+H2
M溶液+H2①组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是
②已知M溶液中硫元素的主要存在形式为S2O32﹣,则反应Ⅲ中生成S2O32﹣的离子方程式为
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol),由图象分析可知,a点时M溶液中除S2O32—外,还有

您最近一年使用:0次



