已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__ 。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离平衡常数Kb=__ 。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__ ,溶液中离子浓度大小关系为__ 。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=__ 。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__ 。(已知lg2=0.3)
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
更新时间:2019-12-19 21:13:29
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】水溶液中的离子平衡是中学学习的一个重要内容。
(1)下列溶液①0.10mol•L-1盐酸②0.10mol•L-1H2SO4溶液③0.10mol•L-1CH3COONa溶液④0.10mol•L-1NH4Cl溶液⑤0.10mol•L-1NaOH溶液,按pH由小到大顺序为____ (填序号)。
(2)在一定温度下,将一定质量冰醋酸加水稀释过程中溶液的导电能力变化如图所示。
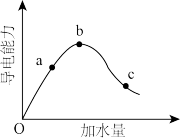
a、b、c三点对应的溶液中,CH3COOH电离程度最大的是____ ;a、b、c三点溶液用1mol•L-1NaOH溶液中和,消耗NaOH溶液体积大小关系____ 。
(3)已知25℃时,CO 水解反应的一级平衡常数Kh=2×10-4mol•L-1,写出此Kh的表达式
水解反应的一级平衡常数Kh=2×10-4mol•L-1,写出此Kh的表达式____ ;当溶液中c(HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=___ 。
(4)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有雾形成,并有带刺激性气味气体溢出,该气体可使品红溶液褪色,请根据实验现象写出SOCl2和H2O反应的化学方程式:____ 。
(5)等浓度的盐酸、氨水中,由水电离出的H+浓度c盐酸(H+)____ c氨水(H+)(填“>”“<”或“=”)。在25℃下,将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合充分反应后溶液呈中性。则反应后溶液存在的离子浓度由大到小顺序为____ ,用含a的代数式表示NH3•H2O的电离常数Kb=____ 。
(1)下列溶液①0.10mol•L-1盐酸②0.10mol•L-1H2SO4溶液③0.10mol•L-1CH3COONa溶液④0.10mol•L-1NH4Cl溶液⑤0.10mol•L-1NaOH溶液,按pH由小到大顺序为
(2)在一定温度下,将一定质量冰醋酸加水稀释过程中溶液的导电能力变化如图所示。

a、b、c三点对应的溶液中,CH3COOH电离程度最大的是
(3)已知25℃时,CO
 水解反应的一级平衡常数Kh=2×10-4mol•L-1,写出此Kh的表达式
水解反应的一级平衡常数Kh=2×10-4mol•L-1,写出此Kh的表达式 ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=(4)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有雾形成,并有带刺激性气味气体溢出,该气体可使品红溶液褪色,请根据实验现象写出SOCl2和H2O反应的化学方程式:
(5)等浓度的盐酸、氨水中,由水电离出的H+浓度c盐酸(H+)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】I.已知:在相同条件下醋酸与氨水电离程度相同。浓度均为 的下列溶液:
的下列溶液:
①硫酸②醋酸③氢氧化钠④氯化铵⑤醋酸铵⑥硫酸铵⑦硫酸氢铵⑧氨水
(1)写出醋酸溶液与氨水反应的离子方程式___________
(2)①、②、③、④四种溶液中由水电离出的 浓度由大到小的顺序是(填序号)
浓度由大到小的顺序是(填序号)_____ 。
(3)④、⑤、⑥、⑦、⑧五种溶液中 浓度由大到小的顺序是(填序号)
浓度由大到小的顺序是(填序号) ___ 。
II.已知 时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(4)浓度相等的下列溶液,它们的 值由大到小排列的顺序是___________(用编号填写)
值由大到小排列的顺序是___________(用编号填写)
(5)根据表中平衡常数数据,写出亚硫酸与碳酸氢钠溶液反应的离子方程式___
(6) 时,
时, 与
与 的混合溶液,若测得混合液
的混合溶液,若测得混合液 ,则溶液中c(CH3COO-)-c(Na+)
,则溶液中c(CH3COO-)-c(Na+)__ (填准确数值)。
 的下列溶液:
的下列溶液:①硫酸②醋酸③氢氧化钠④氯化铵⑤醋酸铵⑥硫酸铵⑦硫酸氢铵⑧氨水
(1)写出醋酸溶液与氨水反应的离子方程式
(2)①、②、③、④四种溶液中由水电离出的
 浓度由大到小的顺序是(填序号)
浓度由大到小的顺序是(填序号)(3)④、⑤、⑥、⑦、⑧五种溶液中
 浓度由大到小的顺序是(填序号)
浓度由大到小的顺序是(填序号) II.已知
 时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:| 化学式 |  | 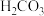 |  |  |
| 电离平衡常数 |  |   |  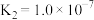 | 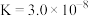 |
 值由大到小排列的顺序是___________(用编号填写)
值由大到小排列的顺序是___________(用编号填写)A. | B. | C. | D. |
(6)
 时,
时, 与
与 的混合溶液,若测得混合液
的混合溶液,若测得混合液 ,则溶液中c(CH3COO-)-c(Na+)
,则溶液中c(CH3COO-)-c(Na+)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】电解质的水溶液中存在电离平衡,请根据所学知识回答下列问题:
(1)醋酸是常见的弱酸。
①常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________ (填序号)。
a.c(H+) b. c.c(H+)∙c(OH-)
c.c(H+)∙c(OH-)
d.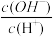 e.
e.
②请设计一个简单的实验验证醋酸与碳酸的酸性强弱___________
(2)常温下,H2C2O4和 的电离平衡常数如下:
的电离平衡常数如下:
①根据以上信息可知,Na2SO4溶液呈___________ (填“酸”“碱”或“中”)性。
②少量Na2C2O4溶液与过量NaHSO4溶液反应的离子方程式为___________ 。
③室温下,pH=1的H2SO4溶液中,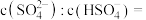
___________ 。
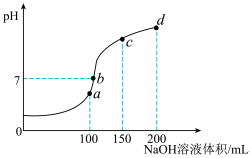
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是___________ 点,在b点,溶液中各离子浓度由大到小的排列顺序是___________ 。
(1)醋酸是常见的弱酸。
①常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
a.c(H+) b.
 c.c(H+)∙c(OH-)
c.c(H+)∙c(OH-)d.
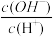 e.
e.
②请设计一个简单的实验验证醋酸与碳酸的酸性强弱
(2)常温下,H2C2O4和
 的电离平衡常数如下:
的电离平衡常数如下:| 化学式 | H2C2O4 |  |
| 电离平衡常数 | 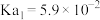 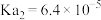 |  |
①根据以上信息可知,Na2SO4溶液呈
②少量Na2C2O4溶液与过量NaHSO4溶液反应的离子方程式为
③室温下,pH=1的H2SO4溶液中,
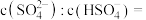
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】硫酸和醋酸都是重要的化工原料,在生产、科研中用途广泛。回答下列问题:
(1)①某温度(t℃)时,水的离子积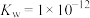 ,则t℃
,则t℃___________ 25℃(填“>”“<”或“=”)。此温度下,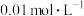 的氨水中
的氨水中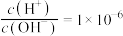 ,则该氨水溶液的pH=
,则该氨水溶液的pH=___________ ;
②将室温下pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液的pH=3,则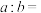
___________ 。
(2)某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:
①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
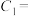
___________ ,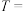
___________ 。
②该实验中通过观察___________ 实验现象判断反应的快慢。为此,该实验中三种溶液混合的顺序不合理的是___________ 。
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
c.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
(3)25℃时,某Na2SO4溶液中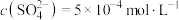 ,取该溶液1mL加水稀释至100mL,则稀释后溶液中
,取该溶液1mL加水稀释至100mL,则稀释后溶液中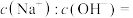
___________ 。
(4)在室温下,蒸馏水稀释0.01mol/LHA(HA为弱酸)溶液时,下列呈减小趋势的是___________。
(1)①某温度(t℃)时,水的离子积
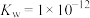 ,则t℃
,则t℃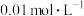 的氨水中
的氨水中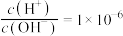 ,则该氨水溶液的pH=
,则该氨水溶液的pH=②将室温下pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液的pH=3,则
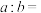
(2)某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:
①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
| 实验编号 | T/K |  | 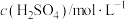 | 实验目的 |
| I | 298 | 1 | 0.1 | 实验I和II探究温度对该反应速率的影响;实验I和III探究反应物浓度对该反应速率的影响 |
| II | 308 |  |  | |
| III | T | 1 | 0.2 |
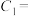
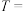
②该实验中通过观察
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
c.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
(3)25℃时,某Na2SO4溶液中
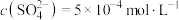 ,取该溶液1mL加水稀释至100mL,则稀释后溶液中
,取该溶液1mL加水稀释至100mL,则稀释后溶液中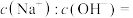
(4)在室温下,蒸馏水稀释0.01mol/LHA(HA为弱酸)溶液时,下列呈减小趋势的是___________。
| A.水的电离程度 | B. |
C.溶液中 和 和 的乘积 的乘积 | D.溶液中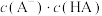 的值 的值 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题
(1)在常温下,将浓度均为 的硫酸与氢氧化钠等体积混合后(假设混合后溶液的体积为混合前溶液的体积之和),溶液的pH=
的硫酸与氢氧化钠等体积混合后(假设混合后溶液的体积为混合前溶液的体积之和),溶液的pH=___________ (已知lg5=0.7)
(2)25℃时,pH均为2的三种酸的电离平衡常数如下表:
试回答下列问题:
①下列四种离子结合质子能力最强的是___________ (填序号)。
a. b.
b. c.
c. d.
d.
②常温下将 溶液加水稀释过程中,下列表达式的数据一定变大的是
溶液加水稀释过程中,下列表达式的数据一定变大的是___________ 。
A. B.
B. C.
C. D.
D. E.
E.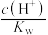
③体积均为10mL,pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。
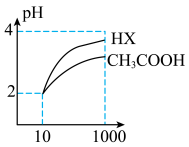
稀释后,HX溶液中水电离出来的
___________ (填“>”、“<”或“=”)醋酸溶液中水电离出来的 ;
; 的电离平衡常数
的电离平衡常数___________ (填“>”、“<”或“=”)HX的电离平衡常数,理由是___________ 。
(1)在常温下,将浓度均为
 的硫酸与氢氧化钠等体积混合后(假设混合后溶液的体积为混合前溶液的体积之和),溶液的pH=
的硫酸与氢氧化钠等体积混合后(假设混合后溶液的体积为混合前溶液的体积之和),溶液的pH=(2)25℃时,pH均为2的三种酸的电离平衡常数如下表:
| 化学式 |  |  |  |
| 电离平衡常数 |  |  、 、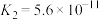 |  |
①下列四种离子结合质子能力最强的是
a.
 b.
b. c.
c. d.
d.
②常温下将
 溶液加水稀释过程中,下列表达式的数据一定变大的是
溶液加水稀释过程中,下列表达式的数据一定变大的是A.
 B.
B. C.
C. D.
D. E.
E.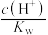
③体积均为10mL,pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。

稀释后,HX溶液中水电离出来的

 ;
; 的电离平衡常数
的电离平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1) 25℃时,物质的量浓度均为0.1mol/L的下列四种溶液:
① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是_________________________ 。
(2)清除水瓶水垢中含有的CaSO4的方法是:将水瓶中的水垢用碳酸钠饱和溶液浸泡后加水冲洗,再加入盐酸即可,请写出上述反应的化学方程式:________________ 、_____________ 。
(3)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验事实 证明之____________________ 。
(4)电离平衡常数(用K表示)是一种平衡常数。电离平衡常数的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
氢氟酸的电离方程式为____________________ ,次氯酸电离平衡常数的表达式为_______________ 。
(5)25℃时,pH=3的HF溶液中,未电离的氟化氢物质的量浓度为_______________________ mol/L。
① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是
(2)清除水瓶水垢中含有的CaSO4的方法是:将水瓶中的水垢用碳酸钠饱和溶液浸泡后加水冲洗,再加入盐酸即可,请写出上述反应的化学方程式:
(3)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的
(4)电离平衡常数(用K表示)是一种平衡常数。电离平衡常数的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(K) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
氢氟酸的电离方程式为
(5)25℃时,pH=3的HF溶液中,未电离的氟化氢物质的量浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
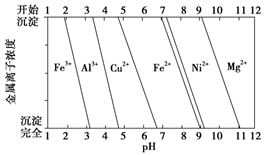
【推荐1】为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为 7.0、8.0 时过滤沉淀,结合下图信息推断该合金中除铜外一定含有________ 。

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】磷化氢(PH3)是一种剧毒气体,是最常用的高效熏蒸杀虫剂,也是一种电子工业原料。
(1)在密闭粮仓放置的磷化铝(AlP)片剂,遇水蒸气放出PH3气体,该反应的化学方程式为________ 。
(2)利用反应PH3+3HgCl2=P(HgCl)3+3HCl,可准确测定微量的PH3。
①HgCl2溶液几乎不导电,说明HgCl2属于____________ (填“共价”或“离子”)化合物。
②通过测定溶液________ 变化,可测定一定体积空气中PH3的浓度。
(3)PH3的一种工业制法涉及的物质转化关系如图所示:
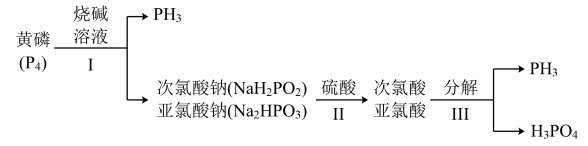
①亚磷酸属于________ 元酸。
②当反应Ⅰ生成的n(NaH2PO2)∶n(Na2HPO3)=3∶1时,参加反应的n(P4)∶n(NaOH)=________ 。
(4)一种用于处理PH3废气的吸收剂成分为次氯酸钙80%、锯木屑(疏松剂)15%、活性炭2.5%、滑石粉(防结块)2.5%。
①次氯酸钙将PH3氧化为H3PO4的化学方程式为_________ 。
②空气中的水蒸气可加快PH3的氧化过程,其原因可能是_______ 。
(1)在密闭粮仓放置的磷化铝(AlP)片剂,遇水蒸气放出PH3气体,该反应的化学方程式为
(2)利用反应PH3+3HgCl2=P(HgCl)3+3HCl,可准确测定微量的PH3。
①HgCl2溶液几乎不导电,说明HgCl2属于
②通过测定溶液
(3)PH3的一种工业制法涉及的物质转化关系如图所示:

①亚磷酸属于
②当反应Ⅰ生成的n(NaH2PO2)∶n(Na2HPO3)=3∶1时,参加反应的n(P4)∶n(NaOH)=
(4)一种用于处理PH3废气的吸收剂成分为次氯酸钙80%、锯木屑(疏松剂)15%、活性炭2.5%、滑石粉(防结块)2.5%。
①次氯酸钙将PH3氧化为H3PO4的化学方程式为
②空气中的水蒸气可加快PH3的氧化过程,其原因可能是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】NH4A1(SO4)2和Na2CO3常作食品加工中的食品添加剂;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)纯碱(Na2CO3)溶液呈_____ (填“酸性”、“碱性”或“中性”),原因是__________ (用离子方程式说明)。
(2)均为0.1mol/L的几种电解质溶液的pH随温度变化的曲线如图甲所示。
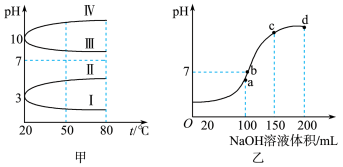
①其中符合0.1 mol/L Na2CO3溶液的pH随温度变化的曲线是_____ (填罗马数字),导致Na2CO3溶液的pH随温度变化的原因是__ 。
②20℃时(KW=1.0×10﹣14),0.1mol/L Na2CO3溶液中c(Na+)-2c(CO )-c(HCO
)-c(HCO )=
)=__ mol/L
(1)纯碱(Na2CO3)溶液呈
(2)均为0.1mol/L的几种电解质溶液的pH随温度变化的曲线如图甲所示。

①其中符合0.1 mol/L Na2CO3溶液的pH随温度变化的曲线是
②20℃时(KW=1.0×10﹣14),0.1mol/L Na2CO3溶液中c(Na+)-2c(CO
 )-c(HCO
)-c(HCO )=
)=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】常温下,向 溶液中加入
溶液中加入 溶液,可观察到的现象是
溶液,可观察到的现象是______ ,发生反应的离子方程式为______ ,若将所得悬浊液的pH值调整为4,则溶液中 的溶液为
的溶液为______ 
 已知常温下
已知常温下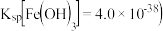 。
。
 溶液中加入
溶液中加入 溶液,可观察到的现象是
溶液,可观察到的现象是 的溶液为
的溶液为
 已知常温下
已知常温下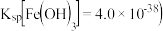 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】由铁铬合金(主要成分Cr、Fe,含少量Co、Ni等)可以制取Cr2O3、FeC2O4·2H2O和LiFePO4.实验流程如下:

设计由沉铁后的滤液(含Cr3+和少量Fe2+)制备Cr2O3的实验方案:_______ ,过滤、洗涤、干燥、500°C煅烧。已知:①P507萃取剂密度小于水,萃取Fe3+时萃取率与溶液pH的关系如图所示。②该实验中Cr3+在pH6.0时开始沉淀,pH=8.0时沉淀完全。pH=12时Cr(OH)3开始溶解。实验中须选用试剂:P507萃取剂、H2O2、NaOH溶液]
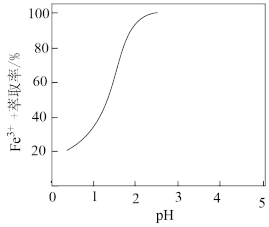

设计由沉铁后的滤液(含Cr3+和少量Fe2+)制备Cr2O3的实验方案:

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)相同温度下等物浓度的下列溶液中,A.NH4C1 B.NH4HCO3C.NH4HSO4D.(NH4)2SO4
① pH值由大到小的顺序是___________________ (用对应的字母填写)。
② NH4+离子浓度由大到小的顺序是___________________ (用对应的字母填写)。
(2)25℃向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。已知该温度下AgCl的Ksp=l.0×l0-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=_____________ 。
②完全沉淀后,溶液的pH=____________ 。
(3)弱酸及其盐在水中存在多种平衡关系。已知NaA水溶液呈碱性,常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
①已知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为___________________ 。
②向该混合物中再加0.03mol NaOH,溶液中n(A-) +n(OH-)-n(H+) =________ 。
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5 mol·L-1Fe3+和0.26 mol·L-1Cu2+,欲使Fe3+完全沉淀[c(Fe3+) ≤ 4×l0-5mol·L-1]而Cu2+不沉淀,则需控制溶液pH的范围为_________ 。[KspCu(OH)2= 2.6×l0-19;KspFe(OH)3= 4×l0-38]
① pH值由大到小的顺序是
② NH4+离子浓度由大到小的顺序是
(2)25℃向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。已知该温度下AgCl的Ksp=l.0×l0-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=
②完全沉淀后,溶液的pH=
(3)弱酸及其盐在水中存在多种平衡关系。已知NaA水溶液呈碱性,常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
①已知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为
②向该混合物中再加0.03mol NaOH,溶液中n(A-) +n(OH-)-n(H+) =
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5 mol·L-1Fe3+和0.26 mol·L-1Cu2+,欲使Fe3+完全沉淀[c(Fe3+) ≤ 4×l0-5mol·L-1]而Cu2+不沉淀,则需控制溶液pH的范围为
您最近一年使用:0次



