2024高二·全国·专题练习
1 . ZnO是电镀、涂料、有机合成等化学工业的重要原料。某课题组设计由含锌工业废料(含Fe、Cu、Mn等杂质)生产ZnO的工艺流程如下:
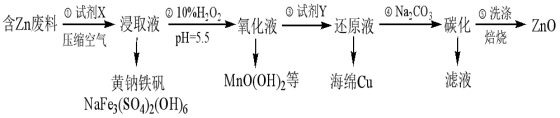
已知:黄钠铁矾在pH为1.5,温度为90℃时完全沉淀,且易于过滤。
(1)试剂X为Na2SO4和___________ 的混合液,步骤①的浸取液里除含有Cu2+、Mn2+以外,还含有的金属离子有___________ ,写出Cu溶解变为Cu2+离子方程式___________ 。
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式___________ 。
(3)步骤③加入试剂Y的目的是置换出Cu,则Y的化学式为___________ ,整个工艺流程中可以循环使用的试剂是___________ 。
(4)步骤⑤中检验沉淀是否洗涤干净的操作方法是___________ 。
(5)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3·xZn(OH)2·yH2O],取该样品6.82g,充分灼烧后测得残留物质量为4.86g,将所得气体通入足量澄清石灰水中,得到2.00g沉淀,则此碱式碳酸锌的化学式是___________ 。

已知:黄钠铁矾在pH为1.5,温度为90℃时完全沉淀,且易于过滤。
(1)试剂X为Na2SO4和
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式
(3)步骤③加入试剂Y的目的是置换出Cu,则Y的化学式为
(4)步骤⑤中检验沉淀是否洗涤干净的操作方法是
(5)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3·xZn(OH)2·yH2O],取该样品6.82g,充分灼烧后测得残留物质量为4.86g,将所得气体通入足量澄清石灰水中,得到2.00g沉淀,则此碱式碳酸锌的化学式是
您最近一年使用:0次
2 . 铵明矾晶体的化学式为 ,以铵明矾为原料可实现如图转化。
,以铵明矾为原料可实现如图转化。 与题中阳离子不形成配合物,固体A为纯净物。
与题中阳离子不形成配合物,固体A为纯净物。
(1)铵明矾晶体“隔绝空气加热”分解产物中含硫化合物有___________ 。
(2)步骤III中生成白色沉淀C反应的化学方程式为___________ 。
(3)合成铵明矾过程中常使用过量的硫酸铵,一个作用是抑制硫酸铝水解,另一个重要作用是___________ 。
(4)设计实验验证固体A含有的金属元素:___________ 。
(5)步骤I中,铵明矾晶体在各温度段内受热“失重计算值”如表所示。(失重计算值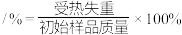 )
)
通过上述数据可判断,在温度区间___________ ℃,铵明矾基本上失去了结晶水。
 ,以铵明矾为原料可实现如图转化。
,以铵明矾为原料可实现如图转化。
 与题中阳离子不形成配合物,固体A为纯净物。
与题中阳离子不形成配合物,固体A为纯净物。(1)铵明矾晶体“隔绝空气加热”分解产物中含硫化合物有
(2)步骤III中生成白色沉淀C反应的化学方程式为
(3)合成铵明矾过程中常使用过量的硫酸铵,一个作用是抑制硫酸铝水解,另一个重要作用是
(4)设计实验验证固体A含有的金属元素:
(5)步骤I中,铵明矾晶体在各温度段内受热“失重计算值”如表所示。(失重计算值
 )
)| 温度区间/℃ | 18→190 | 190→430 | 430→505 | 505→900 |
| 失重计算值/% | 39.20 | 7.80 | 13.00 | 26.00 |
您最近一年使用:0次
解题方法
3 . 丙烯是重要的有机化合物,具有广泛应用。
Ⅰ.工业上以苯和丙烯为原料合成聚碳酸酯的生产原理如下。
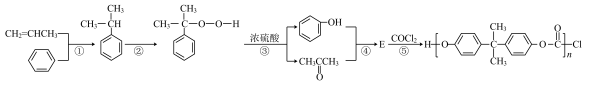
(1)丙酮与水互溶的原因是______ 。
(2)反应②的原子利用率为100%,加入的氧化剂是______ (填分子式)。
(3)蒸馏分离丙酮、苯酚前,需要除去剩余硫酸,最适宜选择______ (选填序号)。
A.NaOH B. C.
C.
(4)E的分子式为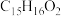 ,则其结构简式为
,则其结构简式为______ 。
Ⅱ.开发新型高效、无毒的催化剂,以丙烯为还原剂脱硝除去NO。
(5)对Mn基催化剂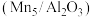 分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、
分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、 的选择性随温度变化曲线分别如图-1、图-2所示。
的选择性随温度变化曲线分别如图-1、图-2所示。
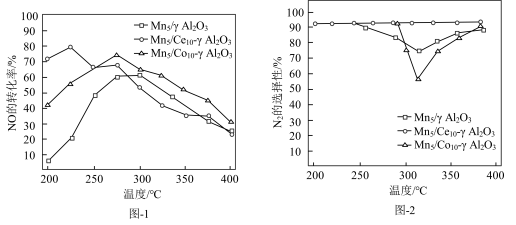
添加助剂______ (选填“Ce”、“Co”)改善催化剂的催化活性效果更加显著。
(6)研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图-3为丙烯脱硝机理。
参与反应,图-3为丙烯脱硝机理。
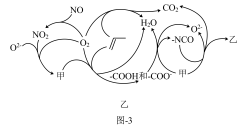
①图中,甲为______ ,乙为______ 。(用化学式表示)
②若参加反应的丙烯与NO物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为______ 。
Ⅰ.工业上以苯和丙烯为原料合成聚碳酸酯的生产原理如下。

(1)丙酮与水互溶的原因是
(2)反应②的原子利用率为100%,加入的氧化剂是
(3)蒸馏分离丙酮、苯酚前,需要除去剩余硫酸,最适宜选择
A.NaOH B.
 C.
C.
(4)E的分子式为
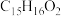 ,则其结构简式为
,则其结构简式为Ⅱ.开发新型高效、无毒的催化剂,以丙烯为还原剂脱硝除去NO。
(5)对Mn基催化剂
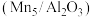 分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、
分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、 的选择性随温度变化曲线分别如图-1、图-2所示。
的选择性随温度变化曲线分别如图-1、图-2所示。
添加助剂
(6)研究表明催化剂添加助剂后催化活性提高的原因是形成活性
 参与反应,图-3为丙烯脱硝机理。
参与反应,图-3为丙烯脱硝机理。
①图中,甲为
②若参加反应的丙烯与NO物质的量之比为
 ,则反应的化学方程式为
,则反应的化学方程式为
您最近一年使用:0次
名校
4 . B、Al、Ga位于元素周期表中第ⅢA族. 为无色气体,主要用作有机合成中的催化剂,极易水解生成
为无色气体,主要用作有机合成中的催化剂,极易水解生成 (
( 在水中完全电离为
在水中完全电离为 和
和 、)和硼酸(
、)和硼酸( ).硼酸(
).硼酸( )是一元弱酸,和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯
)是一元弱酸,和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯 ,硼酸甲酯主要用作热稳定剂、木材防腐剂等,还能和NaH反应制备
,硼酸甲酯主要用作热稳定剂、木材防腐剂等,还能和NaH反应制备 ,
, 是常用的还原剂.
是常用的还原剂. 是常用的耐火材料,还能用作炼铝的原料,高温下
是常用的耐火材料,还能用作炼铝的原料,高温下 和焦炭在氯气的氛围中反应生成
和焦炭在氯气的氛围中反应生成 ,
, 一般以二聚分子(
一般以二聚分子( )形式存在.GaN的结构与晶体硅类似是第三代半导体研究的热点.下列化学反应表示正确的是
)形式存在.GaN的结构与晶体硅类似是第三代半导体研究的热点.下列化学反应表示正确的是
 为无色气体,主要用作有机合成中的催化剂,极易水解生成
为无色气体,主要用作有机合成中的催化剂,极易水解生成 (
( 在水中完全电离为
在水中完全电离为 和
和 、)和硼酸(
、)和硼酸( ).硼酸(
).硼酸( )是一元弱酸,和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯
)是一元弱酸,和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯 ,硼酸甲酯主要用作热稳定剂、木材防腐剂等,还能和NaH反应制备
,硼酸甲酯主要用作热稳定剂、木材防腐剂等,还能和NaH反应制备 ,
, 是常用的还原剂.
是常用的还原剂. 是常用的耐火材料,还能用作炼铝的原料,高温下
是常用的耐火材料,还能用作炼铝的原料,高温下 和焦炭在氯气的氛围中反应生成
和焦炭在氯气的氛围中反应生成 ,
, 一般以二聚分子(
一般以二聚分子( )形式存在.GaN的结构与晶体硅类似是第三代半导体研究的热点.下列化学反应表示正确的是
)形式存在.GaN的结构与晶体硅类似是第三代半导体研究的热点.下列化学反应表示正确的是A.制备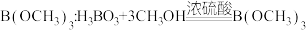 |
B. 和水反应: 和水反应: |
C.高温下 、焦炭在氯气中反应: 、焦炭在氯气中反应: |
D.用石墨作电极电解 的阴极电极方程式: 的阴极电极方程式: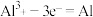 |
您最近一年使用:0次
名校
5 . 研究氨的制备、应用及氨氮的去除有重要意义。
(1)在固定体积的密闭容器中,进行如下化学反应: ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。
①试判断
_______  (填写“>”“=”或“<”)
(填写“>”“=”或“<”)
②一定温度下,在 密闭容器中充入
密闭容器中充入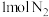 和
和 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的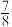 ,则
,则 的转化率
的转化率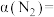
_______ ,以 表示该过程的反应速率
表示该过程的反应速率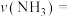
_______ 。
(2)氨的应用。以 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:
I. 和
和 生成
生成 ;
;
Ⅱ. 分解生成
分解生成 。
。
反应过程中能量变化如图所示。 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为_______ 。
②结合反应过程中能量变化示意图,下列说法正确的是_______ (填序号)。
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极, 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。
①写出 去除氨气的化学反应方程式
去除氨气的化学反应方程式_______ 。
②阴极区加入 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用_______ 。
用 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。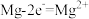 ,
, 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
④反应1h以后,氨氮去除率随时间的延长反而下降的原因是_______ 。
(1)在固定体积的密闭容器中,进行如下化学反应:
 ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。| T/K | 298 | 398 | 498 |
| 平衡常数K | 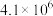 |  |  |

 (填写“>”“=”或“<”)
(填写“>”“=”或“<”)②一定温度下,在
 密闭容器中充入
密闭容器中充入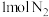 和
和 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的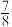 ,则
,则 的转化率
的转化率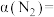
 表示该过程的反应速率
表示该过程的反应速率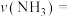
(2)氨的应用。以
 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:I.
 和
和 生成
生成 ;
;Ⅱ.
 分解生成
分解生成 。
。反应过程中能量变化如图所示。

 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为②结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极,
 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。①写出
 去除氨气的化学反应方程式
去除氨气的化学反应方程式②阴极区加入
 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用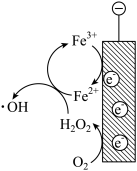
用
 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。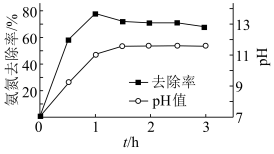
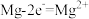 ,
, 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:④反应1h以后,氨氮去除率随时间的延长反而下降的原因是
您最近一年使用:0次



